微RNA-296、血管内皮生长因子-B 的表达与冠心病患者冠脉病变程度的关系
2024-03-13郝恩刚刘丹青
李 震 郝恩刚 刘丹青
1.山东省聊城市第二人民医院检验科,山东临清 252600;2.山东省聊城市第二人民医院心内科,山东临清 252600;3.山东省临清市人民医院检验科,山东临清 252600
冠心病(coronary heart disease,CHD)是心血管系统常见疾病,近年来CHD 发病率在全球范围内上升,已成为我国乃至全球人类死亡的最常见因素之一[1-3]。冠状动脉狭窄(coronary artery stenosis,CAS)程度对CHD 患者选择最佳治疗方案至关重要,并与心血管风险分层密切相关[4]。因此,需要一个潜在而有效的生物标志物来评估CHD 患者的CAS 程度。研究表明,动脉粥样硬化(atherosclerosis,AS)参与CHD 发生、发展[5]。微RNA(microRNA,miRNA)是一种长度为19~24 个核苷酸的单链非编码RNA,能通过调控多种机制参与CHD 过程[6]。miR-296 被报道在CHD 个体中差异表达[7]。过表达miR-296 能促进心肌细胞增殖,改善心肌梗死后心功能[8]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成的重要介质,能通过炎症反应促进AS 发生、发展[9]。但有关miR-296、VEGF-B 与CHD 患者CAS 程度的相关性报道有限。本研究分析CHD 患者miR-296、VEGF-B表达与CAS 的关系,以期为CHD 诊治提供一定参考。
1 资料与方法
1.1 一般资料
选取2019 年1 月至2022 年11 月山东省聊城市第二人民医院收治的93 例CHD 患者,其中,女40例,男53 例;年龄42~73 岁,平均(56.71±6.50)岁;体重指数18.71~31.49 kg/m2,平均(23.94±2.63)kg/m2。纳入标准:①符合《临床冠心病诊断与治疗指南》[10]CHD诊断标准;②初次确诊,入院前未接受相关治疗。排除标准:①冠状动脉造影禁忌证;②既往冠状动脉介入治疗史;③先天性心脏病;④妊娠期或哺乳期;⑤合并其他心肌病;⑥血液、免疫、神经系统疾病,恶性肿瘤;⑦严重肝、肾功能障碍;⑧近1 个月内急慢性感染。本研究经山东省聊城市第二人民医院伦理委员会批准(【2023】医伦审第(04)号)。
1.2 研究方法
1.2.1 实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,Rt-PCR) 采集CHD 组空腹静脉血6 ml,其中3 ml 血液抗凝后使用TRIzol 试剂(赛默飞世尔科技公司,编号:15596018CN)提取全血总RNA,TaKaRa PrimeScrip RT 试剂盒[宝日医生物技术(北京)有限公司,编号:RR037A]合成cDNA。按照Cham QTMunivers SYBR qPCR Master Mix(Vazyme)试剂盒(南京诺唯赞生物科技股份有限公司,编号:Q111-02)说明书进行RT-PCR。反应体系:互补DNA 1 μl、2×HieffRobust PCR Master Mix 10 μl、正反向引物各2.5μl,ddH2O 加至总体积25 μl;反应条件:95 ℃90 s、95 ℃30 s、63 ℃30 s、72 ℃15 s,循环40 次后收集Ct 值,miR-296 以U6 为内参校正,2-ΔΔCt法计算miR-296相对表达量。miR-296:正向引物:5’-GGGGGGGAGGCCCCGA-3’,反向引物:5’-AGTGCAGGGTCCGAGGTATT-3’;U6:正向引物:5’-ACACGCACAAACGAGAAAGG-3’,反向引物:5’-AGTGCAGGGTCCGAGGTATT-3’。剩余3 ml 血液1 500 g 离心15 min 分离血清,保存于-80 ℃冰箱。采用酶联免疫吸附试验试剂盒(上海烜雅生物科技有限公司,编号:XY0196A)检测VEGF-B 水平。
1.2.2 结合位点预测与双萤光素酶报告实验 经Star-Base、TargetScan、miRWalk 数据库预测miR-296 与VEGF-B 的结合位点。构建野生型miR-296(miR-296-wild type,miR-296-wt)、野生型VEGF-B(VEGF-B-wild type,VEGF-B-wt)和突变型miR-296(miR-296-mutant,miR-296-mut)、突变型VEGF-B(VEGF-B-mutant,VEGF-B-mut)萤光素酶载体,接下来将载体共转染至H9C2 细胞中。转染48 h 后使用双萤光素酶测定法测定萤光素酶活性。
1.2.3 冠状动脉造影 所有研究对象入院后均进行冠状动脉造影(荷兰飞利浦血管造影机,型号:FD20),记录病变支数,参考Gensini 积分评估CAS 程度,每处冠脉病变积分为狭窄程度[狭窄直径<25%(1 分)、25%~<50%(2 分)、50%~<75%(4 分)、75%~<90%(8 分)、90%~<99%(16 分)、≥99%(32分)]×冠脉分支(右冠近、中、远段和后降支均×1;后侧支×0.5;远段和后降支×1;左回旋支近段×2.5;第一对角支×1;第二对角支×0.5),总分为所有病变积分之和[11]。由2 名专业造影诊断医生独立评分,取一致结果。根据病变支数将CHD 患者分为单支病变组38 例、双支病变组33 例、多支病变组22 例。根据Gensini 积分将CHD 患者分为轻度CAS 组(<30 分,30 例)、中度CAS 组(31~60 分,34 例)、重度CAS 组(>60 分,29例)。
1.4 统计学方法
采用SPSS 28.0 统计学软件进行数据分析。计量资料符合正态分布采用均数±标准差()表示,两组比较采用t 检验,多组间比较采用单因素方差分析,组间两两比较LSD-t 检验,计量资料不符合正态分布采用中位数(四分位数)[M(P25,P75)]表示,比较采用非参数检验;计数资料采用例数或百分率表示,比较采用χ2检验。相关性采用Pearson 相关系数或Spearman 相关系数。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同CAS 程度CHD 患者临床基线特征比较
不同CAS 程度CHD 患者临床基线特征比较,差异无统计学意义(P>0.05)。见表1。
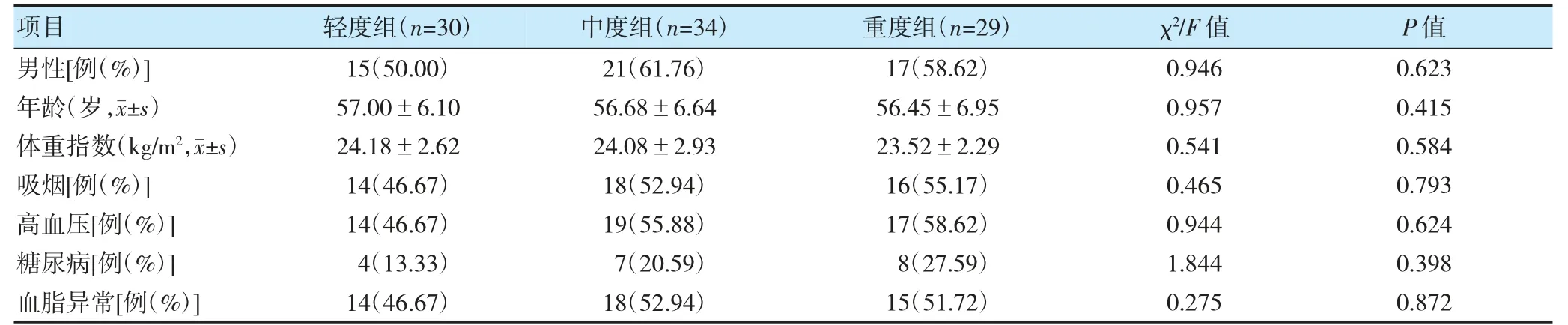
表1 不同CAS 程度CHD 患者临床基线特征比较
2.2 不同冠状动脉病变支数CHD 患者临床基线特征比较
不同冠状动脉病变支数CHD 患者临床基线特征比较,差异无统计学意义(P>0.05)。见表2。
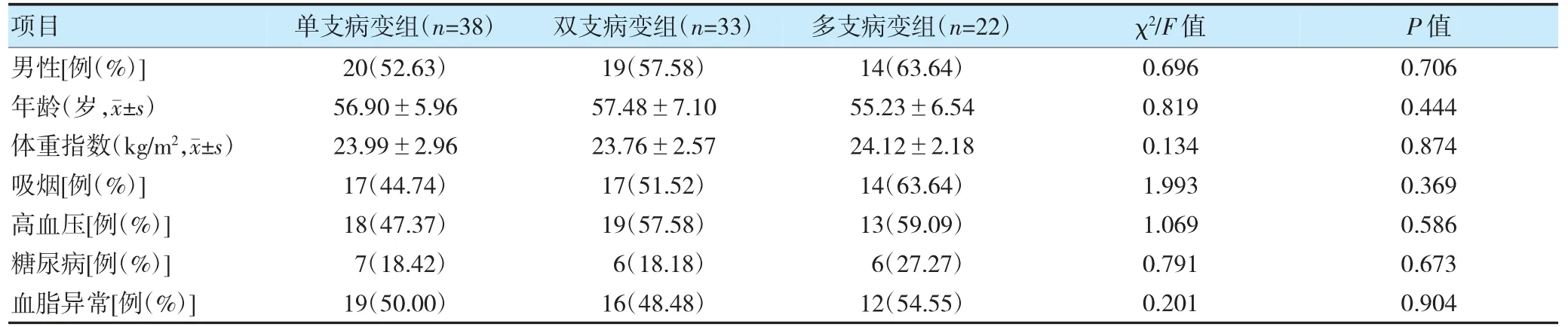
表2 不同冠状动脉病变支数CHD 患者临床基线特征比较
2.3 不同CAS 程度CHD 患者miR-296、VEGF-B 表达比较
重度组miR-296 表达低于轻度组和中度组,VEGF-B 水平高于轻度组和中度组,且中度组miR-296 表达低于轻度组,VEGF-B 水平高于轻度组,差异有统计学意义(P<0.05)。见表3。
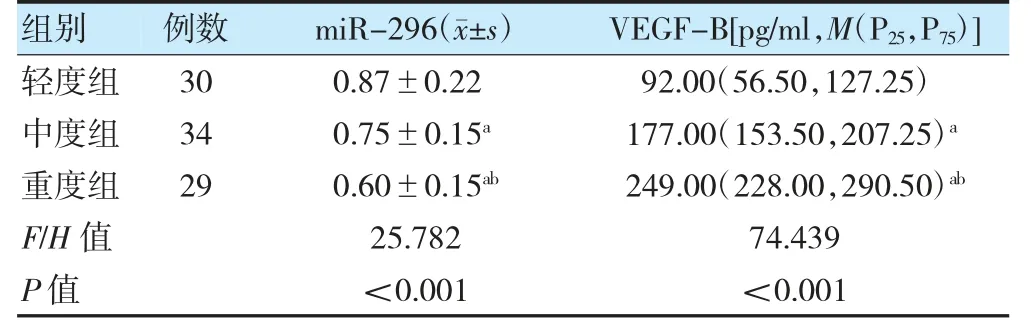
表3 不同CAS 程度CHD 患者miR-296、VEGF-B 表达比较
2.4 不同冠状动脉病变支数CHD 患者血miR-296、VEGF-B 表达比较
多支病变组miR-296 表达低于单支病变组和双支病变组,VEGF-B 水平高于单支病变组和双支病变组,且双支病变组miR-296 表达低于单支病变组,VEGF-B水平高于单支病变组,差异有统计学意义(P<0.05)。见表4。

表4 不同冠状动脉病变支数CHD 患者miR-296、VEGF-B 表达比较
2.5 CHD 患者miR-296、VEGF-B 表达与Gensini 积分的相关性
miR-296与VEGF-B存在结合位点(图1)。与VEGFB-wt 和mir-NC 共转染至H9C2 细胞比较,VEGFB-wt 和miR-296 共转染至H9C2 细胞的萤光素酶活性降低,差异有统计学意义(P<0.05)。但VEGF-Bwt 和miR-296 共转染至H9C2 细胞的萤光素酶活性与VEGF-B-wt 和miR-NC 共转染至H9C2 细胞比较无下降,差异无统计学意义(P>0.05)(图2)。Pearson相关性分析显示,CHD 患者miR-296 与VEGF-B 表达呈负相关(r=-0.731,P<0.001)。Spearman 相关性分析显示,CHD 患者miR-296 表达与Gensini 积分及病变支数呈负相关(rs=-0.719、0.638,P<0.001),VEGF-B表达与Gensini 积分及病变支数呈正相关(rs=0.727、0.698,P<0.001)。
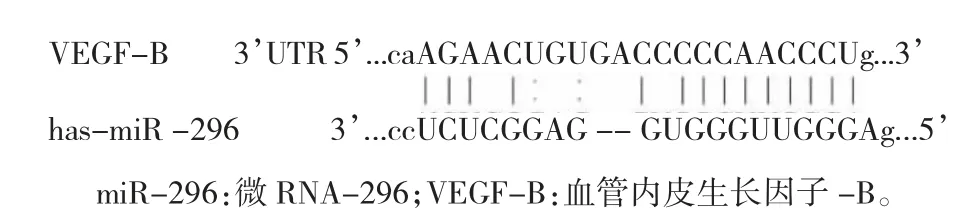
图1 miR-296 与VEGF-B 的结合位点图

图2 miR-296、VEGF-B 的荧光素酶活性
3 讨论
CHD 的特征是在病变的血管中形成的阻塞的富含脂质的斑块可导致血管腔狭窄或阻塞,导致包括心绞痛和心肌梗死在内的缺血性心脏疾病[12-13]。虽然近年来随着区域协同救治体系的逐渐完善,以及药物与非药物治疗手段不断进展,CHD 患者残疾和死亡风险大幅度较低,但CHD 患者总体预后仍然较差[4,14]。因此早期准确评估CHD 患者CAS 程度,对选择合理的治疗方案和改善患者预后具有重要意义。
AS 是CHD 发生、发展的病理基础,其病理生理过程涉及血脂代谢紊乱、炎症反应、氧化应激、血管内皮损害等多种机制[5]。miRNA 能通过引发信使核糖核酸的降解或转录后的基因沉默,通过调节血脂代谢、炎症反应、氧化应激、血管内皮损害等机制参与AS发生、发展[15]。miR-296 定位于人染色体20q13.32,研究报道,下调miR-296 能靶向基质金属蛋白酶15 抑制类风湿关节炎大鼠炎症反应[16];Pan 等[17]研究报道,敲低miR-296 能靶向S100 钙结合蛋白A4 抑制深静脉血栓形成小鼠氧化应激,促进血栓形成。下调miR-296 能靶向缺口受体1 加重中动脉闭塞大鼠血管内皮损伤[18]。重要的是Dai 等[19]研究指出,miR-296降低是冠状动脉疾病患者行经皮冠状动脉介入治疗后支架内再狭窄的独立危险因素。基于此,笔者推测miR-296 可能参与AS 过程。本研究结果显示,CHD患者血miR-296 表达降低,这与Miao 等[7]报道结果相符。结果还显示,CHD 患者miR-296 表达随着CAS程度加重和病变支数增加而降低,说明miR-296 低表达与CHD 患者CAS 加重密切相关,分析原因可能是miR-296 低表达可能导致炎症反应、氧化应激、血管内皮损害,促进AS 发展,进而加重CAS。实验也报道,上调miR-296 能抑制血管内皮损伤,进而抑制AS发生、发展[20]。
VEGF 是血管内皮特异性生长因子,在炎症反应等损伤血管内皮细胞时被大量释放,同时VEGF 也能结合VEGF 受体激活核因子κB 信号通路促进炎症反应,导致血管内皮损伤加重[21]。VEGF-B 是VEGF 家族重要成员,主要表达于冠状动脉内皮细胞、平滑肌细胞和心肌等心血管系统,不仅能结合VEGF 受体1 发挥作用,还能与VEGF-A 协同作用,共同加重血管内皮损害,促进AS 发生、发展[22-23]。近年来多项试验均表明,抑制VEGF 能改善血管内皮损伤,抑制AS进展[24-25]。本研究结果显示,CHD 患者血清VEGF-B表达上调,并随着CAS 程度加重和病变支数增加而升高,提示VEGF-B 高表达与CHD 患者CAS 加重密切相关,分析原因可能是VEGF-B 高表达反映血管内皮损伤加重,导致AS 持续进展,进而导致CAS 加重[24]。既往有研究报道,miR-296 高表达能下调VEGF,减少肝细胞癌淋巴管生成[26];miR-296-5p 表达增强可降低糖尿病视网膜病变小鼠VEGF 表达[27]。本研究通过数据库预测发现,miR-296 与VEGF-B 存在结合位点,进一步研究发现,VEGF-B 是miR-296 的靶点,且二者在CHD 患者血清中表达呈负相关,提示miR-296与VEGF-B 可能共同影响CHD 患者CAS 程度。因此笔者推测miR-296 表达下调可能引起VEGF-B 表达上调,通过炎症反应、氧化应激等引起血管内皮损伤,导致CAS 加重。
综上所述,CHD 患者血miR-296 表达降低,VEGF-B 升高,二者可能共同影响CAS 病变程度。
利益冲突声明:本文所有作者均声明不存在利益冲突。
