甜菜BvBADH 基因家族全基因组鉴定及其高盐胁迫下的表达分析
2024-03-12李昊伍国强魏明韩悦欣
李昊 伍国强 魏明 韩悦欣
(兰州理工大学生命科学与工程学院,兰州 730050)
盐胁迫是影响全球植物生长和作物产量的最主要环境因子[1]。世界上约有20%的土地受到盐渍化的危害[2],随着全球气候变暖盐渍化程度呈逐年加剧趋势[3]。到2050 年,超过50%的耕地受到盐渍化的影响[4]。植物在长期进化过程中,逐渐形成了各种各样的盐渍适应机制。在盐胁迫下,植物可通过积累脯氨酸、可溶性糖、甜菜碱等有机渗透物,降低细胞渗透势,保护细胞免受或减轻盐胁迫造成的伤害。其中,甜菜碱是一种季胺型水溶性生物碱,在自然界中广泛存在,因其最初从甜菜(Beta vulgaris)中提取而得名。植物中发现的甜菜碱有12种,其中化学结构最简单且发现最早的是甘氨酸甜菜碱(glycine betaine,GB)。高等植物的28 个科中,均存在着甜菜碱,尤其是在藜科和禾本科植物中盐和干旱胁迫能促进 GB 合成和积累[5-7]。由此可见,GB 在植物逆境胁迫响应中发挥着重要作用。
甜菜碱在植物体内的合成过程由两步反应催化生成[8]。在催化反应中,第一步的催化酶为胆碱单加氧酶(choline monooxygensase,CMO),其将胆碱转化为甜菜碱醛,甜菜碱醛是一种有毒物质[9-10]。第二步由甜菜醛脱氢酶(betaine aldehyde dehydrogenase,BADH)将甜菜碱醛转化为无毒的甘氨酸甜菜碱[11]。CMO 和BADH 均分布在叶绿体基质中,它们的活性受盐碱、干旱等条件的诱导[12]。研究表明,过表达CMO 并不能引起GB 的积累,但BADH 对GB 生物合成途径至关重要[13]。过表达BADH 使转基因植物GB 含量显著增加,表明BADH是调节甜菜碱合成并维持植物体内渗透平衡的耐盐关键基因[14]。
Weretilnyk 和Hanson[15]在菠菜(Spinacia oleracea)中鉴定到第一个高等植物BADH 编码基因BoBADH。随后,人们相继在大麦(Hordeum vulgare)[16]、高 粱(Sorghum bicolor)[17]、水 稻(Oryza sativa)[18]、千穗谷(Amaranthus hypochondriacus)[19]、海榄雌(Avicennia marina)[20]、中亚滨藜(Atriplex cemrolasiotica)[21]、辽宁碱蓬(Suaeda liaotungensis)[22]等植物中鉴定到BADH 基因家族成员。不同植物BADH 长度差别较大,在1 482-1 581 bp之间;但其编码的氨基酸数目却大致相近,在494-502 aa 之间。大量研究表明,BADH 过表达可显著提高植物的耐盐性[23]。异苞滨藜(Atriplex micrantha)AmBADH 在玉米(Zea mays)中过表达后,转基因植株丙二醛(malondialdehyde,MDA)含量下降,相对电导率降低,叶绿素含量升高,使其产量得以提升[24]。过表达烟草(Nicotiana tabacum)NtBADH 使得转基因胡萝卜(Daucus carota)积累大量GB,在400 mmol/L NaCl 胁迫下能够正常存活[5]。在马铃薯(Solanum tuberosum)中过表达四翅滨藜(Atriplex canescens)AcBADH 后,与野生型植株相比,转基因植株中H2O2和MDA 含量降低,脯氨酸和叶绿素含量升高,耐盐性显著增强[25]。在紫花苜蓿(Medicago sativa)中过量表达大豆(Glycine max)GmBADH 可提高转基因植株过氧化物酶(peroxidase,POD)和超氧化物歧化酶(superoxide dismutase,SOD)活性,从而清除氧自由基,使转基因植株的渗透能力得以增强,在盐胁迫下能够正常生长[26]。在盐处理72 h 后,水稻中耐盐品系BADH 活性是盐敏感品系的2.5 倍[27]。转BADH 基因的核桃(Juglans regia)能在高盐环境下旺盛生长,而野生型植物的生长几乎停滞[23]。过表达 BADH 的转基因烟草植株GB 含量增加了6-30 倍,这也是导致其耐盐性增强的关键原因[6]。将大麦HvBADH1 转到小麦(Triticum aestivum)中,盐胁迫下转基因植株GB 含量显著增加,幼苗成活率得到提高,降低盐胁迫对植株的影响[28]。在拟南芥(Arabidopsis thaliana)中过表达角果碱蓬(Suaeda corniculata)ScBADH 和小麦TaBADH,均可使转基因植株积累更多GB,从而提高其耐盐性[29-30]。过表达菠菜SoBADH 使得转基因烟草植株的耐盐性显著提高[8]。这些结果表明,BADH 在植物GB 的生物合成途径及其在耐盐性中扮演重要角色,在农作物抗逆性遗传改良中具有广阔的应用前景。
甜菜(Beta vulgaris)是石竹目(Caryophyllales)藜科(Chenopodiacdiaceae)二年生草本植物,主要分布在我国西北、华北、东北等干旱半干旱地区。作为我国的第二大糖料作物,甜菜拥有较高的经济价值,用其制糖不仅可满足人们对食物的直接需求,还可为化工、医药、食品加工等多个行业提供配料。另外,甜菜属于典型的嗜盐作物,具有很强的抗盐碱能力和出众的耐贫瘠性,是盐碱地改良和大田轮作的重要经济作物[31]。甜菜基因组序列于2014 年完成并公布[32],为甜菜抗性基因挖掘和抗性基因表达调控网络研究提供便利。鉴于此,本研究拟采用生物信息学手段,从基因组水平挖掘和鉴定甜菜BADH 基因家族,对其理化性质、系统发育、染色体定位、基因结构、顺式作用调控元件、保守基序及其在盐胁迫下的表达模式进行分析。以期为我国北方地区农作抗逆性遗传改良提供理论依据和优异基因资源。
1 材料与方法
1.1 材料
供试甜菜(B.vulgaris)品种为‘甘糖七号’,种子购自武威三农种业科技有限公司。选用Hoagland 营养液对该甜菜进行培养。
1.2 方法
1.2.1 甜菜BvBADH 基因家族鉴定 将从拟南芥基因组数据库TAIR(http://www.arabidopsis.org)获得的AtBADH 氨基酸序列作为参考,利用NCBI 基因组数据库(http://www.ncbi.nlm.nih.gov)和甜菜基因组数据 库(http://bvseq.boku.ac.at/index.shtml),通过BLAST 在线搜索 BvBADH 基因家族成员序列。BvBADHs 预选蛋白的所有同源蛋白序列均满足期望值(expected value,E)<10-40。拟南芥AtBADH 蛋白质序列从NCBI 网站下载。通过在线软件(http://web.expasy.org/protparam/)预测BvBADH 蛋白质等电点(isoelectric point,pI)和理论分子量(molecular weight,Mw)[33]。蛋白质 疏水性(grand average of hydropathicity,GRAVY)、不稳定指数(instability index)和脂肪指数(aliphatic index)利用在线软件ExPASy(http://web.expasy.org/tools/protparam)进 行预测。
1.2.2 甜菜BvBADH 染色体定位分析 根据甜菜基因组数据库信息,在甜菜9 对染色体上找出BvBADHs 位置,利用MapInspect 1.0 软件对BvBADHs家族成员进行染色体定位。
1.2.3 甜菜BvBADH 系统发育、基因结构和保守基序分析 从NCBI 网站下载拟南芥、菠菜、大豆、高粱、藜麦(Chenopodium quinoa)、水稻、烟草、玉米BADH 基因序列,系统发育树利用 MEGA 11.0 软件(https://www.megasoftware.net/)使用邻接比对法(neighbor joining,NJ)以 1 000 次重复构建[34]。根据BvBADH 编码区序列(coding domain sequence,CDS)及基因组序列,通过在线工具 GSDS 2.0(https://gsds.cbi.pku.edu.cn/)预测BvBADH 外显子/ 内含子结构[35]。利用在线软件MEME 5.0(https://meme.suite.org/tools/meme)预测 BvBADH 保守基序,其中设定的参数调整如下:基序值=12,其他数据使用默认数值[36]。
1.2.4 甜菜BvBADHs 蛋白结构分析 采用MEGA 11.0 软件将BvBADH 家族成员的CDS 翻译成氨基酸序列,利用在线软件(https://npsa-prabi.ibcp.fr/)分析二级结构,采用SWISS-MODEL(https://beta.swissmodel.expasy.org/)预测三级结构。
1.2.5 甜菜BvBADH 启动子区域顺式作用元件预测 BvBADH 翻译起始位点上游2.5 kb 鉴定为启动子区域,利用PlantCARE 数据库分析BvBADH 启动子区域可能存在的各种顺式作用元件[37]。
1.2.6 植物材料的培养和处理 挑选籽粒饱满的甜菜种子,用75%乙醇处理2-3 min,然后用无菌水漂洗3 次,最后用无菌水浸泡24 h[38]。将浸泡的种子播在含有蛭石的营养钵中,然后置于培养室内进行培养。培养室的条件:温度25℃/20℃(昼/夜),光照周期16 h/8 h(昼/夜),相对湿度为 65%-70%,光密度550-600 μmol/(m2·s)。每2 d 浇灌一次蒸馏水,待种子萌发子叶露出蛭石后,用Hoagland 营养液浇灌培养。待长至4 周龄时,选取大小、长势一致甜菜幼苗,分别用含有0、100 和150 mmol/L NaCl 的Hoagland 溶液处理,在处理12和24 h 收集甜菜幼苗叶片,立即放入液氮中冷冻,然后放置于-80℃冰箱保存备用。
1.2.7 甜菜BvBADH 表达模式分析 为探究BvBADH家族成员在盐胁迫响应中的作用,采用 RT-qPCR 方法分析其表达模式。总RNA 提取采用UNIQ-10 柱式Trizol 试剂盒(生工,上海)。第一链cDNA 合成用Prime ScriptTMRT Master Mix Kit(TaKaRa,大连)。RT-qPCR 反应体系按照TB GreenTMPremix Ex TaqTMII Kit(TaKaRa,大连)说明书进行。所用BvBADHs 及内参基因BvACTIN(GenBank accession No.XM_010673076)引物序列见表1。BvBADH 相对表达水平采用2-ΔΔCt方法进行计算。所有结果均以3 次生物学重复的平均值±SE 表示,每个生物学重复由3 次技术重复组成。使用SPSS 22.0 软件,在P<0.05 水平上通过多重检验评估各均值之间的显著差异。
与内容分发网络(CDN)、对等网络(P2P)应用、软件定义网络(SDN)、网络地址翻译(NAT)、云计算和移动互联网等类似,区块链是针对互联网在价值传递方面的缺点,新打的一块补丁。
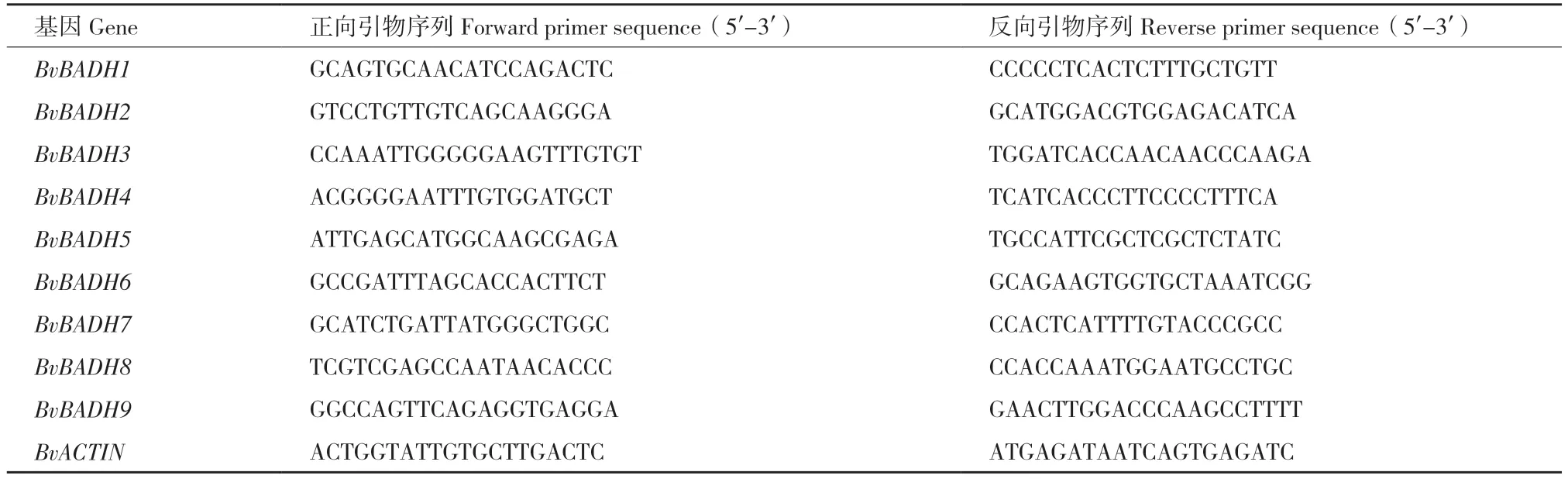
表1 本研究所用RT-qPCR 引物序列Table 1 Sequences of primers used for RT-qPCR in this study
2 结果
2.1 甜菜BvBADH基因家族成员的鉴定
在甜菜基因组序列中共检索出 11 条 BADH 候选基因序列,除去不完整序列后,最终确定 9 条序列为甜菜BADH 基因。根据 BADH 在甜菜基因组序列中的顺序将其命名为 BvBADH1-BvBADH9。序列分析表明(表2),BvBADH 基因家族成员的CDS 为1 500 bp(BvBADH1)-1 608 bp(BvBADH8),蛋白质长度在 500-535 aa,平均约516 aa。Mw 为54.25 kD(BvBADH4)-58.71 kD(BvBADH8)。pI 为5.24(Bv-BADH3)-6.98(BvBADH9)。可 见BvBADHs 是 一类偏酸性的蛋白质。GRAVY 为-0.111(BvBADH6)-0.066(BvBADH9)。其中,BvBADH1-8 的GRAVY为负值,属于亲水性蛋白,而BvBADH9 的GRAVY为正值,属于疏水性蛋白。脂肪指数是蛋白质中脂肪族侧链氨基酸(Ala、Val、Leu 和Ile)含量的相对值,其中最高的是BvBADH9,为95.72;最低的是BvBADH8,为85.74,平均值为88.74。蛋白质不稳定指数最低的是BvBADH4,为22.07;最高的是BvBADH9,为38.12,均小于40,表明BvBADHs 较为稳定。
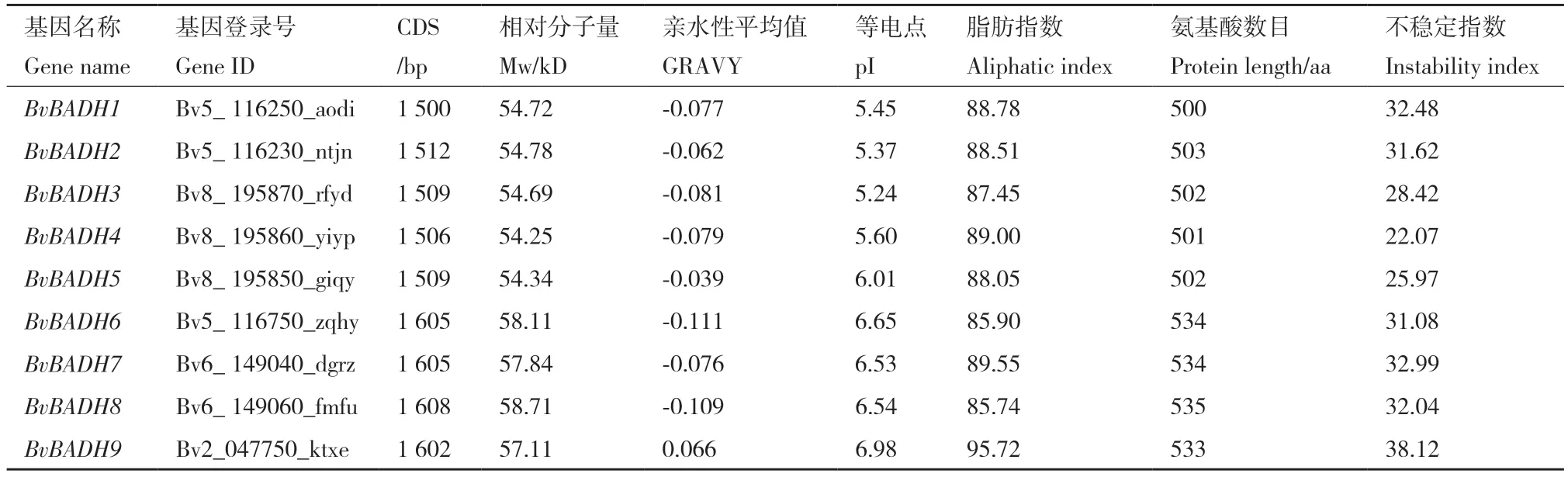
表2 甜菜BvBADH 基因家族成员鉴定Table 2 Identification of BvBADH gene family members in sugar beet
根据甜菜每对染色体长度以及BvBADH 基因家族成员的起始位置,利用MapInspect 1.0 进行染色体定位并绘图。结果(图1)表明,BvBADH9 在2 号染色体,BvBADH8 和BvBADH7 定位在6 号条染色体,5 号(BvBADH1、BvBADH2 和BvBADH6)和8号(BvBADH3、BvBADH4 和BvBADH5)染色体均有3 个基因。
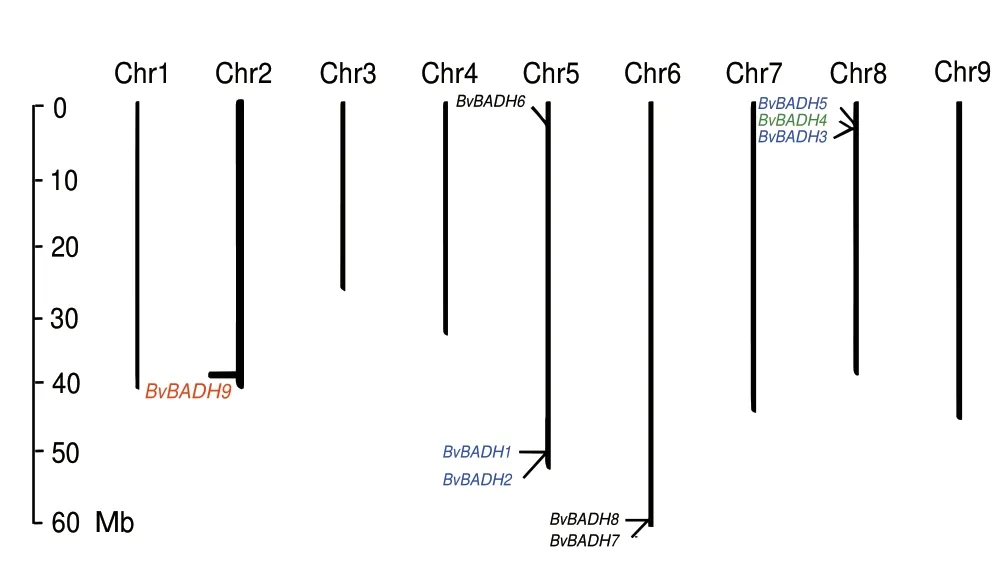
图1 甜菜BvBADH 基因家族染色体定位分析Fig.1 Analysis of chromosome location of the BvBADH gene family in sugar beet
2.2 甜菜BvBADHs多序列比对和系统发育分析
为研究BvBADH 与其他植物BADH 家族成员的系统发育关系,本研究选用甜菜、菠菜、拟南芥、玉米、水稻、大豆、高粱、烟草和藜麦等9 个物种69 个BADH 基因编码氨基酸序列,采用MAGA11.0 软件构建系统发育树。结果(图2)表明,BADHs 基因家族可分为3 个簇,即簇I、II 和III,其中簇III 又分为2 个亚簇,簇IIIa 和IIIb。BvBADH1、BvBADH2、BvBADH3 和BvBADH5 属于簇IIIb,BvBADH4属于簇IIIa,BvBADH9 属于簇II,而BvBADH6、BvBADH7 和BvBADH8 属于簇I。进一步发现,BvBADHs 与十字花科植物拟南芥AtBADHs 和藜科植物菠菜SoBADHs 进化关系较近,而与禾本科植物玉米ZmBADHs 和水稻OsBADHs 进化关系较远(图2)。
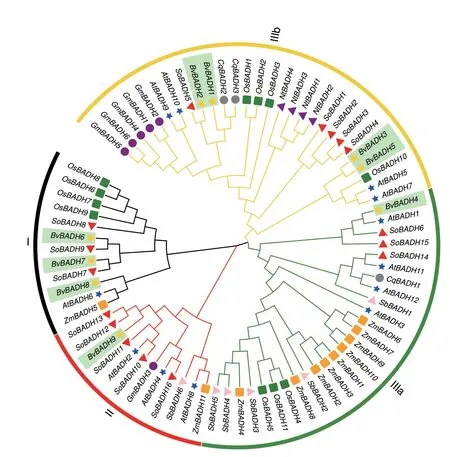
图2 植物BADH 基因家族系统发育树Fig.2 Phylogenetic tree of BADH gene family in plants
为进一步分析BvBADH 基因家族的保守结构域,采用DNAMAN 10.0 对其蛋白质序列进行多重比对。结果(图3)表明,BvBADH 家族成员的氨基酸相似性为81.72%。BvBADH 具有保守十肽序列。由此表明,甜菜BvBADHs 是一类高度保守的蛋白,其家族成员可能发挥相同的功能。
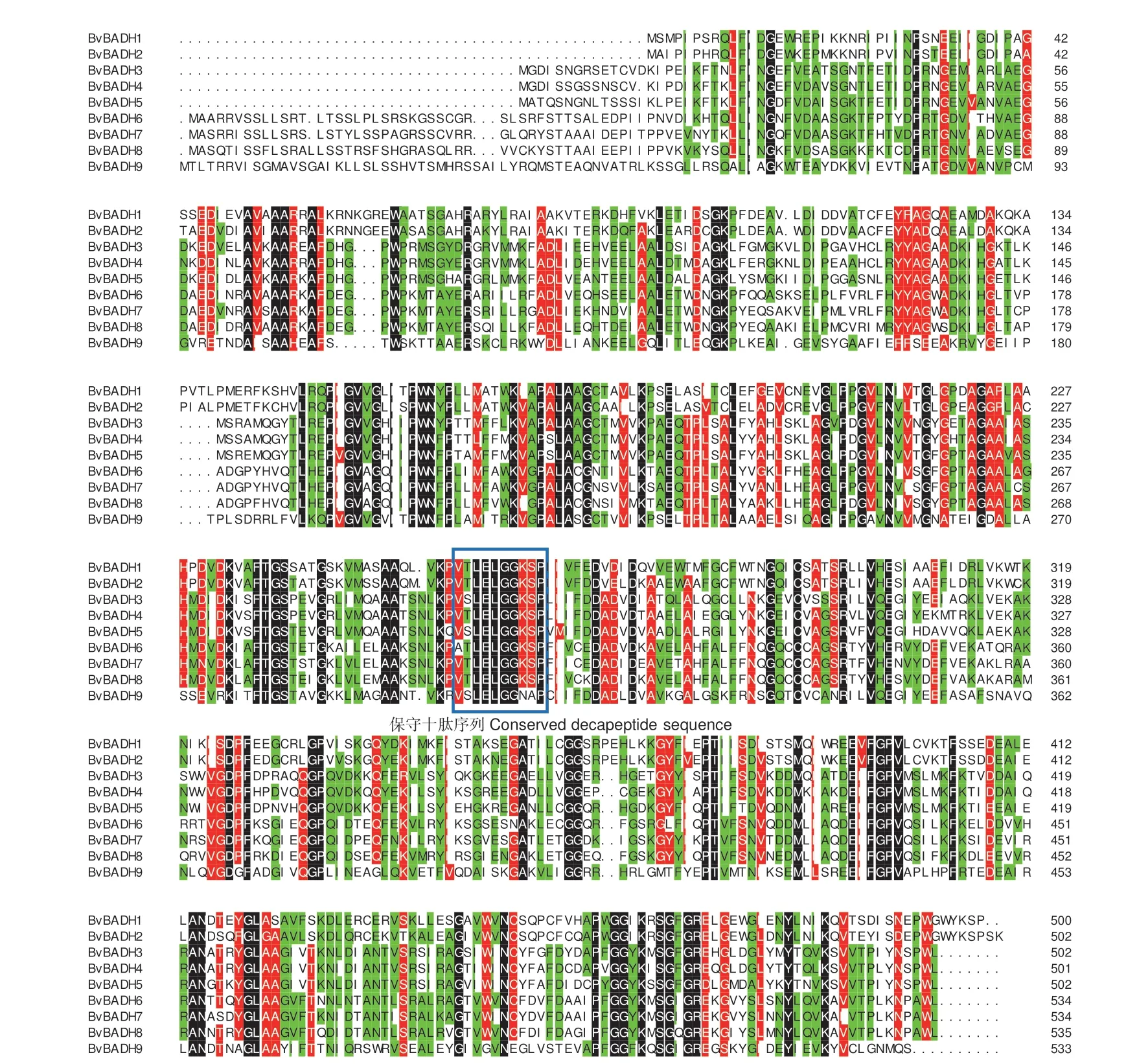
图3 甜菜BvBADH 基因家族氨基酸序列多重比对Fig.3 Amino acid sequence multiple alignment of the BvBADH gene family in sugar beet
2.3 甜菜BvBADHs基因结构和蛋白基序
为确定BvBADHs 基因结构多样性,本研究对其内含子和外显子分布进行分析和比较。结果(图4)表明,BvBADHs 外显子数量为9 个(BvBADH3、BvBADH4 和BvBADH5)-15 个(BvBADH1 和BvBADH2)不等。为进一步探究BvBADH 结构特征,通过MEME 预测其编码蛋白质的保守基序。结果(图5)表明,不同成员的保守基序的数量也各不相同,7-12 个不等。其中,基序1 是BvBADH 编码氨基酸的高度保守序列。
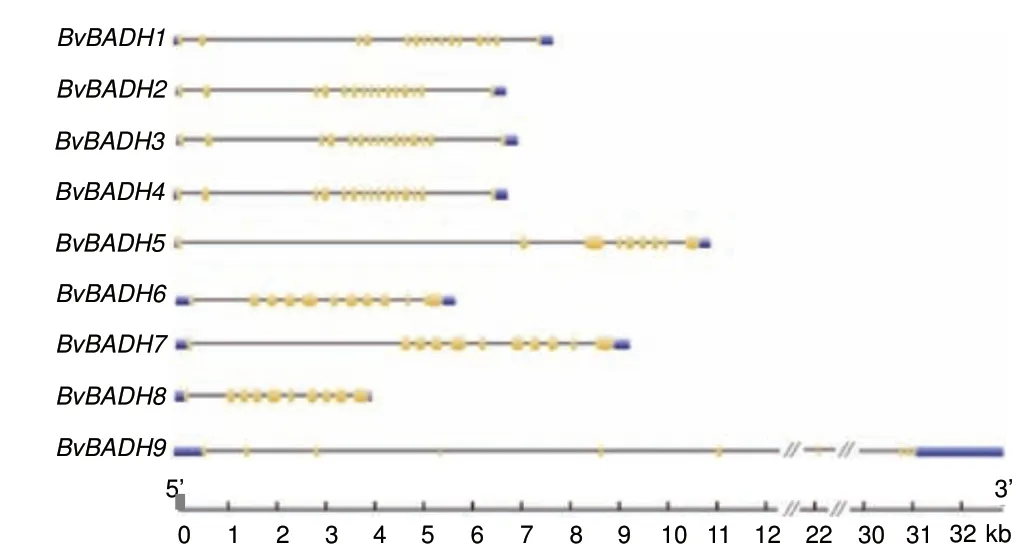
图4 甜菜BvBADH 基因家族基因结构分析Fig.4 Analysis of the gene structure of BvBADH gene family members in sugar beet
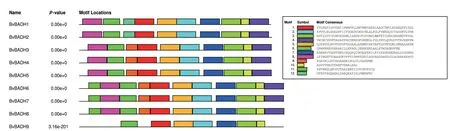
图5 甜菜BvBADH 基因家族蛋白保守基序分布及特征分析Fig.5 Distribution and characteristics of conserved motifs in BvBADH gene family of sugar beet
2.4 BvBADHs启动子区域的顺式作用调控元件
2.5 BvBADHs二级和三级结构分析
如表4 和图6 所示,BvBADHs 二级结构的主要组分为α 螺旋,在9 个成员中除了BvBADH5为39.44%,其余均超过40%,其中含量最高的是BvBADH9,为48.22%。在BvBADH1-BvBADH5 中前50 aa 并没有形成α 螺旋,而BvBADH6-BvBADH9则恰恰相反。另外,起连接其他结构作用的无规卷曲,伸展主链主要分布在C 端的各个区域(图6)。
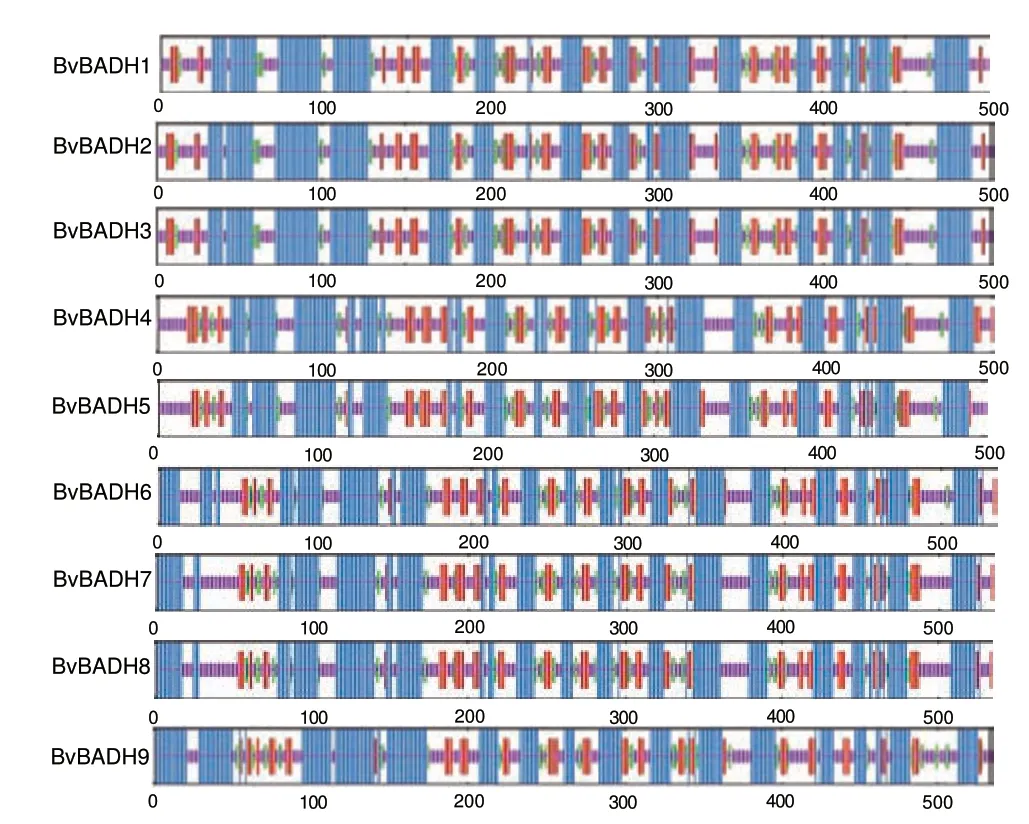
图6 BvBADHs 蛋白质二级结构Fig.6 Secondary structure of BvBADHs protein
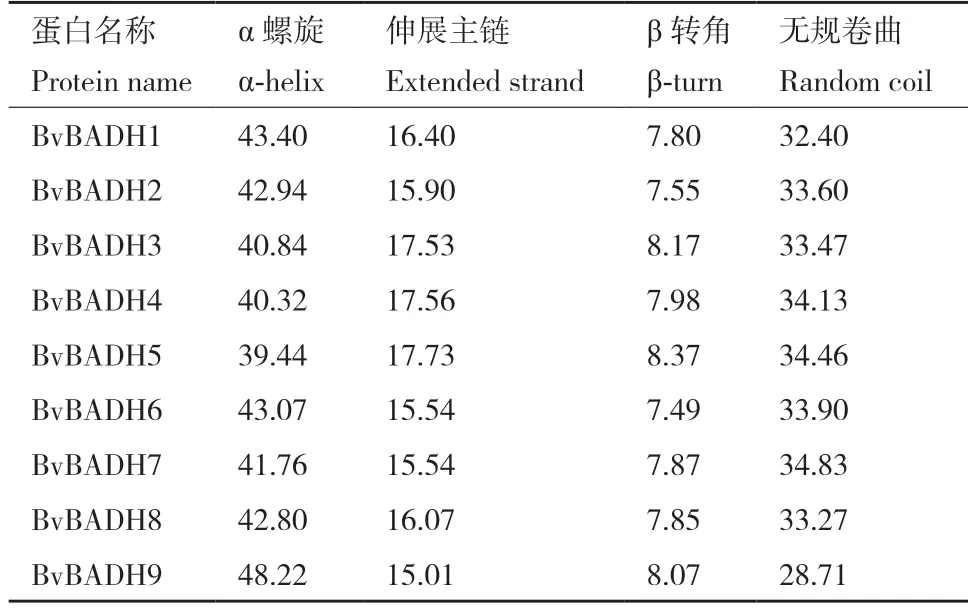
表4 BvBADHs 蛋白二级结构组成Table 4 Secondary structure composition of BvBADHs proteins%
将BvBADHs 基因编码的蛋白序列输入SWISSMODEL 在线工具,运行各自的三维结构发现,BvBADH1-BvBADH9 拥有较多的α 螺旋(图7),与二级结构预测的结果一致。所有预测的BvBADHs 模型的GMQE(global model quality estimation)均在0.93(BvBADH2)-0.98(BvBADH7)之间,均接近于1,表明模型预测的准确性较高。
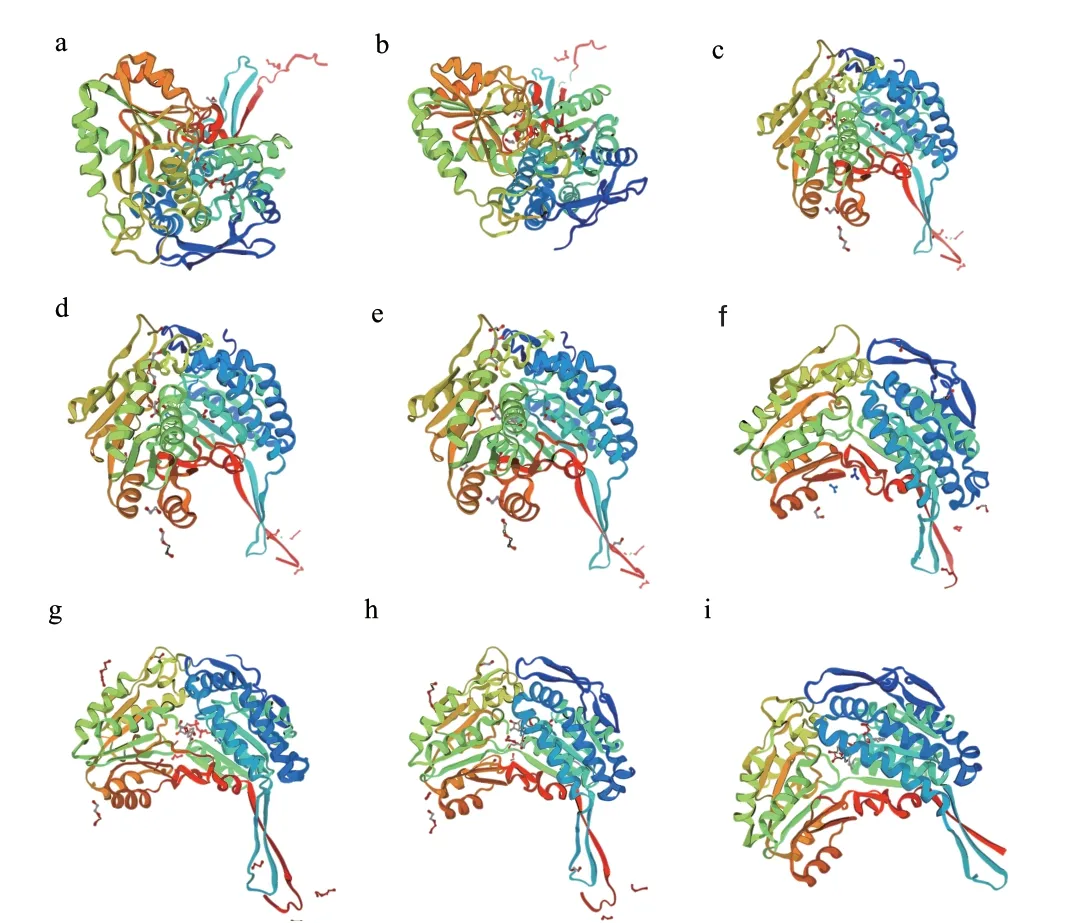
图7 甜菜BvBADH 蛋白质三维结构Fig.7 Three-dimensional structure of BvBADH proteins in sugar beet
2.6 盐处理下甜菜BvBADHs基因表达模式分析
与对照(0 mmol/L NaCl)相比,在100 和150 mmol/L NaCl 处理下,9 个BvBADHs 成员在甜菜叶中的相对表达水平均有所上调(图8)。在100 mmol/L NaCl 处理12 h 后,BvBADH8 的相对表达水平最高,为对照的3.3 倍;在胁迫24 h 后,它们的相对表达水平均明显下降,但仍高于对照,其中BvBADH7 下降最为显著,相对表达水平较12 h 降低了1.7 倍。相比之下,除BvBADH1 外,在150 mmol/L NaCl 处理下,BvBADHs 相对表达水平低于100 mmol/L 处理。这些结果表明,BvBADH 基因家族在盐胁迫响应中具有潜在的功能。
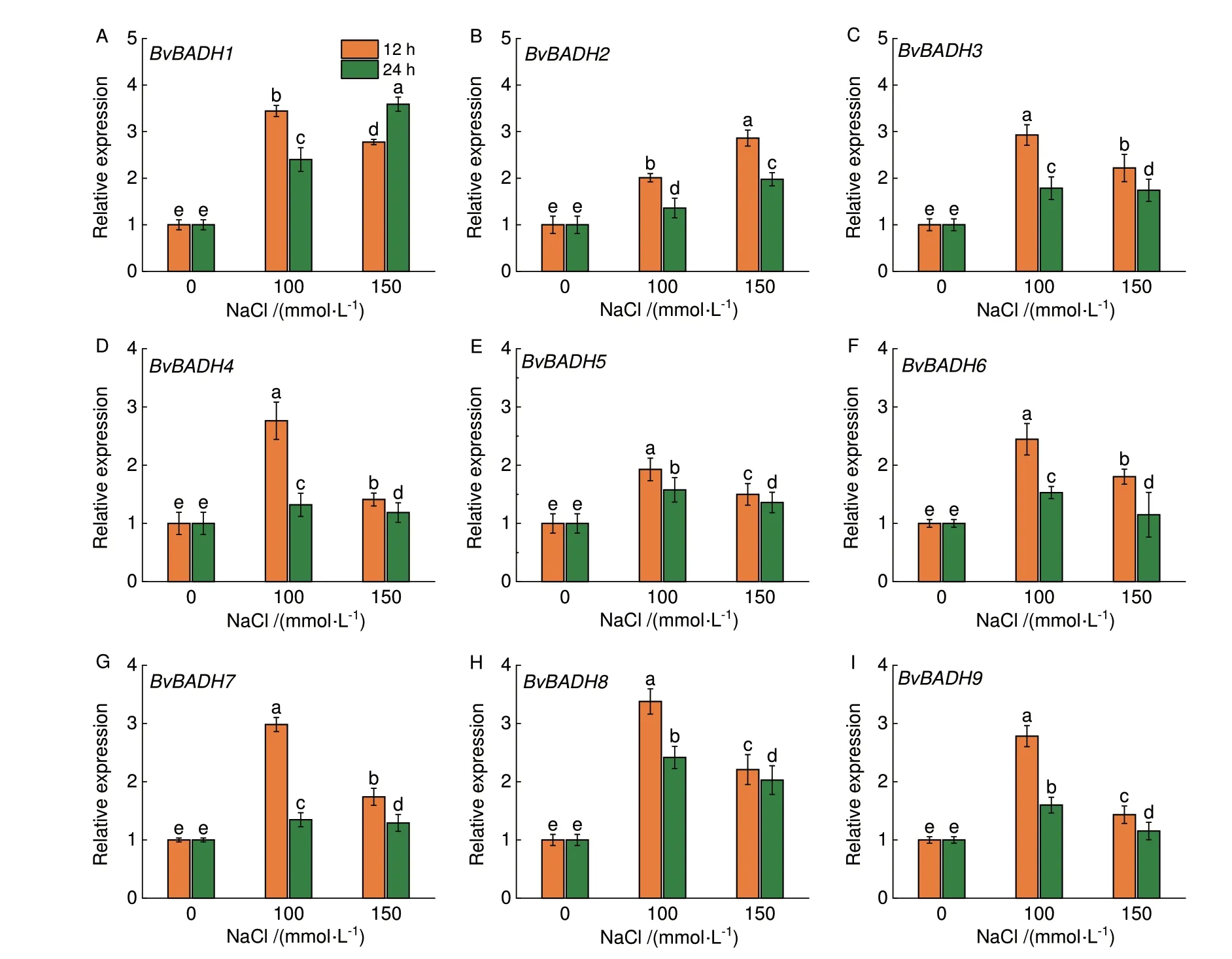
图8 不同浓度 NaCl 处理下甜菜叶片BvBADHs 相对表达水平Fig.8 Relative expressions of BvBADHs in sugar beet leaves under various concentrations of NaCl
3 讨论
BADH 在高等植物菠菜中首次分离得到后[39],人们利用活性染色和柱层析方法证实了BADH 含有两个同工酶BADH I 和 BADH II[40],其中BADH I占总活性的 60%,占总蛋白含量的70% 左右。BADH II 已被证明调节多种植物香味的产生,如水稻[41]、羯布罗香(Dipterocarpus turbinatus)[42]、椰子[43]、扁豆(Lablab purpureus)[44]、南国梨(Pyrus ussuriensis ‘Nanguo Pear’)[45]和丝瓜(Luffa aegyptiaca Miller)[46]。然而,BADH I 则参与植物的逆境胁迫响应[47];其可在渗透胁迫下形成甜菜碱,从而降低细胞渗透势,提高植物对逆境胁迫的耐受性[48]。目前在不同植物中鉴定到BADH 家族成员,如菠菜16 个、玉米11 个、大豆6 个、三角叶滨藜(Atriplex triangularis)5 个[49]、藜麦3 个[50]、甘菊(Dendranthema lavandulifolium)2 个[51]。在本研究中,共鉴定出9 个BvBADH 基因,与其他物种的BADH 基因家族成员数量不尽相同,可能是因为不同物种在进化的过程中,特定基因的复制和缺失造成的这种现象。
根据不同物种BADH 氨基酸序列构建出系统发育树,将高等植物BADH 分为三簇,即簇I、簇II 和 簇III(簇IIIa 和 簇IIIb)。在本研 究中,甜菜BvBADH 九个成员在3 簇中均有分布。另外,BvBADHs 具有一个高度保守的十肽序列VTLELGGKSP,与香蕉(Musa nana)[52]高度保守的十肽序列VSLELGGKSP 相似,但略有不同。因此,推断BvBADH 基因家族9 个成员可能具有相似的生物学功能。
顺式作用元件是转录调控的关键,在基因活性调控中扮演重要的角色[53]。启动子区域的差异可能会影响一个基因的表达模式,从而进一步影响一些基因的功能[54]。在植物中,ABA、水杨酸等激素在植物生长发育与逆境胁迫响应过程中起重要作用[55]。在 BvBADH 基因家族成员中,鉴定出 11 个顺式作用调控元件,基因上游不但包含激素相关的顺式作用元件,还包含一些光响应元件(G-box)和低温响应元件(LTR)等环境响应元件。这些结果表明,BvBADH 基因的表达不但会受一些激素调节,可能还会受到外界环境变化的影响。
研究表明,BADH 在植物响应各种非生物胁迫过程中起重要作用[56-60]。在盐胁迫下,BvBADHs 基因的相对表达水平均有上调,在100 mmol/L NaCl下部分基因家族成员的表达量要高于150 mmol/L NaCl,这可能是由于高盐浓度(150 mmol/L NaCl)影响了植物正常生长代谢所导致的。其中相对表达水平上调最高的是150 mmol/L NaCl 处理24 h 的BvBADH1。值得注意的是,BvBADH1 在高盐浓度处理下,其相对表达水平随时间的延长而升高,在24 h 时达到最高,显著高于其他基因。然而,在同一处理时间内,BvBADH2 在150 mmol/L NaCl 下的相对表达水平大于100 mmol/L NaCl。由此可见,BvBADH1 和BvBADH2 受高盐条件的诱导和上调。另外,BvBADH1 和BvBADH2 与拟南芥AtBADH9 与AtBADH10 同源性较高,这两个基因在拟南芥抗逆性方面起着重要作用[61]。这些结果表明,BvBADHs 在嗜盐作物甜菜响应盐胁迫过程发挥重要作用,可为我国北方地区农作物抗逆性遗传改良提供优异基因资源。
4 结论
在甜菜中共鉴定9 个BvBADH 基因家族成员,每个成员蛋白质的理化性质各不相同。高等植物BADH 家族可分为3 簇,BvBADH 家族成员在3 个簇中均有分布。100 和150 mmol/L NaCl 均显著地诱导BvBADH 基因家族成员的表达,但在100 mmol/L NaCl 处理下的表达量高于150 mmol/L NaCl,表明BvBADH 基因家族在甜菜响应盐胁迫过程中扮演着重要角色。
