甘蔗CBL-CIPK 基因家族的鉴定和表达分析
2024-03-12辛奇李压凡尹铮张晓丹陈霆刘晓华
辛奇 李压凡 尹铮 张晓丹 陈霆 刘晓华
(鲁东大学农林工程研究院 山东省高校作物高产抗逆分子模块育种实验室重点实验室,烟台 264025)
温度、水分及渗透压是制约植物生长的关键环境因素,在农业生产中,明确不同环境因子的影响,探究植物抵抗逆境的关键基因具有重要意义,在植物与环境的相互作用中,钙离子(Ca2+)作为第二信使发挥着关键作用[1]。
CBLs 是一类Ca2+结合蛋白,是感知钙离子浓度变化的钙受体之一。CBLs 的C 端有一个保守的丝氨酸残基,该残基易被磷酸化,并与下游靶蛋白CBL-相互作用蛋白激酶 CIPKs[2]发生特异性相互作用[3]。在应激条件下,CIPK 蛋白质通过调节细胞膜上离子转运体以恢复离子平衡[4],CBL-CIPK 信号系统调控植物体内各种刺激或信号的关键成分以发挥功能[5]。通过前人研究得知,植物体内的钙离子结合蛋白主要有三类,分别是钙调蛋白(Ca2+-binding proteins including calmodulin,CaM)家族、钙依赖蛋白激酶(Ca2+-dependent protein kinases,CDPKs)家族、类钙调磷酸酶B 亚基蛋白CBL 家族[6]。CBL 蛋白依赖EFhand 蛋白基序结构与钙离子结合,将信号传导给下游蛋白[7]。CBL-CIPK 复合物在植物生长、发育和应激反应等多种生理过程中调节钙信号发挥着重要作用[8]。
拟南芥AtCIPK23 是驱动根系对各种环境胁迫做出反应的主要枢纽[9]。抗盐方面,复合物CBL10-CIPK8-SOS1 在调节拟南芥的盐耐受性方面发挥重要作用[10],AtCIPK16 可提高转基因小麦的耐盐性[11],AvCIPK11 对猕猴桃的抗盐性具有正向调节作用[12],AtCIPK6 过度表达增强了拟南芥对盐胁迫的耐受性[13]。抗旱方面,TaCIPK23 超表达的小麦和拟南芥在干旱条件下表现出更高的存活率,并且对ABA敏感[14]。OsCBL8-OsCIPK17 组合可调控水稻幼苗生长并提高其耐热性和耐旱性[15],鸽豆CcCIPK14-CcCBL1 组合通过促进类黄酮的生物合成来积极调节耐旱性[16],辣椒CaCIPK3 和马铃薯StCIPK18 在耐旱性方面都发挥了积极作用[17],StCBL4-StCBL2 对耐旱性有正向调节作用[18]。此外,CBL-CIPK 信号系统在种子萌发、幼苗期发育[19]和抗病方面[20]也发挥重要作用。
目前,CBL-CIPK 基因家族成员研究主要集中在葡萄(Vitis vinifera)、菠萝(Ananas comosus)、油菜(Brassica napus L.)、萝 卜(Brassica rapa var.rapa)、白菜(Brassica rapa ssp.pekinensis)等植物中。在葡萄中发现8 个CBLs 和20 个CIPKs[21],菠萝中发现19 个CBLs 和51 个CIPKs[22],油菜中 有7 个CBLs和23 个CIPKs[23],萝卜中 有10 个CBLs 和26 个CIPKs[24],白菜中有18 个CBLs 和47 个CIPKs[25]。关于CBL-CIPK 信号系统调控甘蔗应对非生物胁迫尤其是低温胁迫的研究却鲜见报道。
本研究通过对甘蔗CBL-CIPK 基因家族成员低温及盐旱胁迫下的表现进行研究,筛选出优质候选基因,为后续揭示CBL-CIPK 信号系统的内在机制及其在非生物胁迫中的功能提供有价值的参考。
1 材料与方法
1.1 材料
甘蔗(Saccharum officinarum)‘GT58’号由广西壮族自治区农业科学院甘蔗研究所提供,大肠杆菌DH5α、酵母pGADT7 和pGBKT7 菌株为鲁东大学农林工程研究院保存。
1.2 方法
1.2.1 试验处理 选择生长一致的甘蔗‘GT58’组培幼苗进行非生物胁迫处理。将幼苗移至装有1 L三级水的水培箱中,每盆均匀放置3 株,预培养20 d。在此期间,每隔3 d 更换一次三级水。当幼苗长出约10 条不定根时,在水培过程中每隔2 h 让根部通气40 min。设置以下5 个处理:CK(普通培养液)、低温(4℃)、高温(45℃)、PEG-6000(25 mmol/L)和NaHCO3(170 mmol/L)。每种处理设3 个重复,分别在试验实施的0、2、8、16、24、48 和72 h 整株取样,液氮速冻,-80℃保存备用。
1.2.2 甘蔗CBL、CIPK 家族成员的鉴定及特征分析 利用拟南芥数据库Tair(https://www.arabidopsis.org/)和植物基因组数据库Esamble Plant(http://plants.ensembl.org/index.html),进行全基因组序列比对、筛选,获得甘蔗CBL 基因家族成员19 个。利用HUMMER 模型分析,去除冗余蛋白保留含有Pkinase(Pfam NO.PF00069)和NAF(Pfam No.PF03822)2 个 保守结构域的蛋白序列,获得82 个甘蔗CIPK 家族成员。利用EXPASY ProtParam tool(https://web.expasy.org/protparam/)分析家族成员物理特征。利用在线工具WoLF PSORT(https://wolfpsort.hgc.jp/)对家族成员的亚细胞定位信息进行预测。
1.2.3 SsCBLs、SsCIPKs 保守结构域及蛋白基序分析 通过DNAMAN 软件验证家族成员的结构域保守性及序列同源性。利用NCBI Web CD-Search Tool(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)和MEME(https://meme-suite.org/meme/tools/meme)分析其蛋白基序。引入进化树数据,利用TBtools 软件(Bio Sequence Structure IIIustrator 模块)对保守结构域及蛋白基序进行统一可视化。
1.2.4 SsCBLs、SsCIPKs 基因结构及染色体定位分析 利用TBtools 软件(Gene Structure Shower 模块)分析并绘制基因结构图,(Amazing Gene Location From GFF3/GTF File 模块)分析并绘制染色体定位图,并根据甘蔗CBL 和CIPK 基因家族成员在染色体上的位置为其命名。
1.2.5 SsCBLs、SsCIPKs 顺式作用元件分析 通过TBtools 软件(Gtf/Gff3 Sequences Extractor 模块)和PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对顺式作用元件进行预测,并使用TBtools 软件(Simple BioSequence Viewer 模块和HeatMap 模块)将数量统计制成热图。
1.2.6 SsCBLs、SsCIPKs 系统进化发育关系及共线性分析 通过MEGA 软件中的Clustal W 工具对拟南芥AtCBLs、水稻OsCBLs、小麦TaCBLs、甘蔗SsCBLs、拟南芥AtCIPKs、甘蔗SsCIPKs 蛋白序列进行比对,使用邻接法(neighbor-joining,NJ)构建系统进化树,并利用最大似然法(maximum-likelihood,ML)进行验证。利用在线工具iTOL(https://itol.embl.de/login.cgi)对进化树进行美化。利用TBtools软件(File Merger For MCScanX 模块和Circle Gene Viewer 模块),分析共线性关系并可视化。
1.2.7 植物总RNA 提取及cDNA 合成 按照RNA提取试剂盒(美国OMEGA 公司)提取植物总RNA,并反转录合成cDNA(Thermo),步骤详见产品说明书。
1.2.8 引物设计及RT-qPCR 试验 选择具有代表性的部分基因家族成员进行定量分析,利用Prime5 软件设计荧光定量引物,以甘蔗GAPDH 为内参基因,引物序列详见附表1。
使用RT-qPCR 测定各基因在非生物胁迫下的表达量,反应程序:95℃ 15 min;95℃ 10 s,60℃ 20 s,40 个循环。
1.2.9 数据处理 采用2-ΔΔCT方法分析基因表达量,利用SPSS 分析数据显著性差异,小于0.05 为显著,小于0.01 为极显著,由Prism 软件绘制基因表达直方图。
1.2.10 重组载体的构建 选定SsCBL1、SsCBL8、SsCIPK47 和SsCIPK81 四个基因验证蛋白互相作用。将SsCBLs 全长cDNA 与pGADT7 和pGBKT7 空载体连接,SsCIPKs 全长cDNA 与pGADT7 空载体连接,构建SsCBL1-AD、SsCBL1-BD、SsCBL8-AD、SsCBL8-BD、SsCIPK47-AD 和SsCIPK81-AD 重组载体,转化DH5α,测序鉴定。所有SsCBL/SsCIPK 基因家族成员的Y2H 互作引物见附表2。
1.2.11 SsCBLs 与SsCIPKs 酵母双杂交点对点验证 将含有目的基因的重组质粒按照一定比例混合,共转化Y2H 型酵母菌,同时,设置pGADT7/pGBKT7 空载体为阴性对照,pGADT7-T/pGBKT7-53为阳性对照。在SD/-Trp/-Leu 二缺固体培养基上筛选阳性克隆,挑选生长良好的阳性克隆接种至液体培养基中进一步培养,28℃摇床培养48 h,用ddH2O 将不同菌株分别稀释至原浓度的1/10、1/100和1/1 000。将不同浓度的菌液点在SD/-Trp/-Leu 二缺固体培养基和SD/-Trp/-Leu/-His/-Ade 四缺固体培养基上,28℃倒置培养48-72 h,观察菌株生长情况。
2 结果
2.1 甘蔗CBL、CIPK基因家族的生物信息学分析
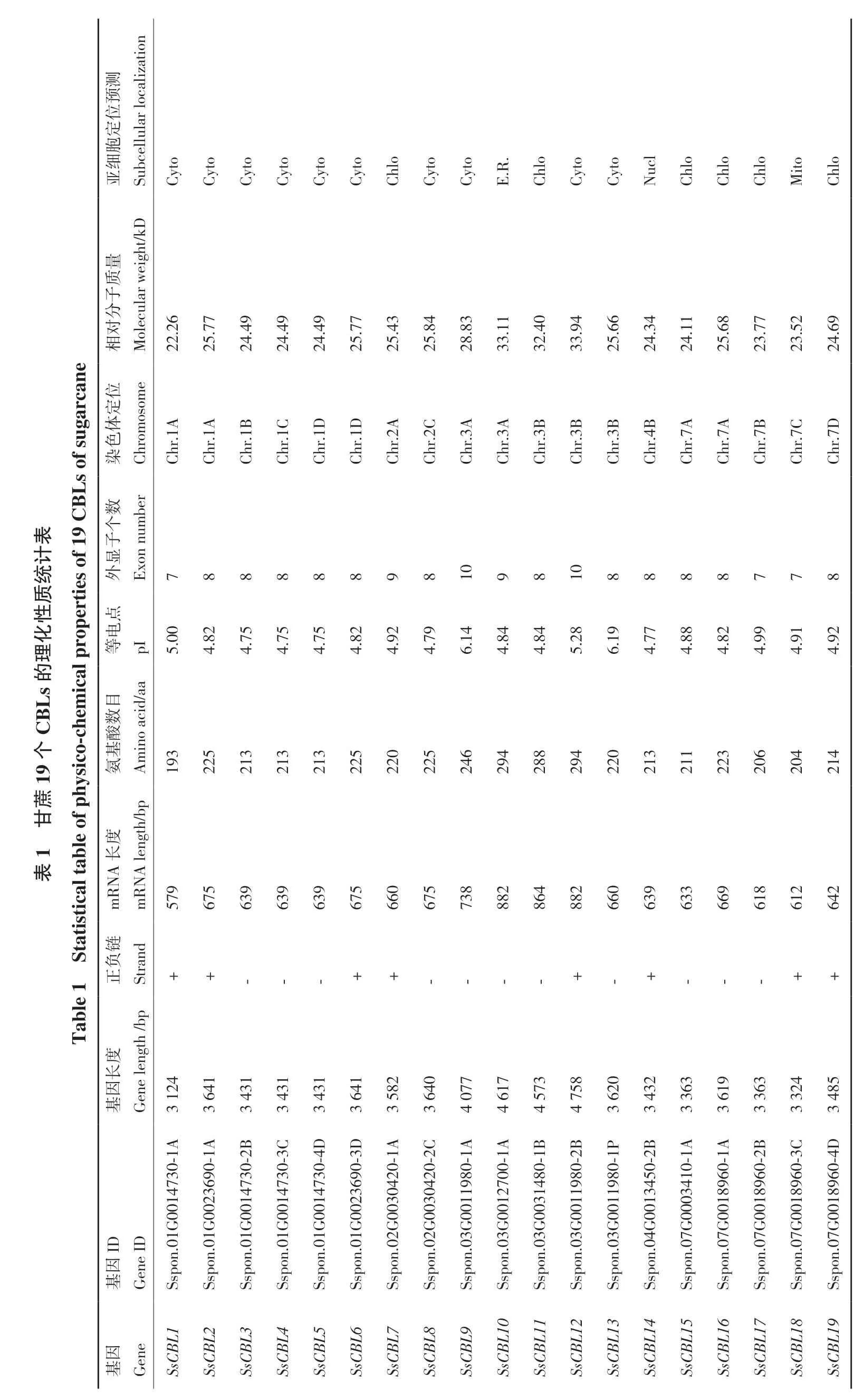
2.1.1 甘蔗CBL-CIPK 家族成员理化性质差异较大 利用蛋白序列BLAST 及HMM 模型鉴定,最终获得19 个甘蔗CBL 基因家族成员(表1)和82个CIPK 基因家族成员(附表3),并按其在染色体上的位置分别命名为SsCBL1-SsCBL19 和SsCIPK1-SsCIPK82。从表1 可以看出,甘蔗CBL 家族基因长度差距较大,从3 124-4 758 bp 不等,编码的氨基酸数目为193-294 个,等电点均小于7 为酸性蛋白,外显子数目差别不大,范围为7-10 个,分子量差距较大,范围为22.27-33.94 kD。亚细胞定位预测显示,大多数基因定位于细胞和叶绿体,少部分基因定位于内质网、细胞核、线粒体。从附表3 可以看出,甘蔗CIPK 家族基因长度差异较大,最短的为6 080 bp,最长为30 944 bp,编码的氨基酸数目为393-2 025 个,等电点范围为5.19-9.88,其中只有12 个基因等电点小于7 为酸性蛋白,绝大多数为碱性蛋白。外显子数目差别较大,范围为1-17 个,且分布极不均匀,分子量范围为43.09-220.47 kD。亚细胞定位预测显示,大部分基因定位于叶绿体和细胞膜,少部分基因定位于线粒体、内质网、细胞和细胞核。此外,甘蔗CBL、CIPK 基因家族成员蛋白序列(附图1)与拟南芥相比具有相似性和一致性,结构域domain 及蛋白基序motif(图1)分析表明家族内部成员间具有较强的保守性。

图1 CBL-CIPK 基因家族的domain 与motif 分析Fig.1 Domain and motif analysis of CBL-CIPK gene family
2.1.2 SsCBLs、SsCIPKs 基因结构相似,并且在染色体上分散分布 CBL 家族成员具有相似的基因结构,内含子数目范围为7-10 个,表明CBL 家族成员在进化过程中基因结构始终保持较好的一致性(图2-A);与CBL 家族明显不同的是,CIPK 家族成员基因结构分为内含子富集和内含子缺失两大类,其中有54 个成员无内含子,组成内含子缺失组,内含子富集组有28 个成员,分别含有1-4 个内含子,表明CIPK 家族在进化过程中具有鲜明的多样性(图2-B)。甘蔗CBL、CIPK 家族成员在染色体上的分布极不均匀。甘蔗CBL 家族成员仅分布在13 条染色体上,其中Chr.1B、Chr.1C、Chr.2A、Chr.2C、Chr.4B、Chr.7B、Chr.7C、Chr.7D 各包含1 个成员,Chr.1A、Chr.1D、Chr.3A、Chr.7A 各包含2 个成员,Chr.3B包含3 个成员(图3-A),而甘蔗CIPK 家族成员分布在29 条染色体上,仅Chr.1C、Chr.4D、Chr.6B3条染色体上没有CIPK 家族成员分布,值得注意的是,Chr.1D、Chr.2B、Chr.2C、Chr.2D、Chr.4C、Chr.7D 6 条染色体上形成了多个基因聚集的基因簇,这种结构的出现,可能与多个基因协同合作发挥功能有关(图3-B)。
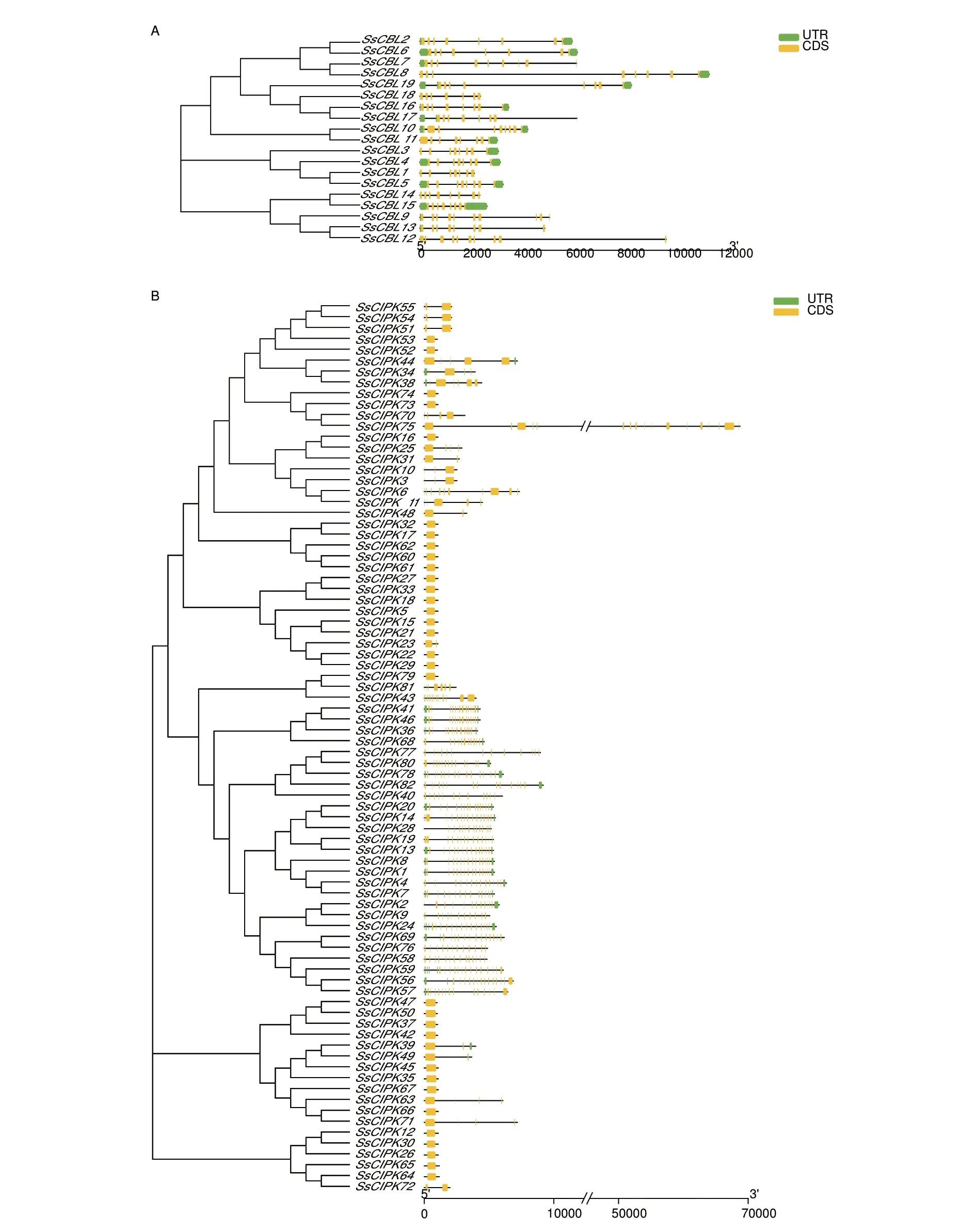
图2 CBL-CIPK 基因家族的基因结构分析Fig.2 Analysis in the gene structures of CBL-CIPK gene family
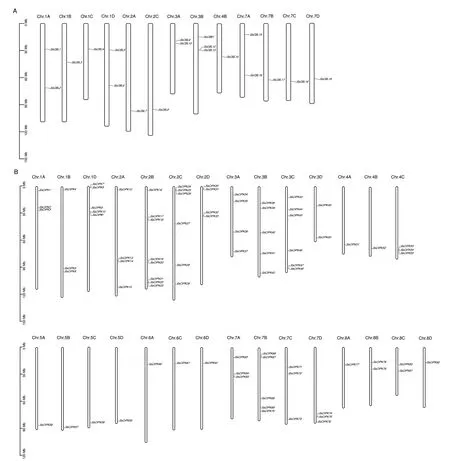
图3 CBL-CIPK 基因家族的染色体定位分析Fig.3 Analysis for their positions on the chromosomes in CBL-CIPK gene family
2.1.3 SsCBLs、SsCIPKs 顺式作用元件分布的多样性 通过顺式作用元件分析发现,即使在同一进化树分支上,甘蔗CBL 和CIPK 家族成员之间顺式作用元件的数量、类型和顺序也不尽相同,这表明顺式作用元件出现的数量、类型和顺序与进化树分支并无显著相关性,但一般来说,每个成员都包含上述3 种顺式作用元件(图4)。由于SsCBL9 上游2 000 bp 区域存在大量未测序碱基,所以预测出的顺式作用元件较少。甘蔗CIPK 家族成员顺式作用元件预测结果详见附图2。
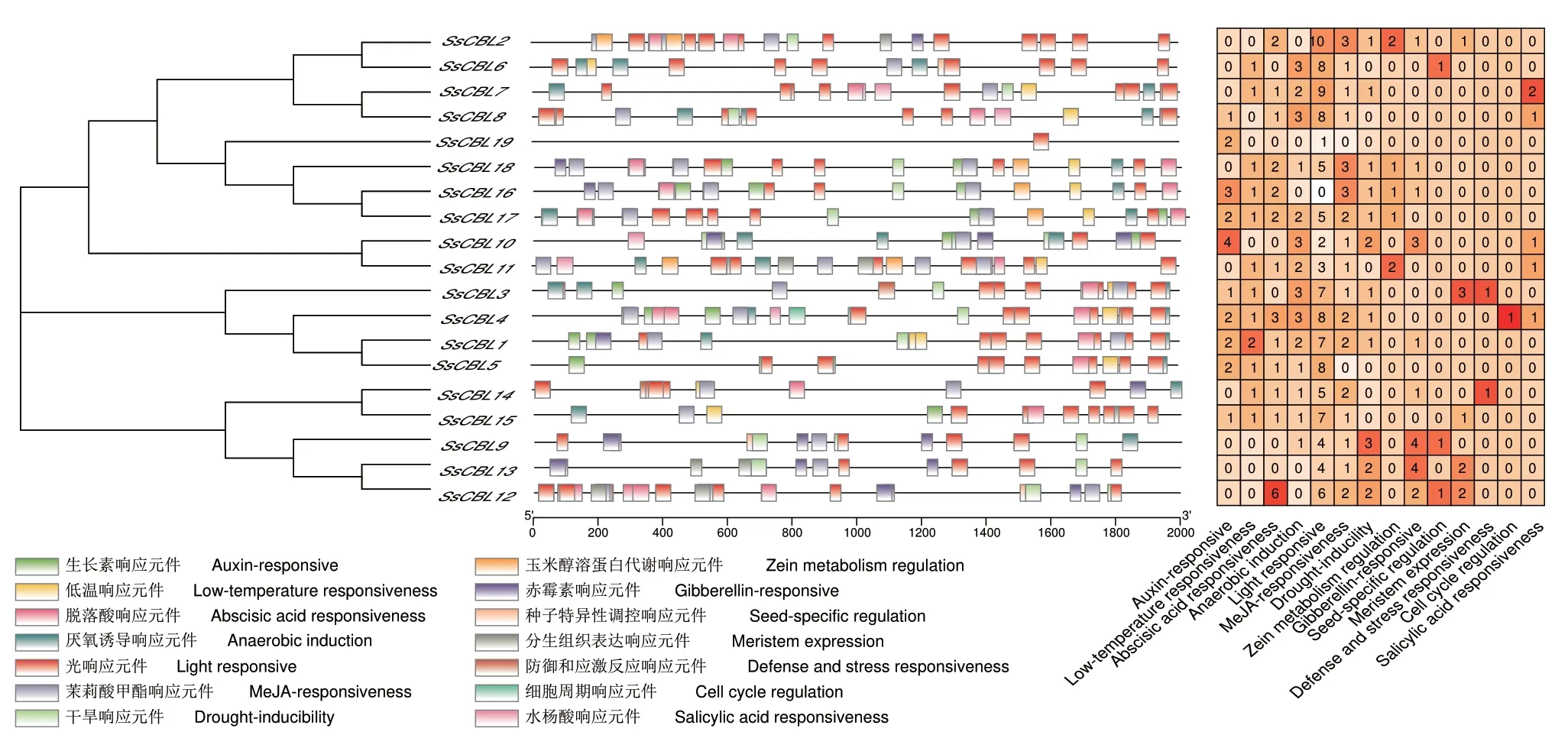
图4 甘蔗CBL 基因家族顺式作用元件预测统计Fig.4 Predicted statistics for cis-acting elements of the sugarcane CBL gene family
2.1.4 SsCBLs、SsCIPKs 分布在不同的进化分支且存在基因复制现象 根据分支情况可将CBL 进化树分为5 个亚族,4 个物种的CBLs 分布较为均匀,各亚族分别包含2-5 个SsCBLs,其中第II 亚族不包含AtCBLs(图5-A)。CIPK 进化树可分为6 个亚族,82 个SsCIPKs 在这5 个亚族中呈不均匀分布,第I-V 亚族分别包含6、15、6、27、28 个SsCIPKs,第VI 亚族不包含SsCIPKs(图5-B)。根据进化支及蛋白序列比对情况,选定SsCBL7、SsCBL9、SsCBL12、SsCBL15、SsCIPK1、SsCIPK5、SsCIPK38和SsCIPK74 这8 个基因作为后续研究对象。共线性分析结果显示,甘蔗全基因组内存在基因复制现象,由SsCBLs 和SsCIPKs 形成的重复基因共有10 对(红色部分),在8 条染色体上分布很不均匀,有些基因在同一条染色体上形成基因连接簇,一个基因也可能与不同的基因相关联,如SsCBL2 与SsCBL6、SsCBL7 和SsCBL8 形成了3 对重复基因,有趣的是,发生重复事件的基因都在进化树的同一分支(图5-C)。上述现象表明,基因重复事件的形成与染色体长度和基因位置无明显关系,但与进化树的分支有关,亲缘关系越近,基因重复事件发生的可能性越大。
2.2 甘蔗CBL、CIPK基因家族部分成员非生物胁迫下定量分析
2.2.1 极端温度下SsCIPKs 的诱导幅度较SsCBLs 更为明显 SsCBLs 和SsCIPKs 在4℃低温胁迫下有显著表达(图6-A-B),其中SsCIPK38 和SsCIPK74 的表达量在处理8 h 时达到最高点,SsCBL9、SsCBL15和SsCIPK1 的表达量在处理16 h 时达到最高点,SsCBL7 和SsCIPK5 的表达量在处理24 h 时达到最高点。从时间上看,SsCIPK38 和SsCIPK74 最早达到最高峰,基因反应也最敏感。从表达量来看,SsCBL7 的表达量最高,在15 h 左右达到峰值。值得注意的是,SsCIPKs 的诱导幅度更为明显,峰值均高于对照。在45℃高温胁迫下,SsCBL7、SsCBL12、SsCIPK5 和SsCIPK74 的表达量明显高于对照,呈先增后减的趋势,尤其是SsCBL7 在处理24 h 时表达量最高,峰值超过30,其次是SsCIPK5,峰值在7左右(图6-C-D)。
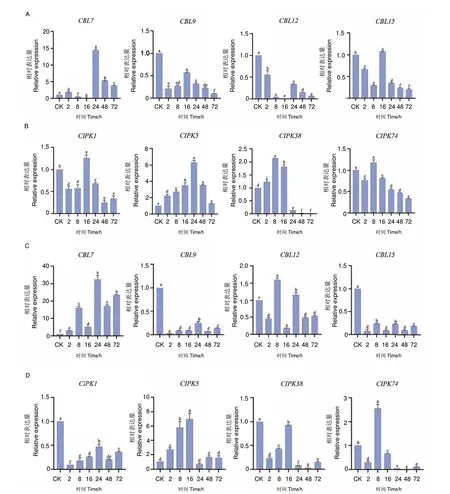
图6 参与不同温度胁迫响应的SsCBLs、SsCIPKs 基因的RT-qPCR 分析Fig.6 RT-qPCR analysis of SsCBLs,SsCIPKs genes involved in different temperature stresses response
2.2.2 NaHCO3、PEG 胁迫下SsCBLs 和SsCIPKs 基因表达趋势较为一致 NaHCO3胁迫下,下降基因的表达趋势差异比较大(图7-A-B),处理24 h 时,SsCBL7 和SsCBL12 的表达量达到最高点,其中SsCBL7 的表达量最高,峰值超过50,48 h 时,SsCIPK5的表达量达到最高点。PEG-6000 胁迫下,SsCBLs和SsCIPKs 的表达表现出一定的共性(图7-C-D),PEG 处理2 h 后,所有基因都有明显的反应,最明显的是SsCBL7、SsCBL12、SsCIPK1 和SsCIPK5。SsCBL15 和SsCIPK5 呈下降趋势,SsCBL9、SsCBL12和SsCIPK1 呈下降趋势,SsCIPK38 和SsCIPK74 呈下降趋势,值得注意的是,SsCBL7 的表达情况最为特殊,除8 和24 h 表达量较低外,其余时间均有超高表达。

图7 参与NaHCO3/PEG 胁迫的SsCBLs、SsCIPKs 的RT-qPCR 分析Fig.7 RT-qPCR analysis of SsCBLs,SsCIPKs genes involved in NaHCO3/PEG stresses
2.3 SsCBLs与下游蛋白SsCIPKs存在互作关系
为了进一步验证甘蔗SsCBLs 与下游蛋白Ss-CIPKs 的相互作用,筛选SsCBL1、SsCBL8、SsCIPK47 和SsCIPK81 进行酵母双杂试验。结果(图8)显 示,SsCBL1 与SsCIPK47、SsCBL1 与SsCIPK81、SsCBL8 与SsCIPK47 和SsCBL8 与SsCIPK81 相互作用。但是,SsCBLs 和SsCIPKs 蛋白之间的互作机制仍需进一步探讨。
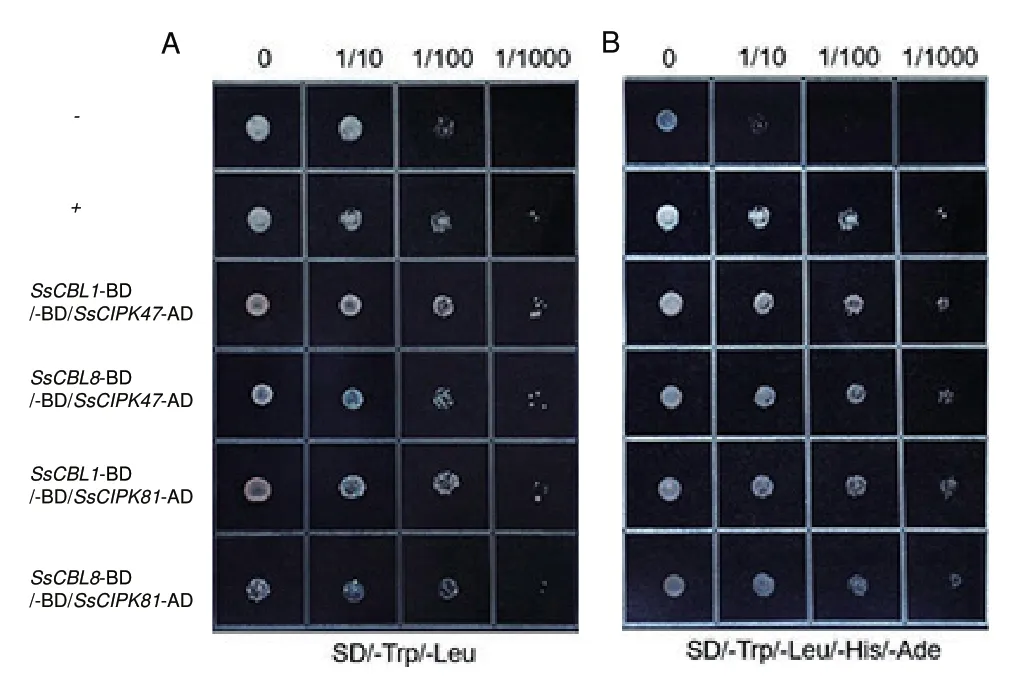
图8 SsCBLs 和SsCIPKs 之间的相互作用分析Fig.8 Interaction between SsCBLs and SsCIPKs
3 讨论
在生长发育过程中,低温、高温、盐害、干旱等非生物胁迫成为限制植物优质高产的重要环境因素。CBL-CIPK 信号网络是解码环境胁迫引发的钙信号[26]、调控植物生长发育和应对植物面临的胁迫的重要调控机制之一[27]。
藜麦中有16 个CBLs 和41 个CIPKs[28],紫花苜蓿中有68 个CBLs 和135 个CIPKs[29]。本研究通过对甘蔗进行全基因组分析,筛选出19 个CBL 基因家族成员和82 个CIPK 基因家族成员。家族成员基本理化性质分析表明,不同成员之间的理化性质差异很大,并且2 个家族之间存在显著差异,这与亚洲梨(Pyrus bretschneideri)CIPK 家族成员具有巨大差异相似[30]。多序列比对、蛋白基序和结构域分析表明,19 个SsCBLs 都具有4 个EFhand 结构,其中17 个成员具有N 端豆蔻酰化结构域,这种结构有助于CBL 蛋白结合Ca2+,12 个成员具有C 端PFPF 结构域,该保守位点是增强CBL 与CIPK 结合和相互作用的关键因素[31]。82 个SsCIPKs 都具有一个N 端的结合结构域Pkinase 和一个C 端的激活结构域NAF[32],2 个结构域同时存在使得CBL 蛋白与CIPK 蛋白顺利结合进而激活CIPK 蛋白发挥相应功能[33]。基因结构与染色体定位分析表明甘蔗CBL家族成员基因结构相似,保持较高的一致性。19 个SsCBLs 不均匀地分布在13 条染色体上。甘蔗CIPK家族成员基因结构差异较大,有54 个成员内含子缺失和28 个成员内含子富集,内含子缺失型基因表达可能与逆境胁迫有关,干旱可诱导内含子缺失型基因在大豆中的表达[34],但在甘蔗中这一现象尚未发现。82 个SsCIPKs 不均匀地分布在29 条染色体上,与山核桃(Carya illinoinensis)相似,30 个CiCIPKs基因不均匀地映射在12 条山核桃染色体上[35],在部分染色体上形成独特的基因簇,多个基因聚集在一起协同发挥功能。顺式作用元件分析表明,甘蔗CBL 和CIPK 家族成员基因上游2 000 bp 启动子区域存在大量抗逆、激素反应和生长发育的相应反应元件,这些元件出现的顺序、数量和类型各不相同,没有明显的规律。系统进化树表明,两棵进化树分别分为5 个亚支系和6 个亚支系,每个亚支系都包含大量成员,且分支明显,推测其进化方向较为独立。甘蔗种内发生了10 对基因重复事件,并且发生重复事件的基因对属于进化树的同一分支,而这一现象在以往的研究中并未发现。
在不同非生物胁迫处理下,SsCBLs 和SsCIPKs的表达量显著不同,这种差异主要体现在响应速度、表达量和表达趋势3 个方面,造成这种差异的原因尚不清楚,但目前可以排除进化关系的可能,因为在进化树中不同亚族、同一亚族、同一分支这3 种关系的基因表达谱均存在明显差异。SsCIPK38 和SsCIPK74 对低温胁迫的响应最为迅速,反应极灵敏。辣椒CaCIPK13 的过表达提高了辣椒的耐寒性[36],柑橘CuCIPK16 的过度抑制增强了转基因拟南芥的耐寒性[37],紫雏菊SpCBL6 增强了转基因拟南芥的耐寒性[38]。在45℃高温胁迫下,SsCBL15 的表达量较低,且变化趋势不大,与桃(Prunus persica)PprCBL1、PprCIPK18 的表达水平类似,在不同阶段都比较稳定[39]。NaHCO3胁迫下,各成员在表达幅度和响应速度方面也表现出明显差异,说明NaHCO3对于基因表达的诱导作用非常显著,其中SsCBL7、SsCBL12、SsCIPK5 的表达最为敏感。丹参和金银花(Lonicera japonica Thunb.)中也存在类似的基因,其中SmCIPK13 的表达水平在NaCl 胁迫处理后显著增加[40],LjCBL2/4、LjCIPK1/15/17 对盐胁迫非常敏感[41]。PEG-6000 胁迫下,SsCBL7 的表达谱最值得注意,除PEG 胁迫的8 h 和24 h 低量表达外,其他时间均保持高度表达,且表达量远高于对照组和其他基因,形成了独特的表达谱。此外,在PEG 胁迫过程中,SsCIPK1 和SsCIPK5 也表现出大幅度、高表达量和快速响应的表达谱,这与CaCIPK20 在干旱胁迫下在辣椒中表达上调[42]相似,StCIPK10 增强了马铃薯对干旱和渗透胁迫的耐受性[43],这些都可以为后续筛选优良的耐旱基因提供参考。有趣的是,酵母双杂交试验表明,SsCBL8 可分别与SsCIPK47 和SsCIPK81 相互作用,推测这种相互作用可增强SsCBL8 基因的功能。此外,SsCBL1 也能分别与SsCIPK47 和SsCIPK81 相互作用。在茶树[44]和棉花[45]中也有类似的结果,多对CBL-CIPK 基因组合在应对低温和干旱胁迫时发生相互作用,形成蛋白质复合物。后续工作可对CBL-CIPK 蛋白质互作网络做进一步的研究和探索。
4 结论
从甘蔗中鉴定出19 个CBL 基因家族和82 个CIPK 基因家族,SsCBL7、SsCIPK5、SsCIPK38 对温度变化敏感,SsCBL7、SsCBL12、SsCIPK5 对盐胁迫敏感,SsCBL7、SsCBL12、SsCIPK1、SsCIPK5 对渗透胁迫敏感。同时,SsCBLs 和SsCIPKs 之间具有相互作用。SsCBL7、SsCBL12、SsCIPK1 和SsCIPK5是具有抗多重逆境能力的候选基因,SsCBL1-Ss-CIPK47、SsCBL1-SsCIPK81、SsCBL8-SsCIPK47 和Ss-CBL8-SsCIPK81 四对基因相互作用形成复杂的蛋白质复合物,在抵抗逆境过程中发挥重要作用。
文章所有附图附表数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002-5464/home.shtml)。
