盐胁迫下不同基因型核桃实生幼苗生长及生理响应*
2024-03-12姬新颖唐佳莉王红霞张俊佩
姬新颖 唐佳莉 李 敖 郑 旭 王红霞 张俊佩
(1. 林木遗传育种全国重点实验室 国家林业和草原局林木培育重点实验室 中国林业科学研究院林业研究所 北京 100091;2. 河北农业大学山区研究所 河北省山区农业技术创新中心 国家北方山区农业工程技术研究中心 保定 071000)
土壤盐渍化是威胁环境和农林业可持续发展的全球性生态问题(Zhanget al., 2022)。盐胁迫通过引起渗透压和离子毒害来破坏植物体内离子的动态平衡,此外,植物在亚细胞水平上经受氧化胁迫,这些都是造成盐胁迫对植物最终有害影响的主要因素。(Abidet al., 2020)。筛选以及培育耐盐林木资源是盐渍土改良利用的有效途径之一。
核桃(Juglans regia)是重要的坚果和木本油料树种,其具有突出的食用价值和药用价值,同时也作为优良经济用材树种被广泛利用,发展前景广阔(刘玉梅等,2020)。近年来,核桃产业迅速发展,但在一些盐碱地区,因土壤含盐量较高影响了核桃的品质和产量。核桃的生态适应性强,但其耐盐能力较弱,对盐分较敏感(欧源,2022)。目前,关于核桃耐盐性砧木选育方面的工作研究较少。Wang等(2020)通过对早、晚实核桃研究表明,在水分和盐分的共同胁迫下,早实核桃受抑制更明显。刘昊等(2021)通过NaCl胁迫处理,研究了小果黑核桃(Julans microcarpa)对盐分的耐受能力。Karimi等(2018;2020)研究表明,温室中生长的核桃幼苗在经过控制盐胁迫的预处理后,能获得更强的抗旱性。鉴于此,本文以不同基因型核桃幼苗为试材,采用盆栽控盐试验,研究盐胁迫对幼苗生长及生理特性的影响,综合评价耐盐性,以期探讨核桃幼苗的耐盐机制以及不同基因型之间的耐盐性差异,为耐盐品种的筛选及盐碱地资源的合理利用提供理论参考。
1 材料与方法
1.1 试验材料
新新2号(JX2)、温185(JW185)、扎343(JZ343)和辽宁1号(JL1)共4种基因型种子于2020年9月采自中国林业科学研究院种质资源库22年生母树。2021年6月初,将催芽后的种子播种于塑料花盆(上口径18 cm,下口径11 cm,高25 cm)中,栽培基质为泥炭土、珍珠岩、蛭石(3∶1∶1,V/V),每盆1粒,并置于中国林业科学研究院的科研温室中统一培养管理。
1.2 试验设计
2021年8月上旬,选取长势一致的健康幼苗进行NaCl胁迫处理,盐分梯度为0(对照)、50、100、200和300 mmol·L-1,均由1/2 Hoagland营养液配置而成,每个梯度设置3个重复,每个重复4株。每隔5天以对应浓度的NaCl溶液处理幼苗,每盆浇300 mL,在花盆底部放置塑料托盘,若有溶液流出,则回倒入盆中。每次浇灌前用清水充分淋洗基质,以防盐分积累,确保试验设计的准确性。试验持续进行4次,分别于试验开始6、12、18和24天采样进行相关生理指标的测定,并记录外部形态特征的变化。
1.3 试验方法
1.3.1 生长指标测定 试验开始前,各处理均随机选取3盆长势较一致的幼苗,测量其苗高(用卷尺测量,cm)、地径(用游标卡尺测量,mm),试验结束后,再次进行测量,计算苗高增量(H△)、地径增量(D△)。
试验结束后,将各处理的未破坏幼苗从盆中取出,洗净并擦干,在105 ℃烘箱中杀青30 min,转至75 ℃烘至恒质量,进行植株干质量(PDW)的测定。每个处理重复3次。
1.3.2 光合指标测定 叶绿素(Chl)含量的测定采用乙醇提取法(Zhuet al., 2021)。净光合速率(Pn)、气孔导度(Cond)、蒸腾速率(Tr)和胞间二氧化碳浓度(Ci)等光合指标采用LI-6400光合仪,在天气晴朗的上午9:00—11:00进行测定,选取离枝顶端向下第2~3片复叶上的第1~2对功能叶,每叶重复测定3次。
1.3.3 生理指标测定 相对电导率(REC)采用电解质外渗法(王学奎,2006)测定;丙二醛(MDA)含量采用硫代巴比妥酸显色法(王学奎,2006)测定;脯氨酸(Pro)含量采用酸性茚三酮比色法(王学奎,2006)测定;可溶性糖(SS)含量采用蒽酮比色法测定(王学奎,2006);超氧化物歧化酶(SOD)活性采用氮蓝四唑光化还原法(李合生,2000)测定;过氧化物酶(POD)活性采用愈创木酚显色法(李合生,2000)测定;生长素(IAA)、脱落酸(ABA)、赤霉素3(GA3)和玉米素核苷(ZR)的含量采用酶联免疫试剂盒的方法测定(ELISA)(江苏晶美生物科技有限公司)。各处理每个指标重复测定3次。
1.4 数据处理
采用Excel 2019和Origin 2021对试验数据进行分析并制图,利用SPSS 23.0软件进行差异显著性分析(P<0.05),图表中数据为平均值±标准差。参考白世践等(2022)和Zhong等(2019)所用方法进行主成分分析,并计算变化幅度和耐盐系数。
变化幅度(%)=(对照处理的测定值-盐胁迫处理的测定值)/对照处理的测定值×100。
某个单项指标的耐盐系数为某个指标在各NaCl浓度处理下的测定值除以对照处理的平均值。
对耐盐系数进行均衡归一化处理,即将数据转换为纯量,按下列公式进行计算:
式中:U(1)、U(2)分别为正、负指标的转化值;Xij表示第j个核桃基因型第i个单项指标的耐盐系数;Xijmin和Xijmax分别表示第j个核桃基因型第i个单项指标耐盐系数的最小值和最大值。
2 结果与分析
2.1 NaCl胁迫下核桃幼苗生长的变化
胁迫至6天时,各基因型在200或300 mmol·L-1NaCl浓度下叶缘出现轻微的枯黄状,其中,JX2症状较轻。12天时,各基因型在盐胁迫下均出现不同程度的叶片枯黄、卷曲症状。18天时,症状进一步加重,其中,JZ343的叶片在200 mmol·L-1时开始出现脱落。24天时,在200 mmol·L-1浓度下,除JX2外,其余3种基因型的叶片均表现出不同程度的脱落,其中,JZ343脱落较严重;300 mmol·L-1浓度时,各基因型叶片干枯、卷曲、脱落症状进一步加深,其中,JX2叶片脱落较轻,JZ343受害最严重。
各基因型幼苗的苗高增量、地径增量及植株干质量均随NaCl浓度的增加而降低(表1)。JX2的苗高增量仅在300 mmol·L-1NaCl 时较对照显著降低,其余3种基因型的苗高增量和地径增量在各盐浓度下均与对照形成显著差异。300 mmol·L-1NaCl时 ,JX2、JW185、JZ343和JL1的苗高增量较对照分别显著下降了50.00%、65.42%、60.22%和58.76%;地径增量较对照分别显著降低了47.78%、70.71%、70.70%和70.11%。各基因型的植株干质量随盐浓度的增加总体呈降低趋势,但各处理间均无显著差异。从生长指标可知,JX2受抑制程度较轻。
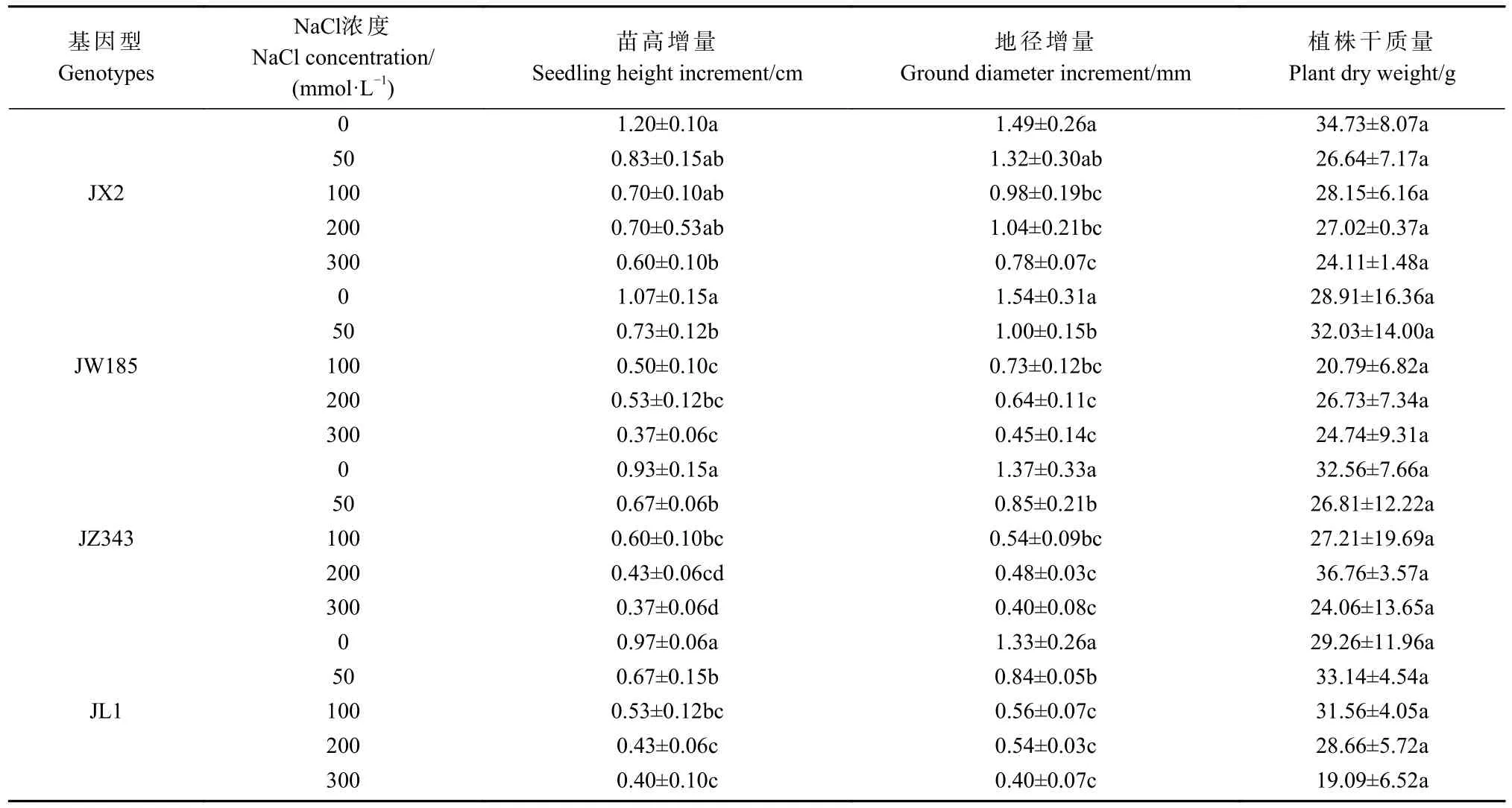
表1 不同浓度盐胁迫对核桃幼苗生长指标的影响Tab. 1 Effect of salt stress at different concentrations on the growth of walnut seedlings
2.2 NaCl胁迫下核桃幼苗光合特性的变化
2.2.1 叶绿素含量 随盐浓度的增加和胁迫时间的延长,各基因型的叶绿素含量总体呈下降趋势(图1)。胁迫至6天时,JX2在不同盐处理下的叶绿素含量均高于对照,最大增幅为41.28%;JW185和JL1在50 mmol·L-1NaCl 时高于对照,随后呈下降趋势,在各处理下,JW185的叶绿素含量要高于JL1;JZ343在各盐浓度下的含量均低于对照(图1A)。在其他3个处理时期,各基因型的叶绿素含量均随盐浓度的增加而降低(图1B-D)。总体来说,JX2的叶绿素含量变化幅度较小,含量较高,而JZ343则相反。

图1 NaCl处理对核桃幼苗叶绿素含量的影响Fig. 1 Effects of NaCl treatment on the chlorophyll content of walnut seedlings
2.2.2 光合参数 随盐浓度的增加和胁迫时间的延长,各基因型的Pn值总体呈下降趋势(图2A-D)。胁迫至6天时,各基因型的Pn值在50 mmol·L-1时有所上升,随后呈降低趋势(图2A)。在12天和18天时,各基因型的Pn值随盐浓度的增加而降低,其中,与对照相比,JX2的降幅较小,最大为49.76%,JZ343降幅较大,已达到88.79%(图2B-C)。24天时,各基因型的值在不同盐处理下均显著低于对照,其中,JL1和JZ343的Pn值较低,较对照降幅较大(图2D)。
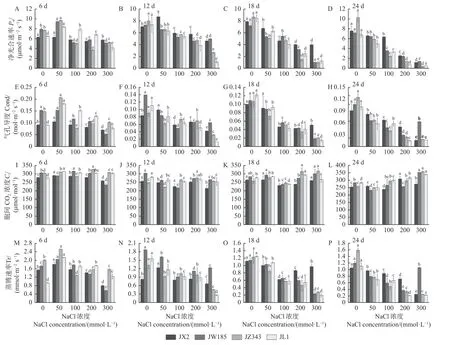
图2 NaCl处理对核桃幼苗光合参数的影响Fig. 2 Effects of NaCl treatment on the photosynthetic parameters of walnut seedlings
Cond和Tr的变化趋势和Pn值类似,即随盐浓度的增加和胁迫时间的延长,总体呈下降趋势(图2E-H和图2M-P)。胁迫至24天时,与对照相比,JX2的Cond和Tr在各盐浓度下的降幅较小,JZ343降幅较大(图2H和图2P)。总体来说,JX2的Pn、Cond和值Tr的变化幅度相对较小,表现较好。
4种基因型的Ci值表现出不同的变化趋势,胁迫至24天时,JX2的Ci值呈先升后降再升高的趋势,JW185、JZ343和JL1的Ci总体呈先降后升的趋势,JW185在300 mmol·L-1时有所升高,较对照增幅为24.90%;JZ343和JL1在100 mmol·L-1开始有所上升,最大增幅分别为39.36%、19.21%(图2I-L)。Ci值的变化表明引起各基因型Pn值下降的主要限制因素可能不同。
2.3 NaCl胁迫下核桃幼苗REC和MDA含量的变化
2.3.1 相对电导率(REC) 随盐浓度增加和胁迫时间延长,4种基因型叶片的REC总体呈上升趋势(图3A-D)。胁迫至6天时,在各盐处理浓度下,4种基因型的REC与各自对照差异不大,表明胁迫初期,植株受损不严重(图3A)。12天时,与对照相比,JX2在各处理下的增幅最小,最大为20.07%,JL1增幅最大达41.42%(图3B)。18天时的变化趋势与12天时类似(图3C)。24天时,在200 mmol·L-1NaCl胁迫下,JL1和JZ343的REC值均超过80%(图3D)。

图3 NaCl处理对核桃幼苗REC和MDA含量的影响Fig. 3 Effects of NaCl treatment on the REC and MDA content of walnut seedlings
2.3.2 MDA含量 叶片中MDA含量的变化与REC类似(图3E-H)。胁迫至6天时,各基因型的MDA与对照相比无显著差异(图3E)。12天时,JX2在各盐处理下的MDA含量与对照差异不显著,其他3种基因型均在300 mmol·L-1NaCl胁迫与对照形成显著差异,并且上升到最大值,其中,JZ343含量最高,为0.026 μmol·g-1,增幅为35.86%(图3F)。18天时,JL1和JZ343的MDA含量总体较高,较对照增幅较大(图3G)。24天时,JX2的MDA含量较低,较对照增幅较小,JZ343则相反(图3H)。
2.4 NaCl胁迫下核桃幼苗渗透调节物质的变化
2.4.1 Pro含量 随盐浓度的增加和胁迫时间的延长,4种基因型叶片的Pro含量总体呈上升趋势(图4)。胁迫至6天时,在50和100 mmol·L-1NaCl胁迫下,JX2的Pro含量较对照显著升高,最大增幅为29.53%,其他盐处理与对照无显著差异;其他3种基因型在各处理间均无显著差异(图4A)。12天时,JX2和JW185的Pro含量较对照显著升高,而JL1和JZ343各处理下的值均无显著差异(图4B)。18天时,与对照相比,各基因型的含量均显著增加,其中,JX2在高盐浓度下的含量较高(图4C)。24天时,JX2的含量随盐浓度的增加而增加,其他3种基因型呈先升后降趋势,在200 mmol·L-1NaCl胁迫时开始降低,但仍高于对照(图4D)。以上结果表明,盐胁迫下,JX2和JW185积累了大量的Pro。
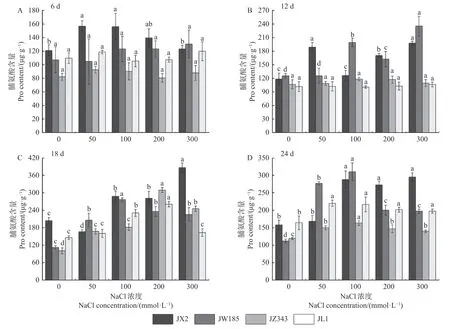
图4 NaCl处理对核桃幼苗Pro含量的影响Fig. 4 Effects of NaCl treatment on the Pro content of walnut seedlings
2.4.2 SS含量 随盐浓度的增加和胁迫时间的延长,4种基因型叶片的SS含量总体呈先升后降趋势(图5)。胁迫至6天时,JX2和JZ343在各处理下的含量较高(图5A)。12天时,与对照相比,JX2在各盐处理下SS含量的增幅大,范围在22.23%~32.27%,而JW185和JL1增幅均在20.00%以下;JZ343的SS含量较低,增幅均低于10.00%(图5B)。18天时,在50 mmol·L-1NaCl胁迫下,各基因型均出现最大值;在各盐浓度胁迫下,JX2的SS含量较高,JZ343较低(图5C)。24天时,JX2在各盐浓度下的SS含量较高,与对照相比增幅较大,最大增幅为26.12%,其他3种基因型最大增幅在10.00%左右(图5D)。以上结果表明,盐胁迫下,JX2具有较强的诱导SS合成和积累的能力。

图5 NaCl处理对核桃幼苗SS含量的影响Fig. 5 Effects of NaCl treatment on the SS content of walnut seedlings
2.5 NaCl胁迫下核桃幼苗酶活性的影响
2.5.1 SOD活性 随盐浓度的增加和胁迫时间的延长,各基因型的SOD活性总体呈先升后降的趋势(图6A-D)。胁迫至6天时,在不同处理下,JL1的SOD值较低,最大为172.121 U·g-1,JZ343的SOD值较高,约在190.000 U·g-1左右(图6A)。12天时,JW185的SOD值较高,JL1较低,并且,JL1的各处理间无显著差异(图6B)。18天时,JX2和JW185的SOD值总体较高,其中,JX2的SOD值随盐浓度的增加而显著增加(图6C)。24天时,JX2、JW185和JL1的SOD值随盐浓度的增加呈先升后降趋势,均在50 mmol·L-1NaCl胁迫时为最大值,而JZ343在各盐处理下的值均显著低于对照(图6D)。盐胁迫下,JX2和JW185的SOD值总体较高。

图6 NaCl处理对核桃幼苗SOD和POD活性的影响Fig. 6 Effects of NaCl treatment on the SOD and POD activities of walnut seedlings
2.5.2 POD活性 POD活性的变化与SOD活性相似,但同一时期各基因型在不同处理之间差异较小(图6E-H)。胁迫至6天时,JX2的POD活性总体较高,200 mmol·L-1NaCl时有最大值223.333 U·g-1,较对照显著升高24.65%,其他盐处理均与对照差异不大;其他3种基因型在各处理间均无显著差异(图6E)。12天时,JZ343在各处理间差异均不显著,其他3种基因型在不同盐处理下的值均高于对照,其中,JX2的值较高,增幅较大(图6F)。18天时,JX2和JL1均在100 mmol·L-1NaCl胁迫时有最大值,较对照分别显著升高52.78%、16.43%,其他盐处理与对照差异不显著;JW185和JZ343的各处理间无显著差异(图6G)。24天时,JX2的POD值总体较高,JZ343较低,但4种基因型各处理间差异均不显著(图6H)。随着胁迫程度的加深,4种基因型的POD活性变化并不显著,其中,JX2的POD活性总体较高。
2.6 NaCl胁迫下核桃幼苗内源激素含量的影响
在不同胁迫时期,随着NaCl浓度的增加,JX2和JWl85的IAA含量总体呈现先升后降的趋势,在50 mmol·L-1NaCl胁迫下有所升高,随胁迫浓度的继续增加,IAA含量又显著降低;JZ343和JL1的IAA含量总体呈现降低的趋势(图7A-D)。上述4种基因型的GA3和ZR的含量总体呈现降低的趋势,300 mmol·L-1NaCl胁迫至24 天时,与对照相比,GA3含量分别显著降低了18.84%、32.86%、19.05%和44.08%,ZR含量分别显著降低了26.31%、42.33%、55.64%和13.80%(图7I-P)。ABA的含量总体呈增加趋势,胁迫至24 天时,在300 mmol·L-1NaCl胁迫下,4种基因型的ABA含量较对照分别显著增加了40.51%、40.00%、88.74%和8.20%(图7E-H)。
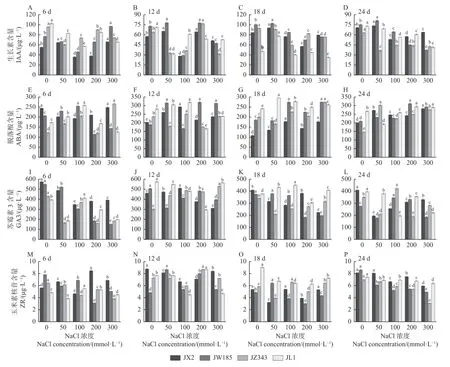
图7 NaCl处理对核桃幼苗内源激素含量的影响Fig. 7 Effects of NaCl treatment on endogenous hormones content of walnut seedlings
2.7 核桃耐盐性综合分析与评价
2.7.1 相关性分析 对各指标进行相关性分析,由图8可见,各指标之间存在不同程度的相关性。H△、D△和REC、MDA呈极显著负相关(P<0.01),REC和MDA呈极显著正相关(P<0.01),SOD、POD和SS含量两两之间均呈极显著正相关(P<0.01),Pro和SS呈显著正相关(P<0.05),ABA和Cond呈显著负相关(P<0.05),ABA与Tr呈极显著负相关(P<0.01)。说明在盐胁迫环境中,REC和MDA含量增加,植物生长量下降,各指标通过相互作用来应对盐胁迫环境,从而维持机体正常运行。

图8 指标相关性分析Fig. 8 Relevance analysis of traits
2.7.2 各单项指标的耐盐系数 根据公式计算各单项指标的耐盐系数,其中Pro的变异系数最大,为56.37%,其次为Pn,为53.57%,再次为MDA、Cond和D△,变异系数依次为49.11%、48.48%和46.97%;SS、SOD和POD的变异系数则较小,均低于15%(表2)。因此,盐胁迫对Pro、Pn、MDA、Cond和D△等指标的影响较大,这些变异系数较大的指标可以作为盐碱地核桃培育的首要参考指标。不同指标指示的理化状态不同,各基因型在盐胁迫下各单项指标的变化幅度不同,因此,各基因型的耐盐性并不能用某单个指标来衡量。
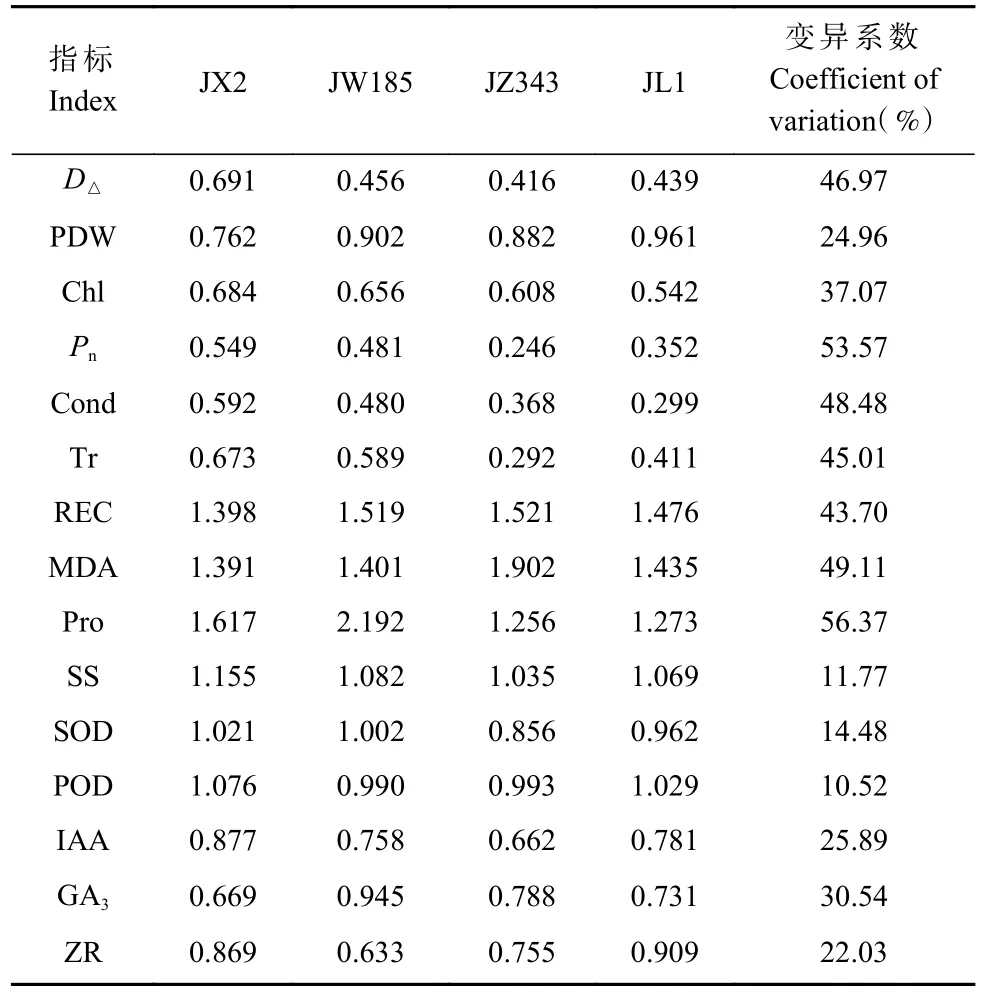
表2 不同核桃基因型各指标的耐盐系数①Tab. 2 Salt tolerance coefficient for each single index of different walnut genotypes
2.7.3 主成分分析 对4种基因型的15个指标的耐盐系数进行主成分分析,考虑到测定指标与耐盐性存在正相关以及负相关,因此可根据公式将耐盐系数进行均衡归一化处理。如表3所示,得出各主成分的特征向量。提取到特征值大于1的主成分3个,累计贡献率达100.00%(表4),因此,可用表5中提取到的3个主成分对4种基因型的耐盐能力进行综合评价。
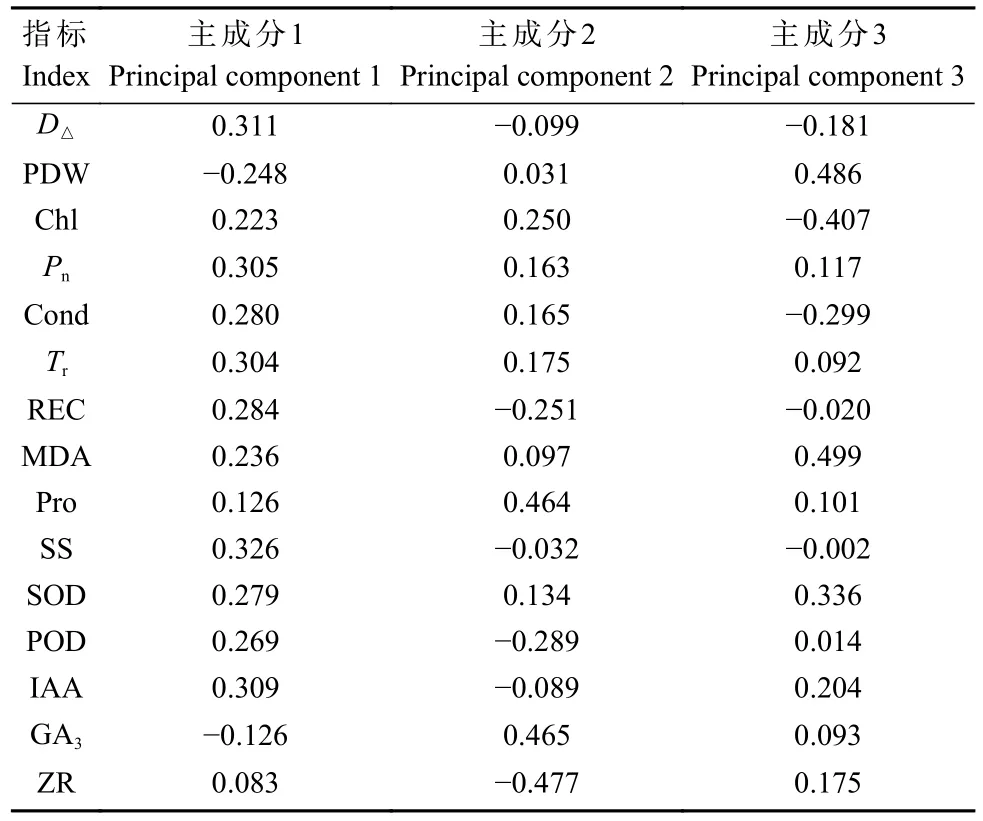
表3 15个单项指标在主成分中的特征向量Tab. 3 Eigenvectors of 16 single indexes in each principal component
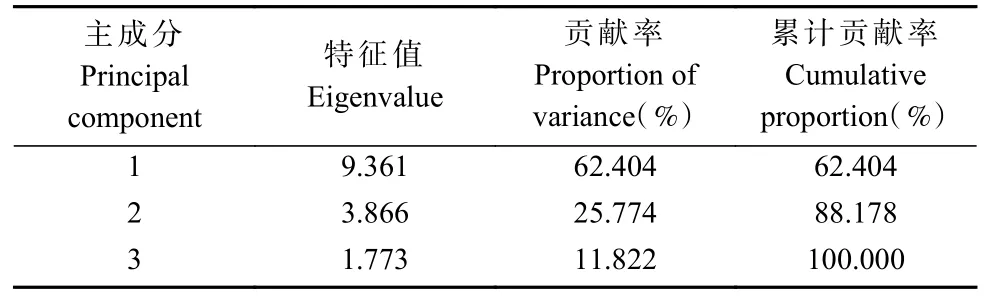
表4 各性状主成分分析Tab. 4 Major constituent analysis of traits
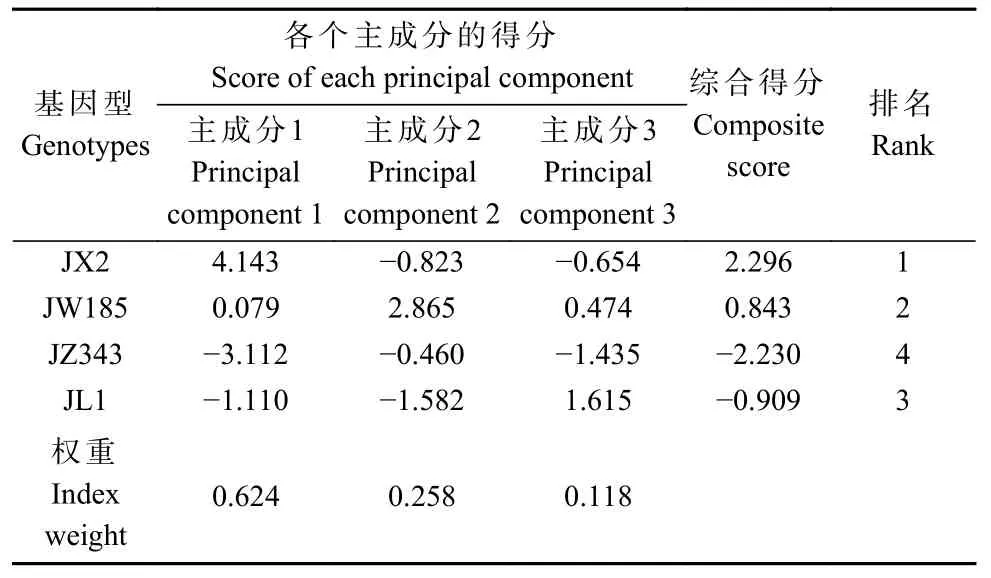
表5 不同核桃基因型耐盐能力综合评价Tab. 5 Comprehensive valuation of salt stress tolerance of different walnut genotypes
2.7.4 耐盐性综合评价 将耐盐系数进行标准化,各主成分的得分用标准化后的数值乘以各主成分的特征向量值,然后利用各主成分的权重建立主成分综合模型,计算每种基因型的综合评价值。综合评价值越大表明该基因型的耐盐能力越强。结果显示(表5),不同基因型耐盐强弱依次为:JX2 > JW185 >JL1 > JZ343。
3 讨论
3.1 NaCl胁迫对核桃幼苗生长的影响
生长特征是评价植物耐盐性最重要和最直观的指标(Liuet al., 2019)。本研究中,各基因型的苗高增量、地径增量及植株干质量均随NaCl浓度的增加而降低,其中,JX2的生长指标受抑制程度较轻,这表明盐胁迫对核桃幼苗的生长造成负面影响,并且不同基因型间存在差异。这与以往研究结果一致,即盐胁迫会在生长量、叶面积、叶片数或总生物量等方面抑制核桃的生长(高娅等,2019)。另外,随着胁迫程度的加深,幼苗均表现出不同程度的盐害症状,如叶片发黄、焦枯、卷曲、少量或大量脱落等。Rahneshan等(2018)和Abid等(2020)的研究中也表明,植物在受到盐胁迫时会出现不同程度的一系列叶片黄化、干枯、脱落等盐害症状。
3.2 NaCl胁迫对核桃幼苗光合特性的影响
叶绿素是植物进行光合作用的重要物质,其含量的多少在一定程度上反映出植物同化物质的能力(刘国华等,2018)。本研究中,在盐胁迫下,4种基因型的叶绿素含量明显降低,叶片出现黄化和焦枯等盐害症状,这可能是由于植物通过光合作用合成碳水化合物的最重要的光合色素含量下降所致,这些色素的含量会影响植物的生长。在Dichala等(2021)、Karimi等(2021)的研究中也表明,叶绿素随着NaCl浓度的增加而减少。在胁迫初期,JX2在各浓度下的叶绿素含量并不是最高的,但随着胁迫程度的加深,相比于其他3种基因型,在不同盐浓度下,JX2的叶绿素含量较其对照降幅最小,且含量也最高,表明JX2在盐胁迫下具有较强的保持叶绿素相对稳定的能力。
光合作用是植物生长的物质和能量来源。一些研究表明,NaCl胁迫下Pn的降低是多种生理反应的结果,包括Cond、Tr、叶绿素含量的降低,或这些参数的组合(Sarabiet al., 2019; Yuanet al., 2022)。一般来说,在盐胁迫下,植物会关闭气孔来避免水分通过蒸腾流失,这会导致Cond值下降(Yuanet al., 2022)。这一机制也限制了CO2的同化,从而减缓了光合作用过程,导致光合作用能力下降,限制了植物的生长(Fenget al., 2021; Banakaret al., 2022)。盐胁迫下诱导气孔关闭是植物减少或避免盐伤害的一种生理机制,本试验中生长参数下降的原因之一可能是由于气孔关闭和光合效率降低(Karimiet al., 2021)。随着胁迫程度的逐渐加深,4种基因型的Pn、Cond和Tr值总体呈降低趋势,其中,JX2各参数的变化幅度相对较小,表现较好。4种基因型的Ci值在不同胁迫时期及不同盐浓度下表现出不同的升降趋势,说明光合作用受到显著抑制的主要因素不同,由气孔限制和非气孔限制共同作用,从而导致光合作用的下降,并且气孔和非气孔限制之间随着盐浓度和胁迫时间的变化而发生动态变化。总之,光合作用是一个受内外因子综合影响的生理过程,因此,有关影响核桃树种光合作用的机理仍需进一步的研究。
3.3 NaCl胁迫对核桃幼苗膜透性的影响
植物的膜系统是在盐胁迫等逆境条件下最先感应到伤害的部位。细胞膜系统受到损伤,引起膜脂氧化反应,导致细胞膜透性增大,REC升高;而MDA是植物膜脂过氧化作用的产物之一,因此REC和MDA是衡量植物在逆境条件下受损伤程度的两个重要生理指标(Karimiet al., 2020; Zhuet al., 2021)。本研究结果表明,4种基因型的REC和MDA含量随盐浓度的增加和胁迫时间的延长总体呈上升趋势,说明在盐胁迫下,质膜受伤害程度逐渐加深。另外,相比于其他3种基因型,JX2的REC和MDA含量增加的相对较少,膜脂过氧化程度较低,膜结构的稳定得到了较好的保持,缓解了细胞所受到的高盐胁迫带来的氧化损伤。
3.4 NaCl胁迫对核桃幼苗渗透调节物质的影响
盐碱地中渗透势的增加会造成渗透胁迫,而植物通常会合成渗透调节物质来维持细胞内的渗透平衡。Pro和SS是促进植物适应逆境的重要渗透调节物质(Zhonget al., 2019)。Zhang等(2022)的研究表明,在盐碱胁迫下,8种苹果(Malus domestica)砧木基因型中的Pro和SS含量均有不同程度的增加,从而维持体内的渗透平衡。本试验中,随着胁迫程度的加深,各基因型的Pro含量总体呈上升趋势,原因可能在于盐胁迫条件下,Pro合成酶被激活,同时,Pro降解酶的活性被抑制,从而导致了Pro含量的积累。SS呈先升后降的趋势,可能是因为在长时间的高盐胁迫下,植株需要较多的能量来维持其自身的抗性生理。4种基因型中,JX2中积累的Pro和SS较多,JX2中较多的渗透调节物质,增加了渗透势,缓解了渗透胁迫,这可能是其具有较高耐盐性的原因之一。
3.5 NaCl胁迫对核桃幼苗酶活性的影响
胁迫环境可以诱导抗氧化酶活性的增加,如POD和SOD,它们与活性氧的清除密切相关,是应对非生物胁迫的重要防御机制(Fenget al., 2021; Zhuet al., 2021)。本研究结果表明,随盐浓度的增加和胁迫时间的延长,4种基因型的SOD和POD活性总体呈先升后降趋势,随着胁迫程度的不断加深,SOD和POD活性在高盐浓度下有所降低。这表明在盐胁迫下,为了清除过量的活性氧,减轻活性氧对细胞膜的伤害,各基因型的抗氧化能力均得到了增强,在一定的范围内,SOD和POD的活性较高,但在长时间以及高浓度的盐胁迫下,超过了幼苗的耐受范围,清除过氧化物自由基的能力下降,引起植物自身代谢失衡,各酶活性降低,幼苗的生长也随之变差,这与前人的研究结果类似(闫文华等,2019;刘昊等,2021)。另外,4种基因型中,JX2的SOD和POD活性总体较高,JZ343的POD活性在各胁迫时期差异均不显著,另外2种基因型也有类似的情况,由此推测在盐胁迫下,POD活性在提高幼苗的耐盐性方面可能并没有起到重要的作用。
3.6 NaCl胁迫对核桃幼苗内源激素的影响
在胁迫条件下,植物可以通过调节体内激素的含量变化,来调节生长节律和代谢活动,使植物能够维持正常的生理机能,从而适应外界胁迫环境(Yuet al.,2020)。ABA作为最重要的胁迫反应激素之一,能够诱导抗逆基因在胁迫条件下表达,同时可增强植物在盐渍环境中的适应能力(张敏等,2008; Chenet al.,2020)。有研究表明,当受到干旱或盐等非生物胁迫时,植物体内的ABA会出现不同程度的积累,ABA在叶片中的积累能够调节气孔的关闭,降低气孔导度和蒸腾速率,减少水分的散失,从而减轻盐胁迫带来的伤害(张敏等,2008; Chenet al., 2020; 张德等,2021)。本研究结果表明,随着盐浓度的增加,各基因型幼苗叶片中的ABA含量均有一定程度的增加,在相关性分析中,ABA与Cond、Tr值呈显著负相关,可以认为,ABA含量增加可以促进气孔关闭而减少水分散失和盐离子伤害,使幼苗在盐胁迫下能继续生长。
一般认为,ZR、GA3和IAA均为生长促进型激素,盐胁迫可诱导生长促进型激素减少(罗玉婕等,2021)。随着胁迫程度的逐渐加深,幼苗的ZR、GA3和IAA含量显著降低,可能是因为激素的调节能力有限,植物为了适应逆境而调控叶片气孔关闭,减轻胁迫带来的压力。在植物激素对盐胁迫的反应中,往往不是一种激素,而是多种激素协同变化,内源激素与植株对逆境环境的适应性密切相关。目前,关于核桃激素与抗盐性关系方面的研究还较少,并且,关于ABA、IAA、GA3和ZR等基于内源激素的化学信号的相对重要性,以及它们对植物在盐胁迫下气孔运动的交互作用还不明确,需要进一步的研究。
在自然条件下,盐碱地的成分比较复杂,除了有NaCl、Na2SO4等中性盐造成的土壤盐化问题外,还包括Na2CO3、NaHCO3等碱性盐造成的土壤碱化问题,并且,土壤盐化和碱化问题在实际的盐碱地中往往同时存在。另外,在植物对盐胁迫的响应过程中,往往会受到多种性状基因的调控,而处于不同的生态环境条件下以及不同生长发育阶段中的基因表达亦有显著差异,其所表现出的耐盐性强弱也可能存在不同。本研究仅进行了中性盐NaCl胁迫下的盆栽控制试验,没有进行大田试验,另外只针对特定环境下的某些生长及生理指标进行了探讨,不能完全反映核桃基因型的耐盐性。因此,若想对不同核桃基因型的耐盐碱性进行全面的评价,还需结合显微结构、矿质元素等更多方面的指标,且在自然条件下的土壤盐碱环境中栽培并对其生理生态响应和基因网络调控机制等方面进一步深入研究,才能得到更加科学全面的评判结果,为实际生产提供更可靠的理论依据。
4 结论
4种核桃基因型的各项生长及生理指标对盐胁迫均有一定的响应。盐胁迫下幼苗的生长状况均受到不同程度的影响,随着盐浓度的增加和胁迫时间的延长,幼苗的光合参数显著降低,REC和MDA含量持续增加,SOD和POD活性先上升后下降,Pro大量积累,SS先增加后减少,在增加ABA含量的同时减少了IAA等生长促进型激素的含量。通过主成分分析,对4种基因型的各单项指标进行耐盐性综合评价,耐盐性综合排序为JX2 >JW185 > JL1 > JZ343。
