藏花醛治疗干性年龄相关性黄斑变性机制的研究进展
2024-03-12王漫峤邵彦李筱荣
王漫峤,邵彦,2,李筱荣
年龄相关性黄斑变性(age-related macular degeneration,AMD)是一种常见且不可逆的视网膜疾病,其特征是视网膜中央黄斑区的进行性变性,主要累及视网膜光感受器、视网膜色素上皮(retinal pigment epithelium,RPE)细胞、Bruch's膜或黄斑区域的脉络膜微循环,是严重威胁老年人视力的主要原因之一[1-2]。AMD 具有多种分类方式,在临床上,其被分为正常衰老改变、早期、中期和晚期阶段[3]。在晚期出现新生血管的AMD,一般被称为湿性AMD(wet age-related macular degeneration,wAMD),而发展成地图样萎缩(geographic atrophy,GA)的AMD,被称为干性AMD(dry age-related macular degeneration,dAMD)[4-5]。从正常衰老过程演变到病理性AMD 主要归因于血管炎症、线粒体损伤、活性氧(reactive oxygen species,ROS)的积累以及RPE 细胞的衰老等病理过程。藏红花是一种原产于地中海和中东地区的药用植物,在既往研究[6]中发现,藏红花具有抗氧化、抗炎、降血压和降血脂等特性。而其主要成分藏花醛,也被发现可以减少白细胞介素(interleukin,IL)-1β、IL-6、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子的产生,减少过氧化氢刺激引起的氧化应激,同时还可以抑制细胞的凋亡[6-8]。wAMD的治疗关键就在于抑制新生血管的生成,目前抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物已成为其一线标准治疗方案,但在dAMD 中尚未找到有效的治疗方法[3]。因此,藏花醛很有可能成为治疗dAMD 的有效药物,相关的机制研究也亟待探索。本文就dAMD 的发病机制、藏花醛的药理学特性以及藏花醛对治疗dAMD的潜在机制等方面进行综述,现报道如下。
1 AMD的分类
AMD 的病理特征包括黄斑区玻璃膜疣(drusen)、RPE 萎缩、脉络膜新生血管(choroidal neovascularization,CNV)形成、视网膜神经上皮层脱离和盘状瘢痕或病变[9]。玻璃膜疣是AMD 诊断的重要标志,由细胞碎片、脂蛋白和淀粉样蛋白沉积物等组成,其中β-淀粉样蛋白1-40(amyloid β-protein 1-40,Aβ 1-40)被发现是玻璃膜疣的主要成分之一[10]。
在临床上,AMD 通常可以分成4 个阶段[11-12]。第一阶段为正常衰老变化阶段,在此阶段存在的玻璃膜疣,直径≤63 μm,同时无AMD 色素异常。第二阶段为早期AMD 阶段,RPE 细胞和脉络膜之间的病理性分子碎片及玻璃膜疣的沉积逐渐增大,出现中等大小的玻璃膜疣(直径63~125 μm),不伴有色素异常。在早期AMD 中,RPE 细胞骨架发生改变,导致正常规则的多边形形状丧失,RPE细胞死亡和视网膜色素减少。随着RPE 细胞骨架的改变,细胞扩大和融合导致局部分裂、碎裂、增厚和细胞内的应力纤维出现[13-15]。第三阶段为中期AMD 阶段,玻璃膜疣继续增大,直径达到125 μm 以上,伴或不伴有色素变化。第四阶段为晚期AMD阶段,分成2 种临床形式,即出现新生血管的wAMD 和出现GA 的dAMD。当玻璃膜疣范围逐渐扩大并伴有RPE 细胞和光感受器的丢失时,则出现了GA 的改变。而wAMD 是由于促VEGF 和抗VEGF 的平衡发生改变,以CNV 为特征[15]。目前,对于wAMD 的治疗,可以采用玻璃体腔注射抗VEGF 药物来治疗,临床上常见的药物都对wAMD 有良好的疗效[16]。但是对于dAMD,目前却没有发现有效的治疗方法,因此,寻找有效控制dAMD进展的方法成为热点研究方向。
2 dAMD的病因和发病机制
AMD 是一种多因素疾病,包括遗传和生活方式在内的各种复杂因素,影响了疾病的易感性、发展和严重程度,具体的发病机制尚不明确,有可能涉及到RPE 细胞衰老、氧化应激、脂类代谢、炎症和免疫等[15,17]。
遗传因素是AMD 发病的重要因素,相关遗传学研究[3,18]发现,多种与AMD 相关的基因参与补体途径、脂质代谢、血管生成、免疫、细胞运动、细胞骨架构建、细胞凋亡和增殖、细胞间连接和胶原纤维的构成等。有一些生活方式和环境因素,也可能会造成AMD 的发生,例如吸烟、紫外线照射以及缺氧等,长时间处于氧化损伤的环境中,可能会造成机体的ROS 大量积累,进而发生基因水平的改变,造成不可逆性伤害[3,19-20]。
从机制上来讲,RPE 细胞衰老,会造成黄斑区细胞外基质中酶的平衡被破坏,使代谢物沉积在Bruch's膜上,形成玻璃膜疣,损害周围的视网膜组织结构[3]。ROS 的产生与其在体内抗氧化防御系统消除之间的不平衡被认为是衰老和神经退行性疾病的原因,同时视网膜作为人体耗氧量最高的组织器官之一,随着年龄的增长,视网膜中ROS 的大量累积,造成视网膜层间结构的损伤,也可能是dAMD 的发病机制之一[21-22]。研究[23]发现,脂质相关途径和基因可能会造成AMD发生的风险,同时也发现dAMD 与血清高密度脂蛋白(highdensity lipoprotein,HDL)和血清硫代内酯酶活性增高有关[24],因此,脂类代谢的异常也可能导致光感受器和RPE 细胞的凋亡,进而使dAMD 发生。炎症反应在AMD 中的重要性也在近年逐渐显现,有研究[25]发现,玻璃膜疣可能导致RPE 层的局部毒性,并在AMD 的发病机制中诱导局部炎症反应。玻璃膜疣中含有多种促炎因子,如补体激活剂、补体片段和膜攻击复合体(membrane attack complex,MAC)[20],与补体(complement,C)系统相关的蛋白质功能异常导致体内平衡失衡,通常会导致健康组织的损伤。有研究[20,26-27]发现,补体途径关键的补体因子(complement factor,CF)的高等位基因Y402H 恰好与早期AMD 中MAC 水平的增高和脉络膜毛细血管萎缩风险增加有关,激活补体途径而出现的MAC可以在Bruch's 膜发生沉积,造成脉络膜毛细血管的萎缩和玻璃膜疣的形成,同时CFH、CFB、CFD、CF1、C1、C3 和C5 的上调被认为是GA 发生发展的危险因素[28]。还有研究[28-29]发现,补体活化可以使补体蛋白、补体基因表达水平上调的年龄依赖性增加,促使MAC 沉积,以及在视网膜中发现炎性细胞因子和趋化因子,这些均证明了补体活化是GA 发生发展的关键因素。
3 藏红花对dAMD的作用
藏红花[19]是一种原产自地中海和中东地区的芳香药用植物,主要由藏花酸(crocetin)、藏红花素(crocins)和藏花醛(safranal)组成,具有神经保护、抗氧化和抗炎作用[6]。研究[30]发现,藏红花能有效降低AMD 实验模型大鼠的视网膜变性[31],同时可有效维持视网膜形态结构。在光损伤的动物模型中,发现在藏红花处理过的受损视网膜组织中,可以检测到藏红花素[32],也发现口服藏花酸可以减少光感器细胞的凋亡,防止闪光视网膜电图的a波和b波振幅的降低,还可以减少视网膜外核层中凋亡细胞的数量,并抑制了外核层厚度变薄[33]。在针对AMD 患者的对照研究[34-36]中,也发现持续的藏红花治疗可以改善患者视力和闪光视网膜电图(flash electroretinogram,fERG)的结果,证明藏红花可以适度改善AMD 患者的视觉功能。藏红花的这种神经保护作用除了可能与其抗氧化特性和参与调节基因作用有关,还有可能是与控制神经胶质细胞释放促炎细胞因子的抗炎作用有关[37]。而藏花醛作为藏红花的有效成分之一,也有潜力通过其自身特性来发挥治疗dAMD的作用。
4 藏花醛治疗dAMD的潜在机制
4.1 细胞凋亡
藏花醛对细胞凋亡的作用具有双面性。细胞凋亡通常伴随着半胱氨酸天冬氨酸水解酶(cysteinyl aspartate specific proteinase,Caspase)的激活,其中Caspase-3 可以被视为细胞凋亡的特异性标志物[38]。B 淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)是一种抗凋亡蛋白,而Bcl-2 相关x 蛋白(Bcl-2associated x protein,Bax)具有促凋亡作用,在免疫细胞稳态中起到重要作用,两者均属于Bcl-2 家族,利用靶向线粒体膜达到调节细胞凋亡的作用[39]。有研究[40]发现,在神经细胞株PC12细胞中,藏花醛可以有效减少Caspase-3的表达水平和Bax/Bcl-2 的比值,说明其通过抑制氧化应激和细胞凋亡来减弱缺血再灌注引发的PC12 细胞的损伤,达到防止神经毒性的作用。在糖尿病视网膜病变的高糖细胞模型中也发现,藏花醛可以减轻视网膜微血管内皮细胞(human retinal microvascular endothelial cell,HRMEC)的损伤,保护其免于细胞凋亡,并抑制其迁移和黏附[41]。而在肿瘤细胞中,藏花醛则表现出促凋亡和降低细胞活力的作用,考虑其可能具有对癌细胞的选择性细胞毒性作用[42-43]。细胞凋亡作为导致AMD 光感受器及RPE 细胞功能丧失的重要机制之一,藏花醛有可能通过调节细胞凋亡来起到治疗dAMD的作用。
4.2 氧化应激
视网膜受到氧化应激的作用而发生组织结构的损伤是dAMD 的发病机制之一。研究[44]表明,藏花醛的抗氧化性可以影响多种细胞的ROS 水平和细胞活力,包括主动脉内皮细胞、多巴胺能细胞、支气管上皮细胞、红细胞以及肝癌细胞,涉及丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路、Kelch 样ECH 相关蛋白1(Kelchlike ECH-associated protein 1,Keap1)/核转录因子E2 相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)信号通路、一氧化氮(NO)生成和清除羟基自由基等病理生理过程,保护细胞免受损伤。还有研究[45]发现,藏花醛可以通过增加抗氧化防御来有效保护易感老年大鼠的大脑免受氧化损伤,起到抗衰老和神经保护的作用。因此,藏花醛的抗氧化特性可能帮助RPE 细胞免受氧化应激的损伤而达到预防、延缓或者治疗dAMD的作用。
4.3 自噬
有研究[46]发现,自噬在保护RPE细胞免受氧化应激和脂褐素积累方面起着重要作用,并且自噬的损伤可能会加剧氧化应激并导致dAMD 的发生。增加自噬通量可以保护RPE细胞免受氧化损伤和死亡,而下调自噬通量会使RPE 细胞更容易受到氧化应激的影响。由此可见,自噬和氧化应激之间可能存在相互作用,氧化应激促进自噬,增加自噬减少氧化损伤并增加抗氧化能力,从而减少氧化应激[47]。藏花醛的抗氧化特性已被基本确定,但其调节自噬的能力目前仍待进一步研究。
4.4 调节免疫与炎性反应
玻璃膜疣作为dAMD 的主要病理产物,含有多种促炎因子和免疫分子,揭示了免疫与炎性反应参与dAMD 的视网膜萎缩及RPE 变性的病理过程[48]。研究[49]发现,藏花醛可以抑制脂多糖刺激的小鼠单核巨噬细胞和骨髓来源巨噬细胞中NO 的产生,并降低诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2)的水平;还可以降低单核巨噬细胞中IL-6 和TNF-α 的产生以及mRNA 表达,并抑制了MAPK 和核因子κB(nuclear factor κB,NF-κB)途径组分的磷酸化和核易位。在结肠炎动物模型中,藏花醛可以缓解临床症状,降低炎症的严重程度、炎症的受累范围和隐窝损伤,还发现可以使结肠组织中的巨噬细胞浸润有所减少,肠系淋巴结和脾脏中的巨噬细胞数量减少,IL-6 和TNF-α 的表达水平也下降[49]。因此,藏花醛在免疫细胞和炎症反应中表现出来的抗炎特性也有可能成为治疗dAMD 的关键,而其与dAMD 发病机制之一的补体活化之间的关系也有待后续研究。
以上对于藏花醛在治疗dAMD 方面存在的潜在机制,总结如图所示(图1)。
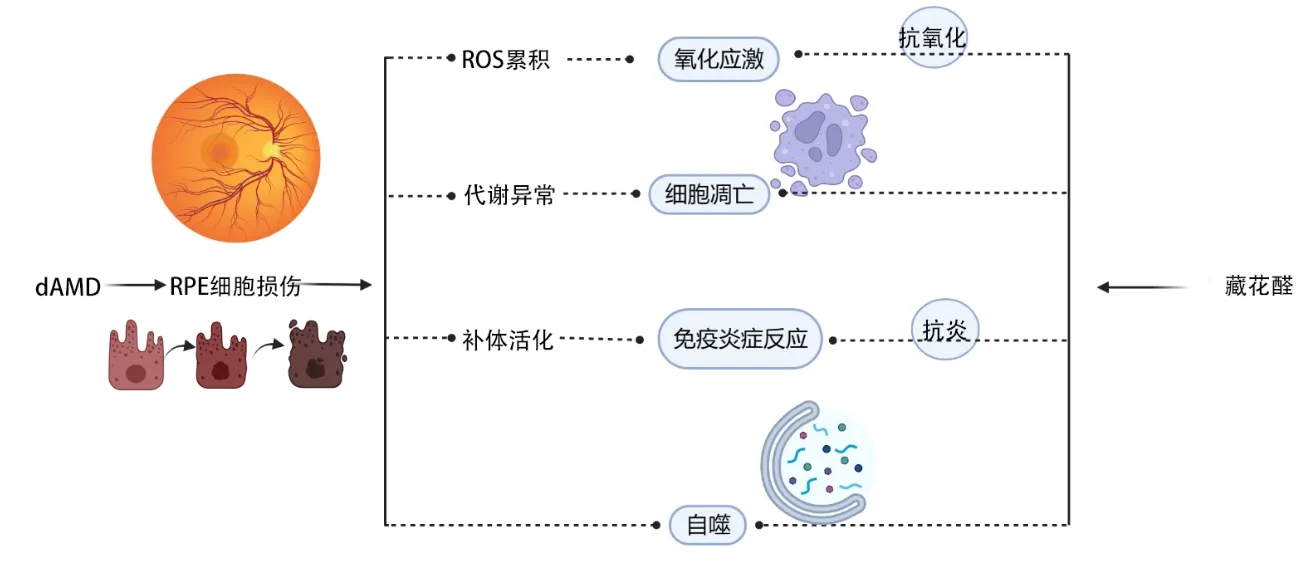
图1 dAMD发病机制与藏花醛治疗的潜在机制示意图
5 小结
随着全球预期寿命的增加,AMD 的患病率也逐年增高。相较于wAMD已有多种治疗方案,可以明确控制疾病的进展和提高患者的预后视力,dAMD 目前缺乏一种有效的治疗方法,许多针对其复杂的病因和发病机制的研究也尚在实验室阶段,进入临床试验阶段的药物也并未取得绝对良好的治疗作用。此外,探究最接近人类的dAMD 动物模型也尚在探索中[50]。藏花醛作为藏红花的主要成分之一,自身具有的抗氧化、抗炎以及神经保护等特性,或许可以利用其在调节细胞凋亡、氧化应激、调控自噬、免疫与炎症反应等方面的作用起到治疗dAMD 或延缓疾病进展的功效,为dAMD 的临床治疗提供新的思路,同时也可以增强人们对于药用植物相关成分研究的兴趣,为拓展中药治疗领域的发展起到关键作用。
