细菌纤维素-明胶/丝素蛋白双层支架的制备及其性能
2024-03-12孙卫华陈驰昊吕向国王秀华
孙卫华,陈驰昊,李 喆,吕向国,王秀华
(1.浙江理工大学材料科学与工程学院,杭州 310018;2.嘉兴学院材料与纺织工程学院,浙江嘉兴 314001;3.上海交通大学医学院附属仁济医院泌尿科,上海 200127)
0 引 言
长段尿道狭窄是泌尿外科一种常见的疾病,组织工程技术有望成为治愈该疾病的有效方法。支架材料可以为细胞生长提供空间结构与力学支撑,并通过模拟体内微环境促进组织重建与再生,因此在组织工程研究中具有重要作用[1-3]。研究表明,高度模拟细胞外基质(Extracellularmatrix,ECM)的纳米三维网络结构会影响细胞行为,进而提高细胞黏附、增殖及蛋白表达,促进组织重建[4-7]。
天然可降解的生物材料已广泛用于制备尿道组织工程支架。明胶(Gelatin, Gel)和丝素蛋白(Silk fibroin, SF)是尿道组织工程中常用的两种天然生物材料。Gel具有良好的生物相容性及可降解性,且降解产物毒性较低;SF具有良好的力学强度及可塑性。以明胶和丝素蛋白为原料制备的疏松多孔支架,兼具两者的优良性能。BC具有良好的持水性能、机械性能及生物相容性,且其三维纳米网络结构能够完美模拟天然ECM[8-10]。因此,BC三维纳米网络结构与Gel/SF多孔支架进行结合,有望应用于尿道组织修复。
本文将Gel与SF水溶液进行混合,通过冷冻干燥法制备Gel/SF管状多孔支架,探究了不同预冻温度对支架多孔结构的影响,选择与尿道组织多孔结构相近的Gel/SF支架,并以其为模板,采用原位发酵法使BC与Gel/SF支架复合,最终得到具有多尺度结构的双层支架Gel/SF/BC。对Gel/SF/BC双层支架的结构及性能进行测试表征,分析其微观形貌、化学结构、力学性能及生物相容性。本文的研究结果可为尿道、血管、皮肤等组织工程支架的设计与构筑提供新的思路与方法。
1 实验部分
1.1 实验材料与仪器
主要材料:木葡糖酸醋杆菌1.1812,购自中国科学院微生物研究所;酵母膏、鱼粉蛋白胨和戊二醛(生物试剂),购自国药集团化学试剂有限公司;葡萄糖、磷酸氢二钠、柠檬酸、磷酸二氢钾、无水乙醇和明胶(分析纯),购自国药集团化学试剂有限公司;曲拉通 X-100(化学纯),购自上海源叶生物科技有限公司;最低限量基本培养基(MEM,AH29917357),购自上海桥星贸易有限公司;L-929细胞(购自中科院上海细胞库);胎牛血清(FBS,NYN0769),购自上海桥星贸易有限公司;二苯基四氮唑溴盐(MTT,J17GS15117),购自上海源叶生物科技有限公司;青霉素链霉素(J210042),购自上海桥星贸易有限公司;高糖液体培养基(DMEM,PM150210),购自武汉普诺赛生命科技有限公司;苯酚和溴化锂(分析纯),购自上海麦克林生化科技有限公司;2,4-二硝基氯苯(分析纯),购自上海博飞美科化学科技有限公司;十二烷基硫酸钠(色谱纯),购自上海麦克林生化科技有限公司;高密度聚乙烯薄膜(海门市扬子医疗器械有限公司);雄性豚鼠(普通级),购自邳州市东方养殖有限公司;道康宁硅胶及其固化剂(DC184),购自北京瑞德佑业科技有限公司;蚕茧(浙江嘉欣丝绸股份有限公司)。
主要仪器:超声诊断仪(东芝Aplio 500),购自日本东芝医疗系统株式会社;冷冻干燥机(SCIENTZ-18 N),购自上海双旭电子有限公司;3D打印机(Creater Pro),购自浙江闪铸三维科技有限公司;电热恒温培养箱(DHP-9082),购自济源千司生物技术有限公司;立式高压蒸汽灭菌锅(申安LDZX-50KBS),购自上海习仁科学仪器有限公司;扫描电镜(Apreo S),购自美国赛默飞公司;傅里叶变换红外光谱仪(VERTEX 70),购自德国布鲁克公司;X射线薄膜衍射仪(D8 ADVANCE型),购自德国布鲁克公司;万能试验机(Instron 5982),购自美国英斯特朗公司。
1.2 Gel/SF管状多孔支架的制备
图1为Gel/SF管状多孔支架的制备流程图。通过超声扫描获取尿道组织二维断层图片(图1(a)),对二维断层图片做数据识别处理,利用imaris软件对处理后的系列二维断层图片进行三维重建及拟合(图1(b)),再经3DMax软件平滑处理后得到尿道三维数字模型(图1(c)),3D打印得到ABS材质的尿道节段性三维实体模型(图1(d))。硅胶和固化剂按照质量比100∶5进行混合,将3D打印模型放入方形透明塑料器皿中并注入上述混合试剂,固化后的硅胶进行倒模处理,得到具有尿道组织宏观形貌的硅胶模具(图1(e))。将Gel/SF混合倒入硅胶模具,冷冻干燥后得到Gel/SF管状多孔支架(图1(f))。

图1 Gel/SF管状多孔支架的制备流程图
将10 g脱胶处理后的蚕茧在质量分数60%的溴化锂溶液中60 ℃条件下溶解5 h,多层纱布过滤,然后用去离子水透析3 d,每隔12 h换水;透析完成后的SF溶液冷冻干燥,制得纯SF。取纯SF溶于去离子水中,配制质量分数5%的SF水溶液,将Gel溶于45 ℃去离子水中,配制质量分数5%的明胶溶液,将两种溶液等体积混合后注入硅胶模具中,分别在-20、-80 ℃以及液氮(-196 ℃)中冷冻12 h,然后进行冷冻干燥,得到Gel/SF管状多孔支架。
1.3 Gel/SF/BC双层支架的制备
配制发酵培养液(5 g/L酵母膏、5 g/L鱼粉蛋白胨、50 g/L葡萄糖、2 g/L磷酸氢二钠、1 g/L柠檬酸、1 g/L磷酸二氢钾),待上述物质充分溶解后,放入立式高压蒸汽灭菌锅中进行灭菌,并在121 ℃、0.1 MPa下灭菌30 min。
采用质量分数0.5%的戊二醛无水乙醇溶液交联Gel/SF管状多孔支架10 min,用发酵培养液清洗3次,置换出多余的戊二醛溶液。将处理后的Gel/SF管状多孔支架重新放置于硅胶模具中,配制菌种密度为107个/mL的木葡糖酸醋杆菌发酵培养液,并将其注入模具内。待发酵培养液充分浸润Gel/SF管状多孔支架后,放入恒温培养箱中,35 ℃发酵培养7 d,获得Gel/SF/BC双层支架。将双层支架浸入医用酒精消毒处理24 h,用质量分数1%的曲拉通 X-100浸泡处理24 h,并用超纯水清洗3次,除去多余的试剂。
1.4 样品表征
1.4.1 形貌及结构分析
采用扫描电镜对管状样品内表面及横截面结构进行观察,采用Image J软件进行测量,并用Origin软件统计进行分析(n=200,n为统计数量),利用傅里叶变换红外光谱仪及X射线薄膜衍射仪对双层支架进行化学结构测试。
1.4.2 孔隙率测试
采用乙醇置换法测量支架孔隙率。取冻干后的支架称重为m1,将其完全浸没在无水乙醇中,用滤纸轻蘸去表面多余液体后称重为m2;将多孔支架放入20 mL量筒中,缓慢倒入乙醇至10 mL,添加乙醇的体积为V;计算样品的孔隙率,每组支架测试3个样品。孔隙率P用式(1)计算:
(1)
其中:m1为支架冻干后的质量,g;m2为浸泡无水乙醇2 h后的质量,g;V为添加的乙醇的体积,mL;ρc为无水乙醇密度,g/mL。
1.4.3 吸水量测试
将支架置于去离子水中浸泡24 h,支架取出后用滤纸将支架表面多余的水分擦拭干净,用电子天平称重得到湿态质量Ws,然后将支架进行冷冻干燥,称重得到干态质量Wd。计算出支架的吸水量,每组支架测试3个样品。吸水量通过式(2)计算:
(2)
其中:Sr为吸水量;Ws为支架在去离子水中浸泡24 h后的质量,g;Wd为冷冻干燥后干态质量,g。
1.4.4 力学性能测试
采用万能试验机对材料进行力学性能测试。将样品统一裁剪为25×4×2 mm3的样条进行拉伸力学性能的测试,拉伸速率为5 mm/min。
循环压缩力学性能测试:湿态下的Gel/SF多孔支架以及Gel/SF/BC双层支架进行压缩循环测试。将样品采用相同的工艺条件,统一制备为直径15 mm,高16 mm的圆柱状样品,压缩至样品发生60%形变,然后恢复至0%,压缩速率为10 mm/min,重复10次循环。
1.4.5 细胞毒性试验
体外细胞毒性试验按照《医疗器械生物学评价 第5部分:体外细胞毒性试验》(GB/T 16886.5—2017)进行测试。将L-929细胞在含10%胎牛血清和抗生素(青霉素100 μg/mL,链霉素100 μg/mL)的MEM培养液进行培养后,分别加入100 μL Gel/SF/BC试验样品浸提液(100%)、阳性对照(含0.5%苯酚的DMEM培养液)和阴性对照液(高密度聚乙烯薄膜的浸提液),37 ℃、5% CO2培养24 h,每组做6个平行;培养24 h后,做细胞形态学观察及吸光度的测定。
1.4.6 皮肤致敏和皮肤刺激试验
皮肤致敏试验和皮肤刺激试验按照《医疗器械生物学评价 第10部分:刺激与皮肤致敏试验》(GB/T 16886.10—2017)进行测试。
皮肤致敏试验过程:选取15只雄性豚鼠将其分为2组:其中阴性对照组为5只动物/组,试验组为10只动物/组。试验前24 h将实验动物背部左侧去毛,去毛范围约为4~6 cm2。无菌条件下制备Gel/SF/BC样品与阴性对照组,样品规格为2.5 cm×2.5 cm,将试验组(Gel/SF/BC)及对照组(医用纱布)样品在动物背部去毛区域进行贴敷并诱导激发致敏反应。在24 h与48 h后观察动物激发部位皮肤反应,并按照Magnusson and Kligman分级表评分。
皮肤刺激试验过程:在给药前24 h内,将动物背部两侧去毛,去毛面积约为10 cm×15 cm。将试验组(Gel/SF/BC)及对照组(医用纱布)样品在两侧去毛区域进行贴敷并做包扎处理,贴敷持续4 h后,移除样品。移除样品后分别于1、24、48 h和72 h观察动物皮肤红斑和水肿反应并按照皮肤反应记分表进行记分。
2 结果与讨论
2.1 Gel/SF管状多孔支架在不同预冻温度下的多孔结构
图2为不同预冻温度下制备的Gel/SF管状多孔支架截面SEM图像及孔径分布。图2显示:预冻温度为-20 ℃的Gel/SF管状多孔支架为大孔结构,孔洞之间连通性较好,孔径为(141±78)μm(图2(a));随着预冻温度降低至-80 ℃,Gel/SF多孔结构的孔径变小,且孔洞周围分布有闭合的凹陷结构,孔洞之间的连通性较差,孔径为(23±18)μm(图2(b));在-20 ℃和-80 ℃下,Gel/SF管状多孔支架孔径大小以及结构变化,发现在恒定温度场下,冰晶颗粒生长至最终定型时的尺寸随着温度降低而变小,冷冻干燥升华从而形成具有不同孔径的多孔结构;-196 ℃的Gel/SF支架的多孔结构类似于一种取向结构,孔径为(88±23)μm(图2(c))。研究发现,-196 ℃下的多孔结构孔径并没有随着温度的下降而减小。这是因为硅胶模具自身的低导热性,在冷冻时一维方向上存在温度场(即-196 ℃到室温35 ℃),冰晶沿着一维方向的温度场而生长,导致冷冻干燥所形成的多孔结构会存在取向结构,且不同位置处截面的多孔结构及孔径大小存在差异[10-11]。由于人尿道脱细胞基质海绵体层孔径大小为100~300 μm,因此,在-20 ℃的冷冻条件制备的Gel/SF管状多孔支架更适合作为尿道组织修复支架。
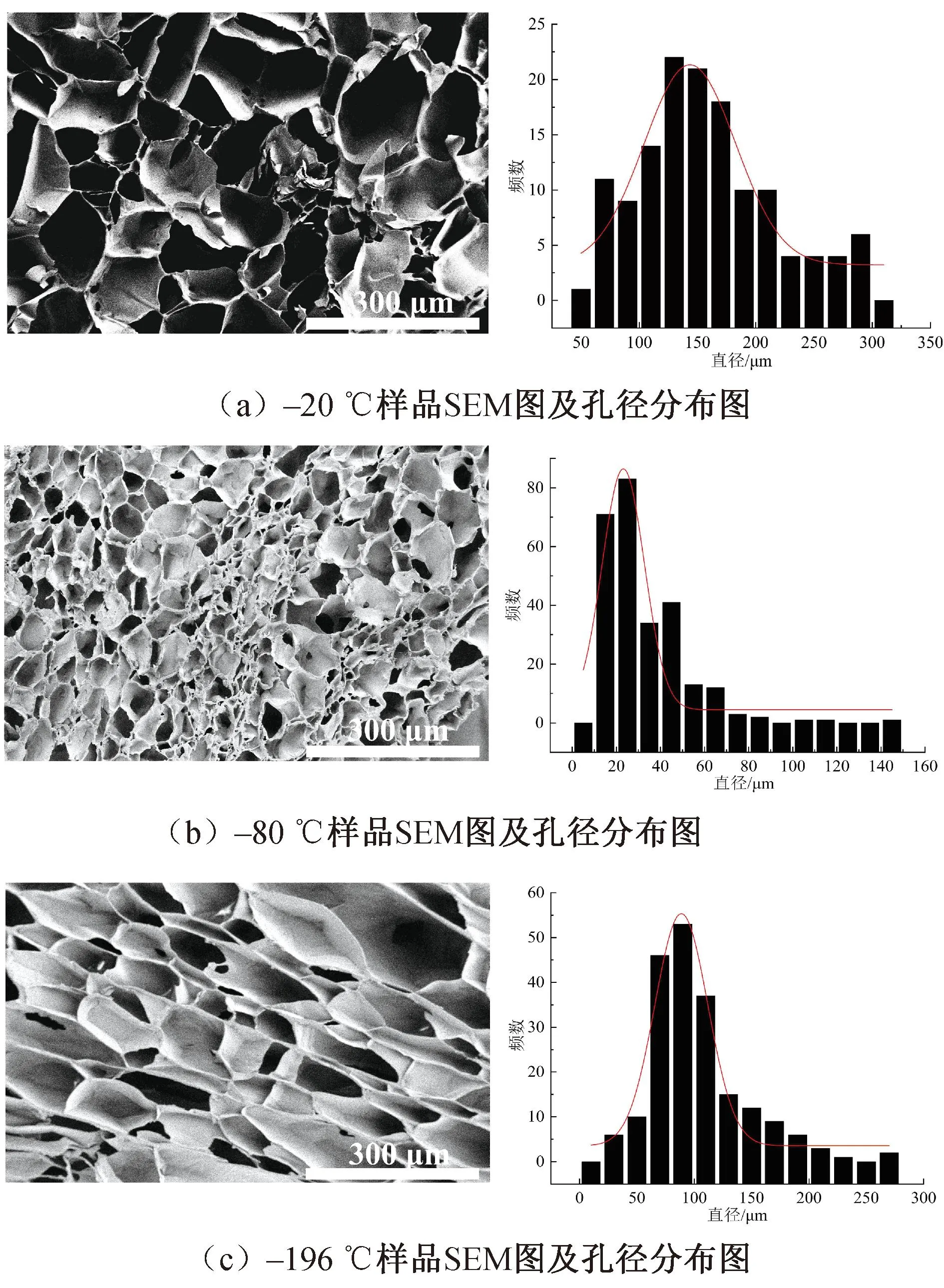
图2 不同温度下Gel/SF支架的SEM图及孔径分布图
2.2 Gel/SF/BC双层支架微观形貌分析
图3为-20 ℃预冻温度下所制备的Gel/SF/BC双层支架SEM图像。Gel/SF/BC内侧是单纯BC形成的致密层,外侧是以Gel/SF管状多孔支架为骨架复合BC纳米纤维的多孔疏松层,多孔疏松层是由微米级的多孔结构组成,孔与孔之间相互连通,孔径的大小为(143±40)μm(图3(a)),与同条件下制备的Gel/SF管状多孔支架孔径一致。
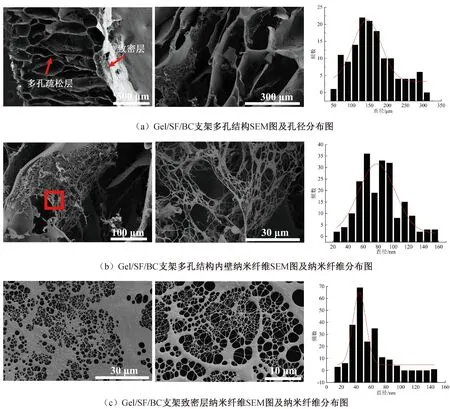
图3 Gel/SF/BC双层支架多级结构SEM图及孔径、纳米纤维分布图
进一步对多孔结构内壁同一位置进行分级观察,在微米级多孔结构内壁存在BC三维纳米网络纤维,纳米级纤维直径为(78±24)nm(图3(b))。
观察Gel/SF/BC双层支架的致密层,其内表面拥有致密的细菌纤维素层,厚度为(29±4)μm,纳米纤维相互交错形成的蛛网结构,构成蛛网结构的纳米纤维直径在(44±8)nm(见图3(c))。纳米纤维的分布呈现蛛网结构,是由于Gel/SF管状多孔支架与木醋杆菌在培养液中的静电作用力,改变了木醋杆菌的聚集状态,进而影响到纳米纤维的自组装过程,最后呈现出不同形貌结构的纳米纤维网络[12]。静态培养的细菌纤维素为三维无序纳米纤维网络结构,而通过静电作用力的控制可得到特殊的蛛网结构或树枝状结构[13]。在双层支架的多尺度结构中,纳米级纤维占比为87.5%,亚微米级纤维占比12.5%。因此,BC的纳米纤维贯穿于Gel/SF管状多孔支架的内壁及其内表面。
对比原位发酵法所制备的Gel/SF/BC双层支架与人尿道脱细胞基质的多尺度结构,结果如表1所示。由表1可知,Gel/SF/BC双层支架与尿道脱细胞基质的厚度近乎一致,双层支架的疏松多孔层平均孔径(143±40)μm,其内壁纳米纤维直径为(78±24)nm,致密层纳米纤维直径(44±8)nm。而人尿道的脱细胞基质海绵体层孔径(146±39)μm,纳米纤维直径(30±7)nm,致密层纳米纤维直径(25±5)nm。因此,Gel/SF/BC双层支架的多尺度结构接近于人体尿道脱细胞基质。

表1 Gel/SF/BC双层支架和尿道脱细胞基质的多级结构
2.3 Gel/SF/BC双层支架化学结构分析

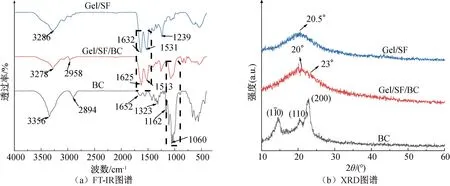
图4 不同样品的FT-IR和XRD图谱
2.4 Gel/SF/BC双层支架孔隙率及吸水量
组织工程支架应具有较高的孔隙率及相互连通的多孔结构,这对细胞的生长、迁移以及新陈代谢等有着重要的影响[18]。对不同样品孔隙率及吸水量进行对比,结果如图5所示。由图5可知Gel/SF支架和Gel/SF/BC双层支架的孔隙率都在80%以上,对于尿道组织工程而言已基本满足[19]。Gel/SF多孔支架孔隙率为85.8%,Gel/SF/BC双层支架的孔隙率为81.3%,双层支架的孔隙率相对Gel/SF较低,是因为Gel/SF多孔结构的孔壁上原位生长的BC对其孔隙率有一定的影响。Gel/SF/BC双层支架的吸水量为16.1,是Gel/SF的1.1倍,两者由于其多孔结构存在,均具有较强的吸水性能。但Gel/SF/BC双层支架的多孔结构里原位生长了纳米级BC,并具有更小孔径的三维网络结构,使得该双层支架的吸水性能较Gel/SF具有明显的提升。

图5 不同样品孔隙率及吸水量
2.5 Gel/SF/BC双层支架力学性能分析
天然BC本身具有良好的力学性能,其应用于支架材料的制备可使材料的力学性能得到改善[20]。对不同样品的拉伸性能进行对比,结果如图6所示。Gel/SF/BC双层支架在72.5 kPa处发生材料的断裂(见图6(a)),其断裂强度与断裂伸长率分别是Gel/SF的1.3倍和1.1倍(见图6(b)),这表明Gel/SF/BC双层支架具有更好的抵抗外力拉伸形变能力,原位发酵生长的BC为Gel/SF支架带来力学性能上的提升。

图6 不同样品的拉伸性能
新生的组织需要适当的压缩力学性能提供支撑,以提供和维护细胞生长所必需的空间环境,并维持一定时间直至新生组织具有一定的自身生物力学特性[21-22]。对不同样品进行压缩性能的比较,结果如图7所示。Gel/SF/BC双层支架第一次循环压缩的应力-应变曲线所对应的最大应力为88.2 kPa,杨氏模量为127.7 kPa,在经过第十次循环压缩后其最大压缩应力降低为83.1 kPa,杨氏模量降低为90.9 kPa,其第一次循环压缩对应的最大压缩应力以及杨氏模量分别为Gel/SF的1.4倍、1.6倍,经过第十次循环压缩对应的最大压缩应力以及杨氏模量分别为Gel/SF的1.4倍、1.7倍(见图7(c)—(d))。这表明Gel/SF/BC双层支架具有更好的耐压缩性能,Gel/SF/BC双层支架上原位生长的BC含有大量羟基,与Gel/SF形成氢键,提高了双层支架的力学性能。

图7 不同样品的压缩性能
2.6 双层支架细胞毒性测试
采用二苯基四氮唑溴盐(MTT)比色法,用各实验组的浸提液培养L-929细胞,并对其增殖情况进行评价。细胞经过24 h的培养后,对比不同实验组的吸光度,结果如图8所示。阳性对照组对比其他组的吸光度较低,显微镜观察L-929细胞几乎没有增长,这表明在含0.5%苯酚的DMEM培养液中细胞无法正常增殖生长。对比阳性组,空白样品、阴性对照组及Gel/SF/BC浸提液(100%),实验组的吸光度相对较强,说明细胞生长状况较好。对比实验组的吸光度(OD值),发现Gel/SF/BC实验组样品浸提液OD值(0.218±0.002)稍低于空白对照组(0.324±0.012)。按照标准设定空白对照组对应的存活率为100%,则实验组Gel/SF/BC的存活率为86.7%。对实验组进行细胞形态学的观察,仅观察到轻微的细胞生长抑制现象,推测Gel/SF/BC双层支架在采用曲拉通 X-100浸泡处理去除内毒素后,存在微量的残留,从而影响了细胞生长。实验样品的细胞存活率为86.7%,高于标准中细胞存活率应不小于70%的要求,说明实验样品Gel/SF/BC对L-929无明显细胞毒性。

图8 24 h后不同样品的吸光度
2.7 双层支架皮肤致敏性与皮肤刺激性测试
皮肤致敏性实验结果:Gel/SF/BC样品与阴性对照组样品评分均为0(无明显改变),阳性对照组评分为2(致敏物为2,4-二硝基氯苯,中度融合性红斑),说明Gel/SF/BC样品无皮肤致敏性。
皮肤刺激性实验结果:Gel/SF/BC样品实验组与阴性对照组原发性刺激指数均为0(极轻微刺激性),阳性组(20%十二烷基硫酸钠)原发性刺激指数均为4.1(中等微刺激性),说明Gel/SF/BC样品无皮肤刺激性。
3 结 论
本文采用原位发酵法将BC与Gel/SF管状多孔支架复合,得到具有模拟尿道组织多尺度结构的Gel/SF/BC双层支架。Gel/SF/BC双层支架表现出良好的力学性能、吸水性能及生物相容性,在尿道组织工程材料具有一定的应用前景。主要结论如下:
a)制备的Gel/SF/BC双层支架,实现了对尿道组织宏观形貌、微米级多孔、纳米级纤维的结构模拟。Gel/SF/BC双层支架宏观形貌长度为9.3 mm,平均孔隙率为83.1%,其中:内侧致密层由直径为(44±8)nm的单纯BC构成,外侧多孔疏松层以孔径为(143±40)μm的Gel/SF多孔支架为骨架,直径为(78±24)nm的BC纳米纤维在其孔壁表面分布。
b)Gel/SF/BC双层支架其力学强度相比于Gel/SF多孔支架有所提升,Gel/SF/BC断裂强度为72.5 kPa,是Gel/SF的1.3倍。Gel/SF/BC经过10次循环压缩对应的最大压缩应力以及杨氏模量分别为Gel/SF的1.4倍、1.7倍。Gel/SF/BC双层支架相比于Gel/SF多孔支架吸水量有所提升,为Gel/SF的1.1倍。
c)Gel/SF/BC双层支架无细胞毒性、无皮肤致敏与皮肤刺激反应,具有较好的生物相容性,能够应用于尿道组织工程。
