五味子多糖对2 型糖尿病大鼠胰岛素抵抗及AMPK/Nrf2/TXNIP 通路的影响
2024-03-12刘枘岢胡园园李雯翀陈毅光
刘枘岢,胡园园,李雯翀,陈毅光
(1.东莞市松山湖中心医院内分泌代谢科,广东 东莞 523326; 2.华中科技大学协和深圳医院内分泌代谢科,广东 深圳 518052)
糖尿病是以高血糖为主要特征的代谢性疾病,其特征是胰岛素分泌不足或对胰岛素代谢作用的敏感性降低。近年来,2 型糖尿病(T2DM) 的患病率在世界范围内不断增加,到2045 年将有大约6.29 亿人患T2DM[1-2]。虽然当前的一些治疗策略可改善T2DM,但它们的副作用和耐受仍不能忽视。五味子是木兰科植物的果实,含有多糖、木脂素等活性成分[3-4],具有保肝、抗肿瘤、抗氧化、抗炎、改善血糖等活性,能降低T2DM 大鼠炎症相关因子肿瘤坏死因子-α (TNF-α) 和空腹血糖(FBG) 水平,提高空腹胰岛素水平和糖耐量,缓解胰岛素抵抗[5]。胰岛素抵抗是T2DM 的决定性因素[1],炎症会促进胰岛素抵抗[6]。然而,关于五味子多糖改善胰岛素抵抗的作用机制尚不清晰。单磷酸腺苷激活蛋白酶(AMPK) 在能量转换、葡萄糖代谢、脂肪代谢等过程中发挥作用,激活AMPK 相关通路对于改善T2DM 小鼠机体炎症反应、脂质代谢、胰岛素抵抗具有积极作用[7]。AMPK 磷酸化可促进核因子E2 相关因子2(Nrf2) 激活,降低硫氧还蛋白互作蛋白(TXNIP) 表达,抑制机体炎症反应[8]。本研究旨在探究五味子多糖治疗糖尿病的可能作用机制,以期为临床治疗糖尿病提供理论依据。
1 材料
1.1 动物 SPF 级Wistar 健康雄性大鼠,购于省医学实验(广东) 动物中心,实验动物生产许可证号SCXK (粤)2018-0002,鼠龄6 周左右,体质量(170±10) g。分笼饲养,12 h/12 h 昼夜交替,温度25 ℃,相对湿度50%,保持环境清洁。研究遵循“3R” 原则并经东莞市松山湖中心医院动物伦理委员会批准(伦理号2020-0410)。
1.2 试剂 链脲佐菌素 ( STZ)、AMPK 抑制剂dorsomorphin (批号T1507、T1977) 购于上海陶素生化科技有限公司; 五味子多糖(纯度≥95%,批号RH704002)购于上海融禾医药科技发展有限公司; TNF-α、IL-6、IL-1β ELISA 试剂盒,HE 染色试剂盒,BCA 蛋白浓度检测试剂盒(批号PT516、PI328、PI303、C0105S、P0012S) 购于上海碧云天生物科技有限公司; 大鼠胰岛素ELISA 试剂盒、高效RIPA 裂解液(批号SEKR-0033、R0010) 购于北京索莱宝科技有限公司; 兔源AMPK、Nrf2、TXNIP、NLRP3、GAPDH 一抗、羊抗兔IgG 二抗(批号ab32047、ab137550、ab188865、ab263899、ab8245、ab133470) 购于英国Abcam 公司。
1.3 仪器 小动物血糖测试仪(上海玉研科学仪器有限公司); BX61 显微镜(日本Olympus 公司); XElx-800 酶标仪(美国Perkin Elmer 公司); 1659001 蛋白电泳仪、Trans-Blot Wistar 转膜仪(美国Bio-Rad 公司); GIS-500 凝胶成像仪(杭州米欧仪器有限公司)。
2 方法
2.1 造模 Wistar 大鼠50 只,随机选取10 只为对照组(常规饲料喂养); 另40 只构建T2DM 大鼠模型[9],喂养高脂高糖饲料(63.9% 普通饲料、20% 蔗糖、10% 猪油、5%蛋黄粉、1%胆固醇、0.1%猪胆汁酸钠),喂养8 周后腹腔注射25 mg/kg STZ,72 h 后尾静脉取血,以FBG>7.1 mmol/L、餐后2 h 血糖(P2BG) >11.1 mmol/L 为造模成功。造模过程中出现大鼠死亡或不符合条件的现象,及时挑选备用大鼠进行造模处理。
2.2 分组及给药 将造模成功的大鼠随机分为模型组、五味子多糖组、AMPK 抑制剂组、五味子多糖+AMPK 抑制剂组,五味子多糖组大鼠每天灌胃给予100 mg/kg 五味子多糖[10],AMPK 抑制剂组大鼠每天腹腔注射20 mg/kg AMPK抑制剂dorsomorphin[11],五味子多糖+AMPK 抑制剂组大鼠在灌胃给予五味子多糖后腹腔注射dorsomorphin,连续4周,模型组及对照组大鼠给予等体积生理盐水。
2.3 大鼠FBG、P2BG 检测 分别在给药前、给药第2 周、给药第4 周,大鼠禁食12 h,取其空腹尾静脉血,检测FBG、P2BG。
2.4 大鼠胰岛素抵抗相关指标检测 末次给药结束后禁食12 h,取尾静脉血,静置20 min 后低温离心15 min,取血清,按相关试剂盒说明书操作,用ELISA 法检测血清胰岛素水平,计算胰岛素敏感指数(ISI),公式为ISI =ln [1/(血清胰岛素水平×FBG) ]。
每组取4 只大鼠用于胰岛素耐量检测,上午禁食4 h后,腹腔注射胰岛素0.5 U/kg,在注射后30、60、90 min尾静脉取血检测血糖水平。
2.5 HE 染色观察大鼠胰腺组织病理损伤 每组取6 只大鼠,腹腔注射10%水合氯醛后处死,剖开腹腔,分离胰腺,用生理盐水清洗,部分冷冻保存备用; 部分置于10%多聚甲醛中固定48 h,将胰腺组织经过脱水、透明处理后包埋于融化的石蜡中,待其凝固后修剪成合适形状并切成厚度约4 μm 的切片,行HE 染色,按相关试剂盒说明书操作,封片、干燥后于光学显微镜下观察。
2.6 ELISA 法检测大鼠血清炎症因子水平 取“2.4” 项下各组大鼠尾静脉血清,按相关试剂盒说明书操作,检测TNF-α、IL-6、IL-1β 水平。
2.7 Western blot 法检测大鼠胰腺组织AMPK/Nrf2/TXNIP通路相关蛋白表达 取于-80 ℃冰箱保存的大鼠胰腺组织,加入RIPA 组织裂解液制成匀浆,提取胰腺组织总蛋白,采用BCA 蛋白检测试剂盒检测蛋白浓度并定量,高温加热变性后电泳分离蛋白质,转膜后5%脱脂奶粉溶液封闭2 h,加入兔源一抗p-AMPK (1 ∶2 000)、AMPK (1 ∶2 000)、Nrf2 (1 ∶500)、TXNIP (1 ∶1 000)、NLRP3 (1 ∶1 000)、GAPDH (1 ∶1 000),4 ℃孵育过夜,TBST 清洗3 次,加入辣根过氧化物标记的二抗,孵育1 h,TBST 洗涤后显色、定影,以GAPDH 为内参,对各组条带进行分析,计算蛋白相对表达量。
2.8 统计学分析 通过SPSS 23.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。P<0.05 表示差异具有统计学意义。
3 结果
3.1 五味子多糖对T2DM 大鼠FBG、P2BG 水平的影响 与对照组比较,模型组大鼠FBG、P2BG 水平升高(P<0.05); 给药第2 周、第4 周,与对照组比较,模型组大鼠FBG、P2BG 水平升高(P<0.05); 与模型组比较,五味子多糖组和五味子多糖+AMPK 抑制剂组大鼠FBG、P2BG 水平降低(P<0.05),AMPK 抑制剂组大鼠FBG、P2BG 水平升高(P<0.05); 与五味子多糖组比较,AMPK 抑制剂组和五味子多糖+AMPK 抑制剂组大鼠FBG、P2BG 水平升高(P<0.05),见表1。
表1 各组大鼠FBG、P2BG 水平比较(mmol/L,±s,n=10)
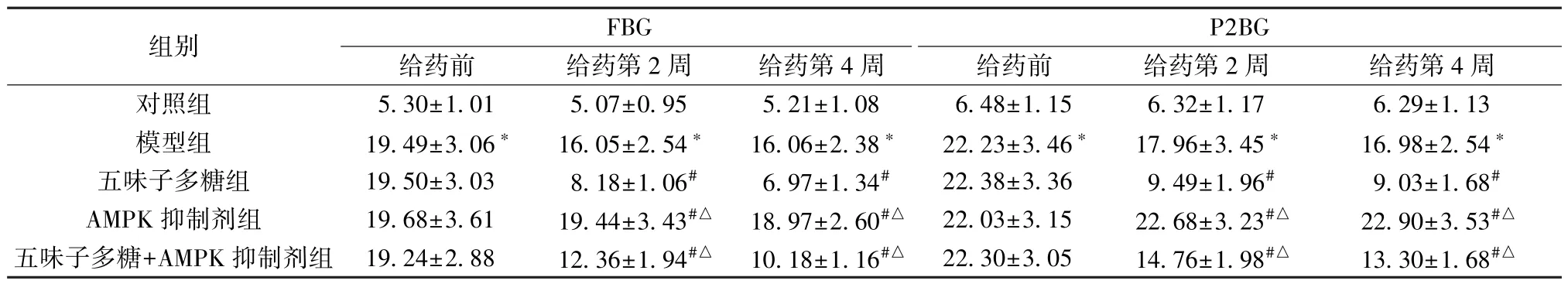
表1 各组大鼠FBG、P2BG 水平比较(mmol/L,±s,n=10)
注: 与对照组比较,∗P<0.05; 与模型组比较,#P<0.05; 与五味子多糖组比较,△P<0.05。
组别FBG P2BG给药前给药第2 周给药第4 周给药前给药第2 周给药第4 周对照组5.30±1.015.07±0.955.21±1.086.48±1.156.32±1.176.29±1.13模型组19.49±3.06∗16.05±2.54∗16.06±2.38∗22.23±3.46∗17.96±3.45∗16.98±2.54∗五味子多糖组19.50±3.038.18±1.06#6.97±1.34#22.38±3.369.49±1.96#9.03±1.68#AMPK 抑制剂组19.68±3.6119.44±3.43#△ 18.97±2.60#△ 22.03±3.1522.68±3.23#△22.90±3.53#△五味子多糖+AMPK 抑制剂组 19.24±2.8812.36±1.94#△ 10.18±1.16#△ 22.30±3.0514.76±1.98#△13.30±1.68#△
3.2 五味子多糖对T2DM 大鼠胰岛素抵抗相关指标的影响 与对照组比较,模型组大鼠血清胰岛素、血糖水平升高(P<0.05),ISI 值降低(P<0.05); 与模型组比较,五味子多糖组和五味子多糖+AMPK 抑制剂组大鼠血清胰岛素、血糖水平降低(P<0.05),ISI 值升高(P<0.05),AMPK 抑制剂组大鼠血清胰岛素、血糖水平升高(P<0.05),ISI 值降低(P<0.05); 与五味子多糖组比较,AMPK 抑制剂组和五味子多糖+AMPK 抑制剂组大鼠血清胰岛素、血糖水平升高(P<0.05),ISI 值降低(P<0.05),见表2、图1。
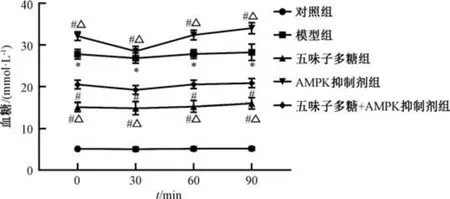
图1 各组大鼠血糖水平比较(±s,n=10)
表2 各组大鼠血清胰岛素水平及ISI 比较(±s,n=10)

表2 各组大鼠血清胰岛素水平及ISI 比较(±s,n=10)
注: 与对照组比较,∗P<0.05; 与模型组比较,#P<0.05; 与五味子多糖组比较,△P<0.05。
组别血清胰岛素/(mIU·L-1)ISI 值对照组56.89±5.58-5.69±0.18模型组75.21±7.38∗-7.08±0.28∗五味子多糖组62.40±6.10#-6.07±0.25#AMPK 抑制剂组83.31±8.44#△-7.37±0.33#△五味子多糖+AMPK 抑制剂组68.50±6.82#△-6.54±0.32#△
3.3 五味子多糖对T2DM 大鼠血清TNF-α、IL-6、IL-1β 水平的影响 与对照组比较,模型组大鼠血清TNF-α、IL-6、IL-1β 水平升高(P<0.05); 与模型组比较,五味子多糖组和五味子多糖+AMPK 抑制剂组大鼠血清TNF-α、IL-6、IL-1β 水平降低(P<0.05),AMPK 抑制剂组大鼠血清TNF-α、IL-6、IL-1β 水平升高(P<0.05); 与五味子多糖组比较,AMPK 抑制剂组和五味子多糖+AMPK 抑制剂组大鼠血清TNF-α、IL-6、IL-1β 水平升高(P<0.05),见表3。
表3 各组大鼠血清TNF-α、IL-6、IL-1β 水平比较(μmol/L,±s,n=10)

表3 各组大鼠血清TNF-α、IL-6、IL-1β 水平比较(μmol/L,±s,n=10)
注: 与对照组比较,∗P<0.05; 与模型组比较,#P<0.05; 与五味子多糖组比较,△P<0.05。
组别TNF-αIL-6IL-1β对照组149.93±11.2358.19±5.1042.20±5.79模型组199.60±15.67∗99.38±10.74∗142.49±19.74∗五味子多糖组168.08±12.38#68.20±6.13#82.48±14.07#AMPK 抑制剂组225.06±16.83#△112.06±12.30#△171.35±18.24#△五味子多糖+AMPK 抑制剂组181.84±12.06#△86.30±10.34#△100.38±11.27#△
3.4 五味子多糖对T2DM 大鼠胰腺组织形态学的影响 正常组大鼠胰腺组织结构完整,胰岛内细胞数量多,细胞排列致密均匀,无明显病变; 与对照组比较,模型组大鼠胰腺组织受损较严重,胰岛形态不规则,胰岛细胞胞质减少,一些胰岛细胞还在细胞质中表现出液泡变性,炎症细胞浸润明显; AMPK 抑制剂组胰腺组织损伤程度较模型组加重,胰岛细胞空泡变性和炎症细胞增多; 与模型组比较,五味子多糖组大鼠胰腺逐渐恢复,胰岛细胞内细胞质明显增多,空泡变性和炎症细胞浸润减少; 与五味子多糖组比较,五味子多糖+AMPK 抑制剂组大鼠胰腺组织损伤加重,较多胰岛细胞空泡变性,炎症细胞浸润增加,见图2。

图2 各组大鼠胰腺组织HE 染色(×200)
3.5 五味子多糖对T2DM 大鼠胰腺组织AMPK、Nrf2、TXNIP 蛋白表达的影响 与对照组比较,模型组大鼠胰腺组织Nrf2 蛋白表达、p-AMPK/AMPK 比值降低(P<0.05),TXNIP、NLRP3 蛋白表达升高(P<0.05); 与模型组比较,五味子多糖组和五味子多糖+AMPK 抑制剂组大鼠胰腺组织Nrf2 蛋白表达、p-AMPK/AMPK 比值升高 (P<0.05),TXNIP、NLRP3 蛋白表达降低(P<0.05),AMPK 抑制剂组大鼠胰腺组织Nrf2 蛋白表达、p-AMPK/AMPK 比值降低(P<0.05),TXNIP、NLRP3 蛋白表达升高(P<0.05); 与五味子多糖组比较,AMPK 抑制剂组和五味子多糖+AMPK抑制剂组大鼠胰腺Nrf2 蛋白表达、p-AMPK/AMPK 比值降低(P<0.05),TXNIP、NLRP3 蛋白表达升高(P<0.05),见表4、图3。

图3 各组大鼠胰腺组织AMPK/Nrf2/TXNIP 通路相关蛋白条带图
表4 各组大鼠胰腺组织AMPK、Nrf2、TXNIP 蛋白表达比较(±s,n=3)
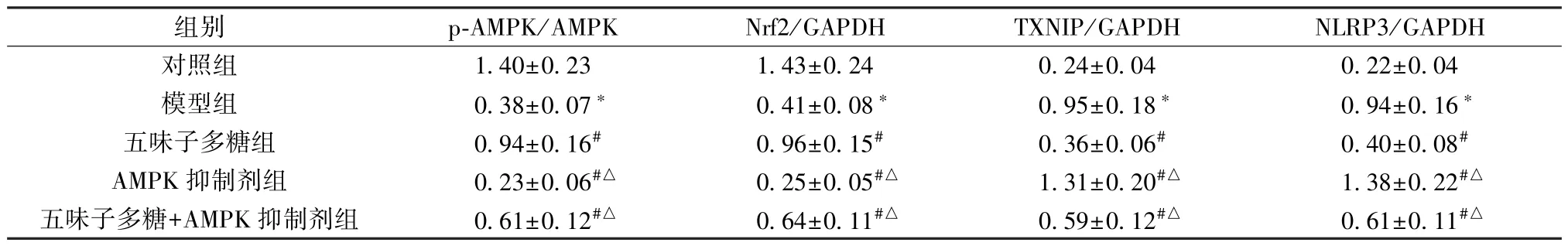
表4 各组大鼠胰腺组织AMPK、Nrf2、TXNIP 蛋白表达比较(±s,n=3)
注: 与对照组比较,∗P<0.05; 与模型组比较,#P<0.05; 与五味子多糖组比较,△P<0.05。
组别p-AMPK/AMPKNrf2/GAPDHTXNIP/GAPDHNLRP3/GAPDH对照组1.40±0.231.43±0.240.24±0.040.22±0.04模型组0.38±0.07∗0.41±0.08∗0.95±0.18∗0.94±0.16∗五味子多糖组0.94±0.16#0.96±0.15#0.36±0.06#0.40±0.08#AMPK 抑制剂组0.23±0.06#△0.25±0.05#△1.31±0.20#△1.38±0.22#△五味子多糖+AMPK 抑制剂组0.61±0.12#△0.64±0.11#△0.59±0.12#△0.61±0.11#△
4 讨论
近年来,T2DM 发病率呈现持续升高趋势,具有高致残率和高致死率。T2DM 发病机制复杂,其中胰岛素抵抗是主要病因之一,已知氧化应激、炎症反应等是胰岛素抵抗发生的重要机制。高脂饮食及小剂量注射STZ 是目前常用的构建大鼠T2DM 模型的方法[8],本研究采用此方法成功构建T2DM 大鼠模型,显示高脂高糖饲料喂养及STZ 可使大鼠产生高血糖、胰腺组织受损、胰岛素抵抗、炎症反应等多种不良影响。
近年来,天然活性物质在T2DM 的治疗中具有积极作用,并得到国内外学者的广泛关注[12-13]。五味子是木兰科植物,其成熟的果实中含有木脂素、挥发油、多糖等活性成分,具有保肝、抗肿瘤、抗氧化、抗炎、降血糖等作用[14]。多糖是五味子的重要生物活性成分,多项研究表明五味子多糖具有改善血糖的作用,能缓解胰腺组织病变,降低大鼠血糖水平[15]。Jin 等[16]研究显示,五味子多糖可通过AMPK 途径改善大鼠肝细胞中葡萄的糖消耗,并参与预防和缓解胰岛素抵抗。本研究结果显示,五味子多糖治疗的大鼠胰腺组织损伤得到一定缓解,大鼠FBG、P2BG 以及血清胰岛素、炎症因子水平降低,ISI 值升高,提示五味子多糖可改善T2DM 大鼠的血糖水平、胰腺组织损伤、胰岛素抵抗及炎症反应,对于治疗T2DM 具有一定的价值。
AMPK/Nrf2/TXNIP 通路与糖尿病、炎症反应联系密切,AMPK 是一种丝/苏氨酸蛋白激酶,参与调控胰岛素抵抗、葡萄糖代谢、脂肪代谢,在T2DM、肥胖等代谢类疾病中低表达[6,17]。多项研究表明,激活AMPK 相关通路在改善T2DM 小鼠胰岛素抵抗[7]、调节糖尿病肝糖原代谢[18]中发挥重要作用。Nrf2 为核转录因子,提高Nrf2 表达可预防T2DM 并发症,并发挥抗炎作用。TXNIP 调控NLRP3 炎症小体和促炎因子,降低TXNIP 表达可抑制NLRP3 激活,从而降低TNF-α、IL-6、IL-1β 等炎症因子水平,磷酸化的AMPK 可促进Nrf2 激活并抑制TXNIP 表达,对于抑制炎症反应具有积极意义[19-21]。本研究结果显示,T2DM 大鼠胰腺组织p-AMPK/AMPK、Nrf2 蛋白表达较对照组降低,TXNIP、NLRP3 蛋白表达升高,经过五味子多糖治疗后,大鼠胰腺组织 p-AMPK/AMPK、Nrf2 蛋白表达升高,TXNIP、NLRP3 蛋白表达降低; 并且在五味子多糖干预的基础上,使用AMPK 抑制剂可减弱五味子多糖对T2DM 大鼠胰岛素抵抗的改善作用,表明五味子多糖具有一定的激活AMPK/Nrf2 通路,抑制TXNIP、NLRP3 表达的作用。以上结果提示五味子多糖可能通过调控AMPK、Nrf2,抑制TXNIP 发挥抗糖尿病作用。
综上所述,五味子多糖对T2DM 大鼠胰岛素抵抗有一定的缓解作用,可能是通过激活AMPK/Nrf2/TXNIP 通路实现,但相关机制复杂,是否有其他通路间接参与介导,仍需深入研究。
