补阳还五汤通过Cav-1 抑制铁死亡对脑缺血小鼠的神经保护作用
2024-03-12刘英飞陈博威田丰铭欧阳银刘柏炎
刘英飞,陈博威,田丰铭,欧阳银,易 健,刘柏炎,4∗
(1.湖南中医药大学,湖南 长沙 410208; 2.益阳医学高等专科学校附属医院,湖南 益阳 413046;3.湖南中医药大学第一附属医院,湖南 长沙 410021; 4.湖南省中医药研究院,湖南 长沙 410013)
脑缺血为一种常见的脑血管疾病,是全球致死和成人致残的主要原因,严重威胁人类的健康,给患者及其家庭、社会带来沉重的经济负担[1],但目前仍缺乏有效的治疗手段,因此进一步阐明脑缺血后病理机制以及开发有效的神经保护制剂成为目前亟需解决的问题。研究表明铁死亡参与脑缺血病理过程并加重脑组织损伤,而使用铁死亡抑制剂可改善脑缺血预后[2]。Cav-1 为位于细胞膜表面质膜凹陷,是胞膜窖(caveolae) 的标志性蛋白和功能蛋白,为体内外细胞信号转导枢纽。既往研究发现Cav-1 可调控铁死亡而发挥作用; Cav-1 抑制铁死亡减轻急性肝炎小鼠肝细胞损伤[3]; Tang 等[4]发现Cav-1 可抑制神经元铁死亡,从而改善认知功能。
补阳还五汤作为治疗脑缺血的经典名方,其疗效性和安全性已得到充分证明[5-7]。课题组前期研究发现,补阳还五汤可通过Cav-1 发挥抗脑缺血损伤作用[8-9],但是补阳还五汤是否通过Cav-1 调控铁死亡而发挥抗缺血作用,目前仍不清楚。因此,本研究拟以Cav-1 KO 和同源WT 小鼠作为研究对象,采用MCAO 法复制脑缺血模型,观察补阳还五汤对脑缺血小鼠病理形态以及铁死亡相关分子的影响,研究其可能的作用机制。
1 材料
1.1 动物 SPF 级雄性KO (Cav-1-/-) 与同源WT (Cav-1+/+) C57BL/6J 小鼠,6~8 周龄,体质量25 ~30 g。Cav-1杂合子(Cav-1+/-) 小鼠引种自江苏集萃药康生物科技股份有限公司[实验动物生产许可证号SCXK (湘) 2018-0008],饲养于湖南中医药大学第一附属医院SPF 级动物房[实验动物使用许可证号SYXK (湘) 2020-0010) ],小鼠子代经PCR 鉴定为KO 与同源WT 小鼠后纳入实验[10]。本实验经湖南中医药大学第一附属医院实验动物伦理委员会批准(伦理号ZYFY20221111-04)。
1.2 药物 黄芪饮片(批号CK21110807)、赤芍饮片(批号CK21111703)、川芎饮片(批号2108221)、桃仁饮片(批号2020050402)、当归饮片(批号TH21111711)、地龙饮片(批号2109142) 及红花饮片(批号2109223) 均购自湖南中医药大学第一附属医院,并经本院中心实验室中药药效物质基础平台龙红萍副研究员鉴定为正品。
1.3 试剂 组织铁测定试剂盒(货号A039-2-1)、还原型谷胱甘肽测定试剂盒(货号A006-1-1)、丙二醛测定试剂盒(货号A003-1-2) 及超氧化物歧化酶测定试剂盒(货号A001-3) 均购自南京建成生物工程研究所; 动物RNA 抽提取试剂盒 (货号 R002)、cDNA 合成试剂盒 (货号R7170M) 及SYBR Green qPCR Mix (货号D7260) 均购自上海碧云天生物技术有限公司; GPX4 多克隆抗体(货号14432-1AP) 购自武汉三鹰生物技术有限公司; HRP-山羊抗兔IgG (货号BA1054) 购自武汉博士德生物工程有限公司。
1.4 仪器 智能组织切片成像系统(美国Akoya Bioscienc公司,型号Vectra3); 荧光定量PCR 仪(德国Eppendorf公司,型号Realplex2); 梯度PCR 扩增仪(美国Bio-Rad公司,型号T100); 电镜(日本日立公司,型号HT7700);多功能酶标仪(美国赛默飞公司,型号Enspire); 高速冷冻离心机(德国Hermle 公司,型号Z32HK)。
2 方法
2.1 补阳还五汤制备 将黄芪、当归、赤芍、地龙、川芎、桃仁和红花按120 ∶6 ∶4.5 ∶3 ∶3 ∶3 ∶3 比例混合,加入5 倍体积量蒸馏水浸泡1 h,先武火煎0.5 h,然后文火煎1.5 h,用三层纱布过滤药液; 再次加入3 倍体积量蒸馏水,用上述方法煎煮及过滤,最后将2 次滤液混匀,使用旋转蒸发仪将药液浓缩至生药量2 g/mL。浓缩液经课题组前期UPLC-Q-TOFMS 检测出21 种成分,其中黄芪甲苷Ⅳ、芒柄花素、阿魏酸、芍药内酯苷质量浓度分别为78.1、46.7、45.6、468.4 μg/mL[11]。
2.2 MCAO 模型建立 采用改良的大脑中动脉栓塞法制备脑缺血模型[12],小鼠术前禁食12 h,腹腔注射1%戊巴比妥钠麻醉后固定小鼠,切开皮肤,钝性分离左侧颈总、颈内、颈外动脉,结扎颈总动脉及颈外动脉,于颈总动脉近心端剪一小切口,将线栓经切口处送入颈内动脉,当线栓上黑色标记点恰好位于颈总动脉分叉口时固定线栓,消毒并缝合皮肤。假手术组小鼠仅切开皮肤并分离血管,随后缝合皮肤。小鼠麻醉清醒后2 h,参照Longa 法[13]对小鼠进行神经行为学评分,评分为1~3 分者纳入研究对象。
2.3 分组和给药 将KO 和同源WT 小鼠分别随机分为假手术组、模型组和补阳还五汤组,每组18 只。补阳还五汤组于造模后1 d 灌胃给予补阳还五汤,根据课题组前期研究基础[8,14],确定其给药质量浓度为18.5 g/kg,其余各组灌胃等量蒸馏水,连续灌胃7 d。
2.4 取材 末次灌胃给药1 h 后,每组随机选取6 只小鼠进行神经功能评分。然后麻醉处死全部小鼠留取脑组织,随机选取6 只用于病理形态学及免疫组化等指标检测; 6只用于RT-qPCR 检测; 其余6 只用于相关试剂盒相关指标的检测。
2.5 神经行为学评分 采用改良神经功能缺损评分(modified neurological deficit score,mNSS) 对小鼠神经功能缺损进行评估[15],该评分内容涉及感觉、运动及反射等方面,总分为18 分,0 分代表无神经功能缺损,评分越高,说明神经损伤越严重。
2.6 HE 染色观察脑组织病理变化 取全脑于4% 多聚甲醛中浸泡、固定,常规脱水、石蜡包埋、切片、烤片,然后脱蜡至水,以苏木精-伊红(HE) 染色后自来水冲水,脱水透明后封片,使用智能组织切片成像系统进行全片扫描,随机选取皮质缺血区域内3 个不同区域拍照并保存图片。
2.7 尼氏染色观察神经元结构 将脑组织石蜡切片脱蜡至水,然后使用尼氏染液进行染色,脱水透明后封片,使用智能组织切片成像系统进行全片扫描,随机选取皮质缺血区域内3 个不同区域拍照并保存图片。
2.8 透射电镜观察脑组织线粒体结构 冰上取缺血侧皮层脑组织块约1 mm3,然后立即置于电镜固定液中避光固定,4 ℃过夜,经室温脱水、渗透包埋、聚合、超薄切片、染色,在透射电子显微镜下观察线粒体形态,并采集图像。
2.9 脑组织铁、GSH、MDA 水平及SOD 活性检测 准确称取25 mg 缺血侧皮层脑组织,加入9 倍量生理盐水,冰水浴条件下匀浆,2 500 r/min 离心10 min,取上清液待测。根据BCA 试剂盒说明书测定蛋白浓度,按照组织铁、GSH、MDA 以及SOD 试剂盒说明书进行检测,并根据试剂盒提供的公式计算脑组织铁、GSH、MDA 水平及SOD活性。
2.10 免疫组化法检测脑组织GPX4 蛋白表达 取全脑组织石蜡切片,依次脱蜡至水、热抗原修复及封闭,分别加入GPX4 一抗(1 ∶100) 4 ℃孵育过夜,滴加含HRP 的二抗,室温避光孵育1 h,PBS 冲洗后封片。使用智能组织切片成像系统进行全片扫描,随机选取缺血区域3 个不同视野拍照并保存照片,运用Image J 图像分析软件计算其蛋白表达量。
2.11 RT-qPCR 法检测脑组织GPX4 mRNA 表达 称取20 mg 缺血侧脑组织置于1.5 mL 离心管中,迅速加入预冷裂解液300 μL,匀浆,通过离心柱法抽提RNA,然后将RNA逆转录为cDNA,在荧光定量系统中采用两步法进行PCR扩增,PCR 扩增程序为95 ℃预变性2 min; 95 ℃变性15 s,60 ℃退火/延伸30 s,共40 个循环。熔解曲线反应条件为95 ℃15 s,60 ℃15 s,95 ℃15 s。引物由生工生物工程(上海) 股份有限公司设计并合成,序列见表1。以β-actin作为内参基因,采用2-ΔΔCT法计算GPX4 mRNA 相对表达。

表1 引物序列
2.12 统计学分析 通过GraphPad Prism 9 软件进行处理,符合正态分布的计量资料以(±s) 表示,多组间比较采用方差分析,随后采用Turkey 进行事后检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 补阳还五汤对Cav-1-/-脑缺血小鼠神经行为学评分的影响 与同基因型假手术组比较,WT 和KO 模型组小鼠神经行为学评分升高 (P<0.01); 与同基因型模型组比较,WT 和KO 补阳还五汤组小鼠神经行为学评分降低(P<0.01); KO 模型组神经行为学评分高于WT 模型组(P<0.05),KO 补阳还五汤组神经行为学评分高于WT 补阳还五汤组(P<0.01),见表2。
表2 补阳还五汤对Cav-1-/-脑缺血小鼠神经行为学评分的影响(±s,n=6)

表2 补阳还五汤对Cav-1-/-脑缺血小鼠神经行为学评分的影响(±s,n=6)
注: 与同基因型假手术组比较,∗∗P<0.01; 与同基因型模型组比较,△△P<0.01; 与WT 模型组比较,◇P<0.05; 与WT 补阳还五汤组比较,##P<0.01。
组别神经行为学评分/分WTKO假手术组00模型组6.17±0.69∗∗7.5±0.55∗∗◇补阳还五汤组0.67±0.52△△3.83±1.17△△##
3.2 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织病理形态的影响 HE 染色结果显示,与同基因型假手术组比较,WT、KO 模型组小鼠缺血侧皮质神经元排列不规整,细胞间隙增宽、水肿,存在空泡,细胞核出现固缩,甚至核碎裂; 与同基因型模型组比较,WT、KO 补阳还五汤组小鼠缺血侧皮质神经元排列相对规整,细胞间隙减小,核仁较清晰;与WT 模型组比较,KO 模型组小鼠缺血侧皮质神经元出现大量核固缩及空泡; 与WT 补阳还五汤组比较,KO 补阳还五汤组小鼠缺血侧皮质神经元排列相对欠规整,存在更多空泡,见图1。尼氏染色结果显示,假手术组小鼠皮层神经元结构完整,边界清晰,可见大量呈深蓝色颗粒或斑块状尼氏体,核呈蓝色; WT、KO 模型组小鼠神经元结构紊乱,可见细胞肿胀,甚至呈空泡样改变,细胞核固缩,甚至核碎裂等,尼氏体数量减少(P<0.01); 与WT 模型组比较,KO 模型组表现出更严重的神经元损伤,尼氏体数量更少(P<0.05); 与WT 补阳还五汤组比较,KO 补阳还五汤组尼神经元损伤严重,尼氏体数量减少(P<0.01),见图2。
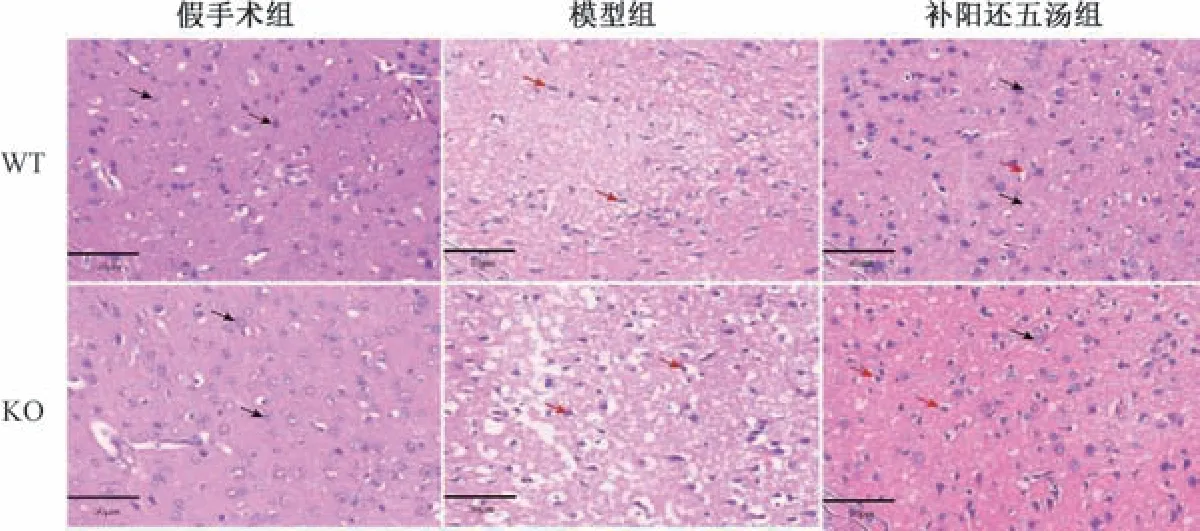
图1 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织病理形态的影响(HE,×400)
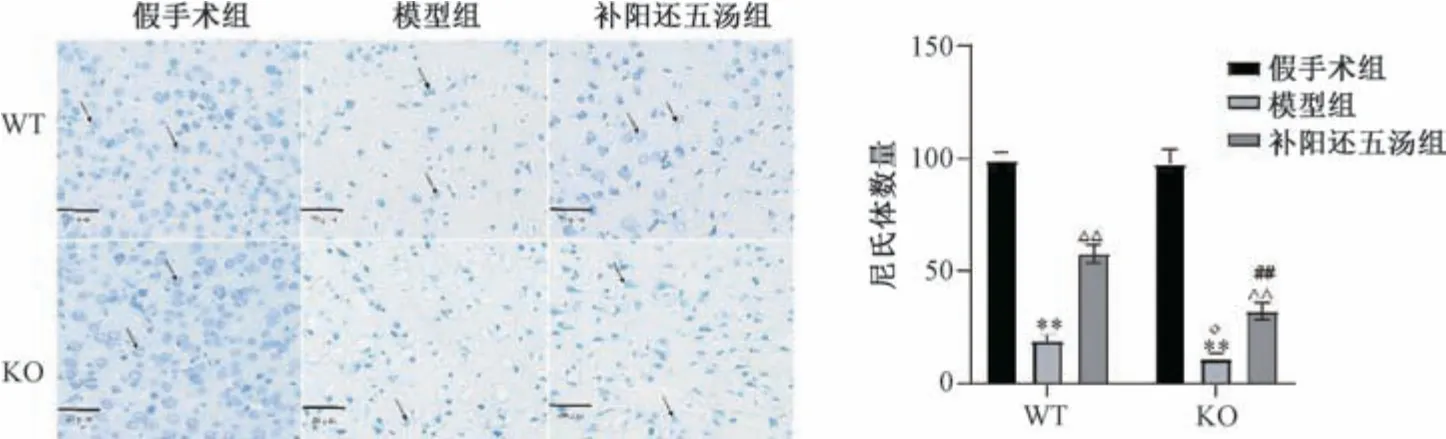
图2 补阳还五汤对Cav-1-/-脑缺血小鼠神经元细胞形态的影响(尼氏染色,×400,±s,n=6)
3.3 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织线粒体形态的影响 与假手术组比较较,模型组脑缺血区域线粒体变小、水肿严重,线粒体膜密度增加,嵴减少甚至消失,线粒体外膜破裂等,其中KO 模型组线粒体损伤更严重; 给予补阳还五汤干预后,线粒体形态改善,但KO 补阳还五汤组线粒体形态改善不如WT 补阳还五汤组,仍可见部分线粒体水肿、线粒体嵴减少、线粒体膜密度增加等,见图3。
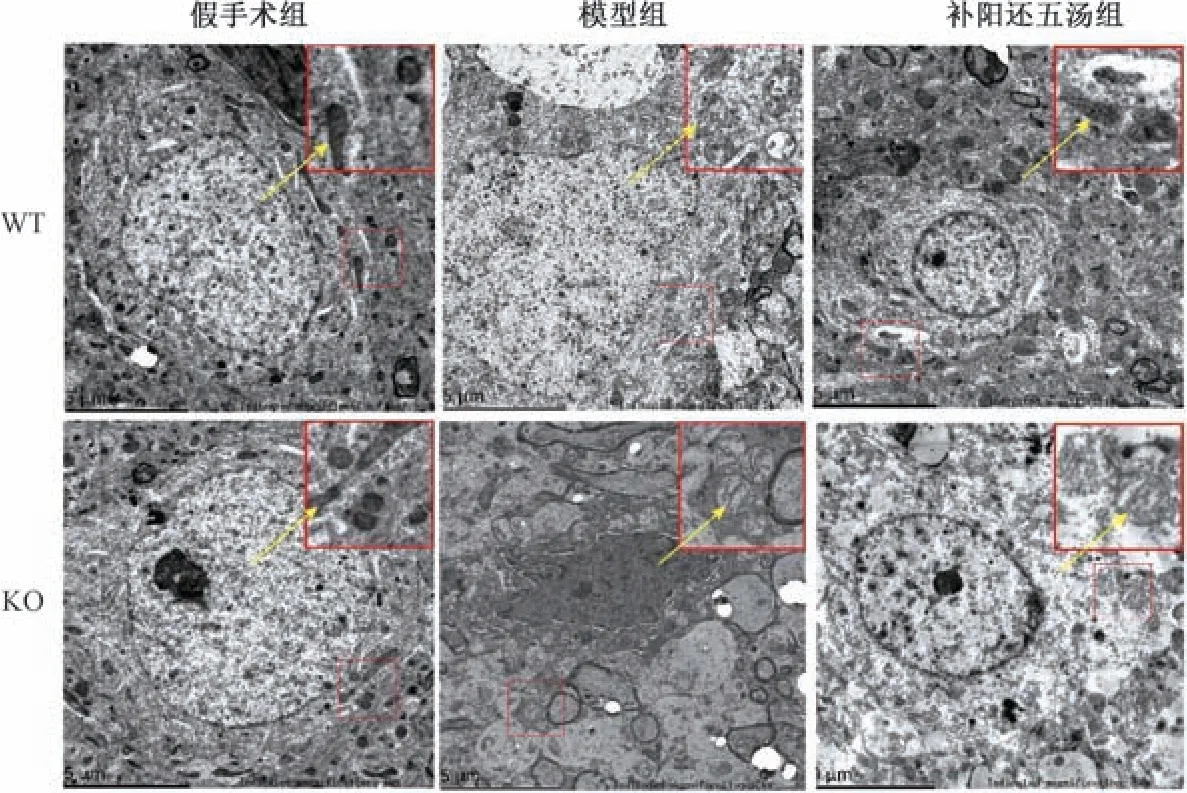
图3 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织线粒体形态学的影响(n=3)
3.4 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织铁水平及脂质过氧化的影响 与同基因型假手术组比较,WT、KO 模型组小鼠脑组织GSH 水平和SOD 活性降低(P<0.01),MDA 和铁水平升高(P<0.01); 与同基因模型组比较,WT、KO 补阳还五汤组小鼠脑内脑组织GSH 水平和SOD 活性升高(P<0.05,P<0.01),MDA 和铁水平降低 (P<0.05,P<0.01); 与WT 模型组比较,KO 模型组小鼠脑组织GSH 水平和SOD 活性降低(P<0.05),MDA 和铁水平升高(P<0.05); 与WT 补阳还五汤组比较,KO 补阳还五汤组小鼠脑组织GSH 水平和SOD 活性降低(P<0.01),MDA和铁水平升高(P<0.01),见图4。

图4 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织铁、GSH、MDA 水平及SOD 活性的影响(±s,n=6)
3.5 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织GPX4 蛋白和mRNA 表达的影响 与同基因型假手术组比较,WT、KO 模型组小鼠脑组织GPX4 蛋白及mRNA 表达降低(P<0.01); 与同基因型模型组比较,WT、KO 补阳还五汤组小鼠脑组织GPX4 蛋白及mRNA 表达升高 (P<0.05,P<0.01); 与WT 模型组比较,KO 模型组小鼠脑组织GPX4蛋白及mRNA 表达降低(P<0.05); 与WT 补阳还五汤组比较,KO 补阳还五汤组脑组织GPX4 蛋白及mRNA 表达降低(P<0.01),见图5。
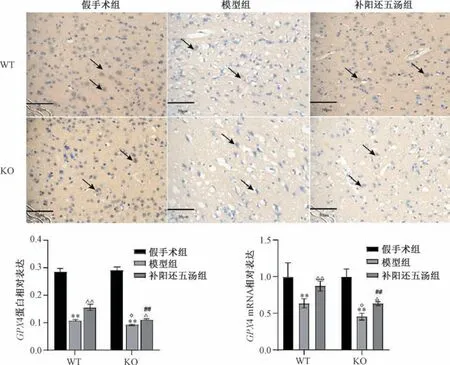
图5 补阳还五汤对Cav-1-/-脑缺血小鼠脑组织GPX4 蛋白及mRNA 表达的影响(±s,n=6)
4 讨论
脑缺血属于中医“缺血性中风” 范畴,病因病机多为风、火、痰、瘀等留滞经络,气血运动不畅,其中气虚血瘀为其重要的病理因素[16]。补阳还五汤出自《医林改错》,为治疗缺血性中风气虚血瘀证的经典方剂。该方由黄芪、当归尾、地龙、川芎、赤芍、桃仁和红花等组成,方中重用黄芪为君药,大补元气,使气旺血行; 臣以当归尾活血化瘀而不伤血,佐以川芎、赤芍、桃仁、红花等药物行气活血,地龙通络,全方共凑益气活血通络之功效,具有气旺血行、活血而不伤正等特点。本研究表明,补阳还五汤能降低神经功能缺损评分,改善缺血区域病理形态而发挥抗脑缺血损伤作用,说明补阳还五汤具有抗脑缺血损伤作用。
脑缺血后病理机制复杂,如氧化应激、钙超载、兴奋性氨基酸毒性、炎症等,伴随凋亡、自噬、焦亡等多种细胞死亡形式[17-18]。铁死亡是一种非经典细胞死亡方式,以铁依赖的脂质过氧化为特征,在脑缺血病理过程中发挥重要作用。GPX4 为铁死亡的标志性蛋白,它以GSH 为底物,将有毒的脂质过氧化物转化为无毒的脂质醇,从而维持体内氧化还原体系平衡[19]。既往研究表明,脑缺血后铁水平增加,GSH 及GPX4 水平降低,增加脑内GPX4 表达量能改善脑缺血预后[20]。本研究发现,模型组小鼠缺血侧脑组织内线粒体变小,水肿严重,嵴减弱甚至消失,呈典型的铁死亡线粒体形态学变化。脑组织铁、MDA 水平增加,而GSH、SOD 和GPX4 水平减少,以上结果表明铁死亡参与脑缺血病理过程。补阳还五汤干预后能改善线粒体形态,降低脑组织铁和MDA 水平,增加GSH、SOD 和GPX4 水平,提示补阳还五汤可能通过抑制神经元铁死亡而发挥抗脑缺血损伤作用。
Cav-1 为caveolae 的重要结构蛋白和功能蛋白,通过其脚手架结构域激活下游信号分子,广泛参与细胞增殖、迁移以及胞吞、脂质代谢、细胞信号转导等生理过程[21]。Cav-1 在脑内神经元中表达丰富,不仅参与大脑发育,而且在脑缺血病理过程中发挥重要作用[22]。有研究发现,过表达Cav-1 可减轻缺氧条件下海马神经元凋亡[23],而敲除Cav-1 会增加脑缺血小鼠的梗死面积及血脑屏障的通透性,从而加重脑缺血[24]。本研究发现,与WT 模型组小鼠比较,Cav-1 KO 模型小鼠表现出更严重的神经功能缺损症状及缺血区域神经元损伤,这与既往研究一致。同时,敲除Cav-1可在一定程度上削弱补阳还五汤的抗脑缺血损伤作用,说明补阳还五汤可能通过Cav-1 发挥抗脑缺血损伤作用。在本研究中,与WT 模型组小鼠比较,Cav-1 KO 小鼠脑缺血后表现出更严重的线粒体损伤,脑内铁和MDA 水平增加,而GSH、SOD 及GPX4 水平减少,并且Cav-1 KO 能在一定程度上逆转补阳还五汤抑制铁死亡的效果。以上结果表明,Cav-1 缺失能促进脑内铁死亡,补阳还五汤可能通过Cav-1抑制铁死亡而发挥抗缺血性脑损伤作用。
综上所述,本研究发现Cav-1 敲除进一步加重脑缺血后铁死亡,而补阳还五汤可能通过Cav-1 抑制铁死亡而发挥保护脑缺血的作用,但补阳还五汤通过Cav-1 调控铁死亡的下游靶点不明确,这将是课题组下一步研究的重点。
