黑逍遥散调控p38MAPK/ATF2/COX-2 信号通路对阿尔茨海默病大鼠神经炎症的影响
2024-03-12米彩云李明成王虎平
米彩云,彭 超,周 君,李明成,王虎平
(甘肃中医药大学,甘肃省方药挖掘与创新转化重点实验室,甘肃 兰州 730000)
阿尔茨海默病(Alzheimer’s disease,AD) 是一种患者认知和记忆能力恶化并伴随着神经精神症状和行为障碍的慢性退行性疾病。据估计,全球约有4 600 万AD 病例,每年的相关支出费用约为8 000 亿美元,是仅次于心脏病、恶性肿瘤和中风的第四大死亡原因[1],已成为一个棘手的社会和医学问题,但目前尚无有效的方法治疗或减缓AD的进程[2]。研究表明,神经炎症是AD 重要的发病机制之一,AD 患者大脑通常具有炎症迹象,在炎性环境下,神经元进行性丧失,并最终导致认知和运动障碍[3]。AD 可归于中医“呆症” “健忘” “痴呆” 等范畴,与肝、脾、肾三脏密切相关,因此,本研究选用肝脾肾“三脏并调”的经典方黑逍遥散进行研究,探讨该方通过调控p38MAPK/ATF2/COX-2 信号通路防治AD 的作用及其免疫炎症机制,以期为临床应用黑逍遥散防治AD 提供实验支撑。
1 材料
1.1 动物 SPF 级4 月龄雄性Wistar 大鼠90 只,体质量(250±50) g,由甘肃中医药大学动物实验中心提供(动物质量合格证号62001000000570)。所有大鼠置于受控环境下饲养,温度(23±2)℃,相对湿度(45±5)%,12 h 光照/12 h 黑暗周期,自由饮食饮水。所有动物均按实验动物中心的指导原则处理,所有项目均经过甘肃中医药大学伦理委员会的评估和批准(伦理号2020-004)。
1.2 药物与试剂 黑逍遥散组方购自甘肃中医药大学第二附属医院中药房,经鉴定符合2020 年版《中国药典》 要求。Aβ1-42蛋白 (上海源叶生物科技有限公司,批号107761-42-2); 盐酸多奈哌齐[卫材(中国) 药业有限公司,国药准字H20070181]; HE 染色试剂盒(北京索莱宝科技有限公司,批号G1120); Aβ1-42、iNOS、PGE2酶联免疫试剂盒(上海茁彩生物科技有限公司,批号YY56922、YY98455、YY69712 ); p38、p-p38、COX-2、ATF2、p-ATF2 抗体 ( 美国 ImmunoWay 公司,批号 YT3513、YP0336、YT1037、YT0385、YP0023)。
1.3 仪器 MT-200 型Morris 水迷宫实验系统(成都泰盟科技有限公司); Multiskan Mk3 型酶标仪、Real-time PCR仪(美国罗氏公司); JY-SCZ2+型垂直电泳槽、JY-ZY5 型转膜仪、JY300C 型电泳仪(北京君意东方电泳设备有限公司); 5200 型化学发光凝胶成像仪(上海天能科技)。
2 方法
2.1 药物制备 黑逍遥散按熟地15 g、柴胡10 g、当归10 g、白芍10 g、白术10 g、茯苓10 g、生姜10 g、炙甘草8 g、薄荷2 g 比例称取饮片,凉水浸泡40 min,大火煮沸,小火煎熬1 h,后下薄荷煎煮5 min,滤出药汁后,加水二次煎煮30 min,混合2 次滤出药汁,浓缩得到生药量1.0 g/mL 的黑逍遥散汤剂。盐酸多奈哌齐研成粉末,溶解于纯水中,配制成0.005 mg/mL 的溶液。
2.2 模型复制 大鼠腹腔注射3%戊巴比妥钠溶液进行麻醉,剃去大鼠头部毛发备皮后固定头部,沿脑顶部正中切开1 cm 左右切口,使颅骨完全暴露,确定海马CA1 区位置并标记,用牙科钻在标记处钻孔直至出现落空感,再用微量进样器在2 孔各缓慢注射1 μL Aβ1-42溶液至硬脑膜下深3 mm,留针3 min 后再缓慢出针。假手术组大鼠注射等剂量生理盐水,不注射Aβ1-42溶液,术后在创面涂抹青霉素干粉剂以预防感染,缝合皮肤后再次碘伏消毒。
2.3 分组与给药 随机选取10 只大鼠作为空白组,10 只作为假手术组,选取造模成功的大鼠50 只,随机分为模型组、盐酸多奈哌齐组和黑逍遥散低、中、高剂量组。根据第四版《药理实验方法学》 中人和大鼠体表面积折算方法,黑逍遥散低、中、高剂量为4.25、8.5、17 g/kg,盐酸多奈哌齐剂量为0.5 mg/kg,空白组与假手术组给予生理盐水,灌胃给药,每天1 次,连续42 d。
2.4 Morris 水迷宫行为学检测 给药结束后进行水迷宫实验,向水箱注水至淹没圆形平台2 cm 处,加入二氧化钛使水变为乳白色避免大鼠看清水下平台,将大鼠面朝池壁随机放入任一象限,分别记录大鼠找到平台的时间,如果时间超过120 s,则引导大鼠至平台上停留15 s,每次游泳结束后,将大鼠用毛巾擦干以防感冒。每只大鼠每天测试2次,连续测试5 d,第6 天撤除平台,开始120 s 的探索训练。记录2 次结果,作为行为学的检测指标。
2.5 标本采集与保存 于末次行为学测试后,大鼠腹腔注射3%戊巴比妥钠进行麻醉,待麻醉后处死,每组取3 只大鼠全脑,置于固定液中,常温放置; 其余大鼠脑组织在冰浴条件下,剥离海马体,置于-80 ℃冰箱保存。
2.6 HE 染色观察海马CA1 区病理形态学变化 脑组织于4%多聚甲醛溶液中固定8 h,浸于70%乙醇溶液中,然后分别置于80%、90%、95%和无水乙醇中梯度脱水4 h,将组织浸泡在二甲苯中30 min,然后用石蜡包埋,切片,脱蜡水化后将切片浸泡于苏木素溶液中染色10 min,纯水冲洗干净,然后使用1%盐酸乙醇冲洗切片5 s,纯水冲洗干净后用伊红复染2 min,纯净水再次冲洗,经脱水、透明、封片后置于显微镜下观察。400 倍镜下观察海马组织结构及细胞形态,同时采集照片。
2.7 ELISA 法检测海马组织Aβ1-42、iNOS、PGE2水平 取海马组织,匀浆后离心,收集上清液,于孔板上加入各梯度标准品和待测样品,按各试剂盒说明书操作进行反应,反应终止后在450 nm 波长处检测各孔光密度(OD) 值,根据OD 值绘制标准曲线,计算各组大鼠海马组织Aβ1-42、iNOS、PGE2水平。
2.8 RT-qPCR 法检测海马组织p38、ATF2、COX-2 mRNA表达 称取各组海马组织100 mg,加入RNA 抽提试剂提取RNA,用微量分光光度计检测RNA 纯度,重复3 次取平均值。将所提取的RNA 按照说明书操作反转录合成cDNA,建立20 μL 反应体系(各0.4 μL 正反向引物、1 μL 待测DNA、10 μL HieffTM qPCR SYBR& Green Master Mix、无酶水定容至20 μL) 进行qPCR 反应。按照试剂盒说明书设置两步法扩增程序,40 个循环后采集荧光信号,每个基因重复3 次实验。引物由生工生物工程(上海) 股份有限公司合成,序列见表1。
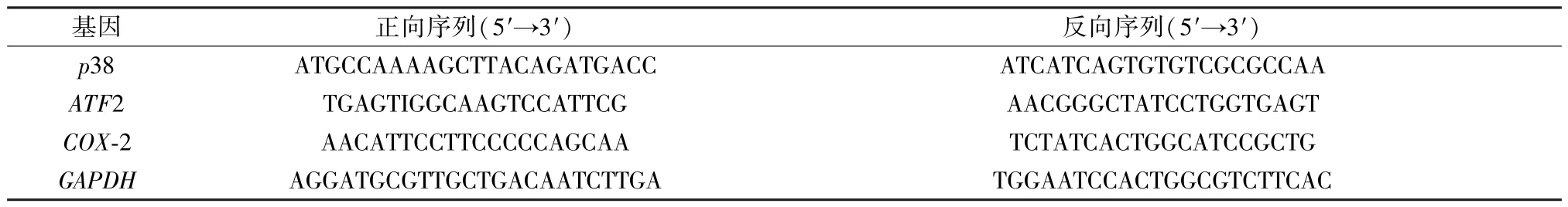
表1 引物序列
2.9 Western blot 法检测海马组织p38、p-p38、ATF2、p-ATF2、COX-2 蛋白表达 取海马组织80 mg,加入细胞裂解液和蛋白酶抑制剂,匀浆后离心,吸取上清液进行BCA蛋白浓度测定,蛋白定量后进行变性。取蛋白样品加样电泳,然后转移至PVDF 膜,室温封闭2 h,加一抗置于摇床上孵育1 h 后,于4 ℃过夜,次日用PBST 洗膜,加入稀释好的二抗孵育2 h,PBST 洗膜,用滤纸吸干PVDF 膜的液体,将膜放在曝光机显影板上曝光,分析条带灰度值。
2.10 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以(±s) 表示,多组比较采用单因素方差分析,组间两两比较方差齐采用LSD 法; 方差不齐采用Games-Howell 法。P<0.05 为差异具有统计学意义。
3 结果
3.1 大鼠一般情况 空白组大鼠常规喂养,发育良好,皮毛有光泽,反应迅速,饮食、二便未见改变; 造模48 h 后,假手术组及造模组大鼠精神不振,蜷缩俯卧,饮食减少,大便色浅呈稀糊状,假手术组死亡1 只,模型组死亡2 只,均出现脑部水肿; 给药1 周后黑逍遥散中剂量组死亡1 只,高剂量组死亡2 只,腹部膨大,判断为肠梗阻死亡。随着药物干预时间的推移,各给药组大鼠一般状况有所好转,大鼠皮毛逐渐恢复光泽,精神状态逐渐变好,活跃度有所提升,饮食尚可,二便较正常; 模型组和假手术组术后常规饲养,未进行任何治疗,一般状态稍有好转,但仍精神不振、皮毛蓬松没有光泽、反应迟钝、饮食饮水较少,体质量增长缓慢。
3.2 黑逍遥散对AD 大鼠学习记忆能力的影响 与空白组比较,假手术组大鼠第2 天逃避潜伏期延长(P<0.05),第3、4 天无明显变化(P>0.05),模型组大鼠第2~4 天逃避潜伏期延长(P<0.01); 与假手术组比较,模型组大鼠第2~4 天逃避潜伏期延长(P<0.01); 与模型组比较,黑逍遥散高、中剂量组和盐酸多奈哌齐组逃避潜伏期缩短(P<0.01),低剂量组无明显变化(P>0.05),见表2。与空白组比较,假手术组大鼠有效区域运动距离、目标象限停留时间百分比无明显变化(P>0.05),模型组有效区域运动距离减少(P<0.01),在目标象限停留时间百分比降低(P<0.01); 与模型组比较,黑逍遥散各剂量组及多奈哌齐组有效区域运动距离增加(P<0.01),黑逍遥散高、中剂量组及多奈哌齐组大鼠目标象限停留时间百分比提高(P<0.05,P<0.01),低剂量组无明显变化(P>0.05),表3。
表2 黑逍遥散对AD 大鼠第2~4 天逃避潜伏期的影响(±s)

表2 黑逍遥散对AD 大鼠第2~4 天逃避潜伏期的影响(±s)
注: 与空白组比较,∗P<0.05,∗∗P<0.01; 与假手术组比较,△△P<0.01; 与模型组比较,##P<0.01。
组别动物数/只逃避潜伏期/s第2 天第3 天第4 天空白组1061.50±13.2233.10±7.9122.20±4.13假手术组972.11±12.61∗41.33±8.9025.89±9.35模型组8104.75±8.10∗∗△△81.75±11.51∗∗△△67.75±7.69∗∗△△黑逍遥散低剂量组1097.20±8.1372.00±10.1563.10±11.16黑逍遥散中剂量组896.13±6.96##60.25±5.97##34.25±11.12##黑逍遥散高剂量组986.67±11.51##59.44±9.29##40.44±13.86##盐酸多奈哌齐组1084.70±10.19##51.40±11.37##29.50±6.57##
表3 黑逍遥散对AD 大鼠有效区域运动距离和目标象限停留时间百分比的影响(±s)

表3 黑逍遥散对AD 大鼠有效区域运动距离和目标象限停留时间百分比的影响(±s)
注: 与空白组比较,∗∗P<0.01; 与假手术组比较,△△P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别动物数/只有效区域运动距离/cm目标象限停留时间百分比/%空白组10619.33±137.0628.38±6.90假手术组9551.23±104.4826.80±3.68模型组846.75±11.76∗∗△△11.39±3.12∗∗△△黑逍遥散低剂量组10278.47±64.75##16.19±4.42黑逍遥散中剂量组8341.53±81.89##20.38±5.95#黑逍遥散高剂量组9388.95±175.68##23.04±5.23##盐酸多奈哌齐组10483.37±113.56##23.53±6.80##
3.3 黑逍遥散对AD 大鼠海马CA1 区病理改变的影响 空白组大鼠海马CA1 区神经元数量丰富,排列有序,结构正常,细胞核清晰,核仁明显,细胞质丰富; 与空白组比较,假手术组大鼠海马CA1 区神经元形态、结构、数量未见明显改变; 模型组大鼠海马CA1 区神经元明显丢失,可见大量肿胀的神经元,结构疏松,细胞核固缩,形成一些液泡结构; 与模型组比较,各给药组大鼠海马神经元形态均有所改善,以黑逍遥散高剂量组和盐酸多奈哌齐组作用最为显著,可以清晰地观察到神经元排列有序,细胞体饱满,未见大量凋亡细胞,见图1。

图1 黑逍遥散对AD 大鼠海马CA1 区病理改变的影响(HE,×400)
3.4 黑逍遥散对AD 大鼠海马组织Aβ1-42、iNOS、PGE2水平的影响 与空白组比较,假手术组大鼠海马组织Aβ1-42、iNOS、PGE2水平无明显变化(P>0.05),模型组大鼠海马组织Aβ1-42、iNOS、PGE2水平升高(P<0.01); 与假手术组比较,模型组大鼠海马组织iNOS、PGE2水平升高(P<0.01); 与模型组比较,黑逍遥散中、高剂量组和盐酸多奈哌齐组大鼠海马组织Aβ1-42、iNOS、PGE2水平降低(P<0.05,P<0.01),见表4。
表4 黑逍遥散对AD 大鼠海马组织Aβ1-42、iNOS、PGE2 水平的影响(pg/mL,±s,n=6)
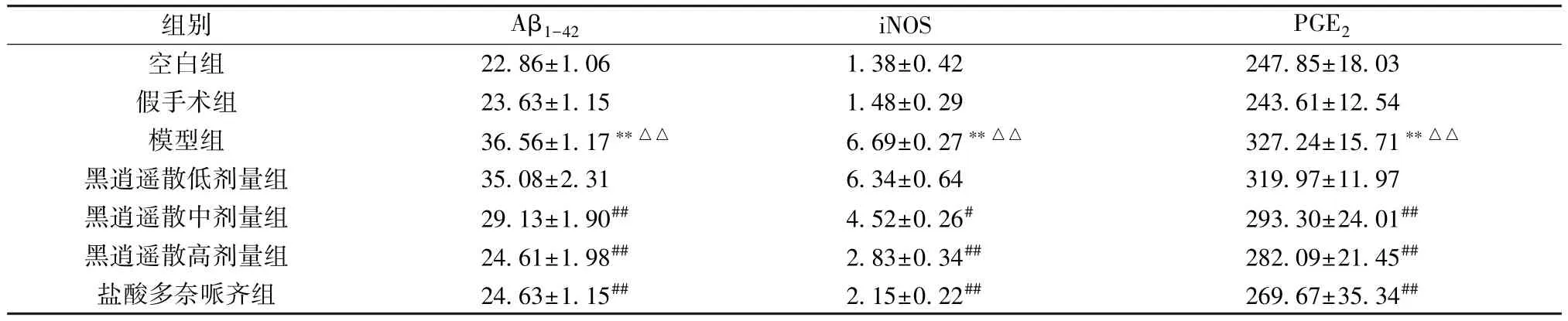
表4 黑逍遥散对AD 大鼠海马组织Aβ1-42、iNOS、PGE2 水平的影响(pg/mL,±s,n=6)
注: 与空白组比较,∗∗P<0.01; 与假手术组比较,△△P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别Aβ1-42iNOSPGE2空白组22.86±1.061.38±0.42247.85±18.03假手术组23.63±1.151.48±0.29243.61±12.54模型组36.56±1.17∗∗△△6.69±0.27∗∗△△327.24±15.71∗∗△△黑逍遥散低剂量组35.08±2.316.34±0.64319.97±11.97黑逍遥散中剂量组29.13±1.90##4.52±0.26#293.30±24.01##黑逍遥散高剂量组24.61±1.98##2.83±0.34##282.09±21.45##盐酸多奈哌齐组24.63±1.15##2.15±0.22##269.67±35.34##
3.5 黑逍遥散对AD 大鼠海马组织p38、ATF2、COX-2 mRNA 表达的影响 与空白组比较,假手术组大鼠海马组织p38 mRNA 表达升高(P<0.05),ATF2、COX-2 mRNA 表达无明显变化(P>0.05),模型组大鼠海马组织p38、COX-2 mRNA 表达均升高(P<0.01),ATF2 mRNA 表达无明显变化(P>0.05); 与假手术组比较,模型组大鼠海马组织p38 mRNA 表达升高(P<0.01),ATF2、COX-2 mRNA 表达无明显变化 (P>0.05); 与模型组比较,各给药组p38 mRNA 表达均降低(P<0.01),ATF2 mRNA 无明显变化(P>0.05),黑逍遥散中、高剂量组及盐酸多奈哌齐组COX-2 mRNA 表达降低(P<0.05,P<0.01),低剂量组COX-2 mRNA 表达无明显变化(P>0.05),见表5。
表5 黑逍遥散对AD 大鼠海马组织p38、ATF2、COX-2 mRNA 表达的影响(±s,n=6)

表5 黑逍遥散对AD 大鼠海马组织p38、ATF2、COX-2 mRNA 表达的影响(±s,n=6)
注: 与空白组比较,∗P <0.05,∗∗P <0.01; 与假手术组比较,△△P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别p38ATF2COX-2空白组0.28±0.071.02±0.180.29±0.05假手术组0.41±0.10∗1.19±0.060.39±0.15模型组1.00±0.00∗∗△△1.00±0.001.00±0.00∗∗黑逍遥散低剂量组0.46±0.02##1.07±0.100.64±0.10黑逍遥散中剂量组0.45±0.07##0.92±0.050.50±0.07#黑逍遥散高剂量组0.40±0.12##0.92±0.060.52±0.01##盐酸多奈哌齐组0.48±0.05##1.08±0.120.45±0.06#
3.6 黑逍遥散对AD 大鼠海马组织p38、p-p38、ATF2、p-ATF2、COX-2 蛋白表达的影响 与空白组比较,假手术组p38、ATF2、p-p38、p-ATF2 蛋白表达无明显变化 (P>0.05),假手术组大鼠海马COX-2 蛋白表达升高 (P<0.05),模型组大鼠海马组织p38、p-p38、p-ATF2 蛋白表达升高(P<0.01),ATF2 蛋白表达无明显变化(P>0.05);与假手术组比较,模型组大鼠海马组织p38、p-p38、p-ATF2、COX-2 蛋白表达升高(P<0.05,P<0.01),ATF2 蛋白表达无明显变化(P>0.05); 与模型组比较,黑逍遥散低剂量组p-ATF2 蛋白表达降低(P<0.01),中剂量组p38、p-p38、p-ATF2 蛋白表达降低(P<0.01),高剂量组及盐酸多奈哌齐组p38、p-p38 蛋白表达降低(P<0.01),黑逍遥散高剂量组及盐酸多奈哌齐组p38、p-p38、p-ATF2、COX-2 蛋白表达均降低(P<0.01),见表6、图2。

图2 各组大鼠海马组织p38、p-p38、ATF2、p-ATF2、COX-2 蛋白条带图
表6 黑逍遥散对AD 大鼠海马组织p-p38、p-ATF2、COX-2 蛋白表达的影响(±s,n=3)

表6 黑逍遥散对AD 大鼠海马组织p-p38、p-ATF2、COX-2 蛋白表达的影响(±s,n=3)
注: 与空白组比较,∗P<0.05,∗∗P<0.01; 与假手术组比较,△P<0.05,△△P<0.01; 与模型组比较,##P<0.01。
组别p38p-p38ATF2p-ATF2COX-2空白组1.01±0.030.38±0.011.03±0.070.40±0.040.65±0.03假手术组0.98±0.020.47±0.031.15±0.070.48±0.010.98±0.05∗模型组1.34±0.08∗∗△△1.04±0.05∗∗△△1.09±0.060.98±0.08∗∗△△1.31±0.05∗∗△黑逍遥散低剂量组1.14±0.031.01±0.010.94±0.020.66±0.11##1.19±0.10黑逍遥散中剂量组0.92±0.08##0.78±0.04##0.98±0.010.64±0.12##1.25±0.05黑逍遥散高剂量组0.70±0.03##0.66±0.01##1.04±0.070.65±0.08##1.02±0.06##盐酸多奈哌齐组0.68±0.04##0.75±0.25##1.06±0.050.70±0.05##0.80±0.03##
4 讨论
p38 丝裂原蛋白活化激酶(p38 mitogen-activated protein kinase,p38MAPK) 级联信号通路作为介导炎症的经典途径,已被证实与神经退行性变有关[4-7]。炎症反应是β-淀粉样蛋白(β-amyloid protein,Aβ) 沉积所引起的继发性反应,Aβ 能激活小胶质细胞并通过p38MAPK 途径释放大量炎症因子,从而诱导神经元凋亡,导致记忆力及认知功能障碍[8]。活化转录因子2 (activation transcription factor 2,ATF2) 作为p38MAPK 信号通路下游的重要底物,在炎症中具有潜在的作用[9]。研究发现,当其上游信号分子p38MAPK 被激活后,ATF2 的Try307 位点会迅速发生磷酸化改变,从而上调或下调靶基因的转录过程,干扰正常的基因表达,介导诸如细胞凋亡等病理过程[10-11]。有研究表明,在ATF2 基因敲除大鼠中,经脂多糖刺激后肿瘤坏死因子-α、白细胞介素1β 和白细胞介素6的表达受到显著抑制,且ATF2 在浸润性巨噬细胞中高表达,并抑制抗炎分子ATF3 在白色脂肪组织的M1 巨噬细胞中的转录[12]。一氧化氮(nitric oxide,NO) 可由NOS 的3种亚型产生,其中诱导型NOS (iNOS) 能够通过脂多糖和各种细胞因子的刺激,产生大量NO,从而加速AD 的进程[13-14]。另一种炎症介质 PGE2可通过环氧合酶2(cyclooxygenase,COX-2) 依赖性途径合成参与神经退行性病变等疾病的病理过程[15]。研究表明,在炎症模型中,当机体受到外界刺激后,COX-2 应激性升高,促进其催化产物PGE2的表达量增加[16],PGE2进一步作用于局部炎性细胞,加重炎症损伤[17]。
黑逍遥散出自清·徐大椿《医略六书·女科指要》卷二十六方,由《局方》 之逍遥散加熟地而成,具有补肾填精、养血疏肝、健脾和中功效。课题组前期研究已经证实,黑逍遥散对提高大鼠学习记忆功能具有确切疗效,并对AD表现出较为显著的防治作用[18-21],但其对于学习记忆的改善是否与调控p38MAPK 途径减轻AD 脑内及血清中炎症因子的表达有关,有待进一步证实。本研究发现,黑逍遥散可以缩短大鼠逃避潜伏期,增加平台象限停留时间,提示其在改善Aβ1-42诱导的AD 大鼠空间学习记忆缺陷方面的有效作用; 黑逍遥散能降低AD 大鼠海马组织Aβ1-42、iNOS、PGE2水平; 黑逍遥散能降低p38、COX-2 mRNA 表达和p38、p-p38、p-ATF2、COX-2 蛋白表达,提示其能够通过降低p38 总量以及其磷酸化水平来阻断p38MAPK 信号通路。而本实验发现,p38 的下游底物ATF2 在各组中总量变化无明显差异,但p-ATF2 在模型组中呈高表达,给药干预后其表达降低,说明p-p38 能够激活ATF2 使其磷酸化,活化后的ATF2 又可诱导 COX-2 的上调。因此,阻断p38MAPK/ATF2/COX-2 介导的炎症通路可能是治疗AD 的重要靶点。
综上所述,黑逍遥散对AD 具有明确的防治作用,其作用机制可能是通过调控p38MAPK/ATF2/COX-2 信号通路从而抑制炎症因子的释放,进而改善Aβ1-42诱导的神经元改变和学习记忆障碍。
