六味地黄丸介导RAGE 抑制MMP-2/MMP-9 对Aβ1-40 损伤bEnd.3 细胞紧密连接蛋白的影响
2024-03-12贾亚泉高爱社张振强宋军营
丁 蕊,袁 永,贾亚泉,高爱社,张振强,宋军营∗
(1.河南中医药大学中医药科学院,河南 郑州 450046; 2.河南中医药大学医学院,河南 郑州 450046;3.河南省神经退行性疾病防治工程研究中心,河南 郑州 450046)
阿尔茨海默病(Alzheimer’s disease,AD) 是一种进行性发展的神经退行性疾病,其病理发生除β 淀粉样蛋白(β-Amyloid protein,Aβ) 沉积形成的老年斑外,还与血脑屏障功能障碍相关[1-2]。血脑屏障是防止外周循环有害物质进入脑内的重要组织结构[3],由脑微血管内皮细胞、周细胞、星形胶质细胞、基底膜、神经元、小胶质细胞组成。其核心是脑微血管内皮细胞间的紧密连接,表达于血管内皮细胞表面的闭锁小带蛋白1 (Zonula occluden-1,ZO-1) 是主要结构[4-5]。基底膜的细胞外基质蛋白能够被基质金属蛋白酶家族(matrix metalloproteinases,MMPs) 降解[6],尤其是MMP-2和MMP-9 可以消化内皮基底层和紧密连接支架蛋白,破坏血脑屏障完整性[7]。
此外,外周组织和器官产生的Aβ 不能及时转运清除,经血脑屏障进入脑内大量堆积,推动AD发展[8]。Aβ 跨血脑屏障的转运与低密度脂蛋白相关蛋白1 (low-density lipoprotein receptor related protein1,LRP1) 和晚期糖基化终末产物受体(the receptor of advanced glycation endproducts,RAGE)有关。课题组前期研究表明,六味地黄丸可能是通过RAGE/LRP1 改善AD 小鼠脑微血管损伤[9],本研究采用Aβ1-40损伤小鼠脑微血管内皮细胞株bEnd.3[10]作为AD 细胞模型,以RAGE 为靶点,探讨六味地黄丸含药血清对神经血管单元和血脑屏障的影响及其防治AD 是否与调控RAGE 表达相关,为中医理论“肾精亏虚” 即“肾精不足不能充养脑髓,致神机失用,最后发展为痴呆[11]” 提供实验依据。
1 材料
1.1 动物与细胞 SPF 级雄性昆明小鼠,12 周龄,体质量30~35 g,购自济南朋悦实验动物繁育有限公司[实验动物生产许可证号SCXK (鲁)20190003,合格证编号370726211100788147],饲养于河南中医药大学实验动物中心[实验动物使用许可证号SYXK (豫) 2021-0015],动物实验经河南中医药大学实验动物伦理委员会审核通过(伦理号DWLL202109007)。小鼠脑微血管内皮细胞株bEnd.3 (编号BNCC339490),购自河北北纳生物科技有限公司。
1.2 药物 六味地黄丸(仲景宛西制药股份有限公司,批号210105); Aβ1-40(上海源叶生物科技有限公司,批号D08GS170718); RAGE 抑制剂FPS-ZM1 (美国MCE 公司,货号945714-67-0)。
1.3 试剂 胎牛血清(苏州双洳生物科技有限公司,批号QA01563); DMEM 高糖培养基、BCA 试剂盒、RIPA 裂解液、PMSF、蛋白磷酸酶抑制剂(北京索莱宝科技有限公司,批号20220507、20210406、20200826、20211129、20211010); 增强型细胞增殖毒性检测(CCK-8) 试剂(上海翊圣生物科技有限公司,批号C8102040); LRP1 抗体(美国Santa Cruz 公司,货号2703-1); 甘油醛-3-磷酸脱氢酶(GAPDH) 抗体(上海泊湾生物科技有限公司,批号F057302); BDNF 抗体(武汉三鹰生物科技有限公司,批号10003458); RAGE、MMP-2、MMP-9、ZO-1、辣根过氧化物酶(HRP)标记的山羊抗兔多克隆抗体、HRP 标记的山羊抗小鼠多克隆抗体(武汉博士德生物工程有限公司,货号10CM57、11CM341、ZP2807BP07、ZP1007BP07、BST15J22C15K55、BST16K30C16L50)。
1.4 仪器 Multiskan GO 型多功能全波长酶标仪(美国Thermo Fisher Scientific 公司); Microfuge ®20R 型高速冷冻离心机(美国Beckman Coulter 公司); JY200C 型电泳仪、Mini-Protean 型蛋白转印系统(美国Bio-Rad 公司); DFC450C 型倒置荧光显微镜(德国Leica 公司)。
2 方法
2.1 六味地黄丸含药血清(MSLDP) 制备 昆明小鼠适应性饲养1 周后,分为给药组和对照组。六味地黄丸浓缩丸溶于生理盐水制备混悬液。根据课题组前期研究结果,给药组以2.7 g/kg 剂量灌胃,对照组以等体积生理盐水灌胃,每天2 次,连续3 d。第4 天给药1 h 后,摘眼球取血。全血室温下静置2 h 后,3 000 r/min 离心10 min,取血清,56 ℃水浴灭活30 min,0.22 μm 无菌滤器过滤除菌,分装后于-80 ℃保存备用。
2.2 Aβ1-40和FPS-ZM1 配制 Aβ1-40用无菌超纯水配制,于5% CO2培养箱中37 ℃孵育7 d,待其变为凝胶状态后取出并分装于无菌EP 管内,终浓度为1 154.78 μmol/L; FPS-ZM1 是一种高亲和且无细胞毒性的RAGE 抑制剂,本实验选用浓度为1 μmol/L。2 种试剂均置于-20 ℃冰箱保存。
2.3 细胞培养 bEnd.3 细胞使用含10% FBS、90% DMEM 高糖培养基在37 ℃、5% CO2恒温培养箱中培养,待细胞生长至合适密度时换液或接种于96、24、6 孔板细胞培养板,以便后续实验。
2.4 分组及给药 为了明确MSLDP 对Aβ1-40损伤的bEnd.3 细胞紧密连接的影响,将细胞分为对照组、Aβ1-40组、Aβ1-40+MSLDP 组、MSLDP 组。为进一步探讨MSLDP 对Aβ1-40损伤bEnd.3 细胞RAGE/MMP-2/MMP-9 的调控作用,将细胞分为对照组、Aβ1-40组、FPS-ZM1 +Aβ1-40组和FPS-ZM1 +Aβ1-40+MSLDP 组。
2.5 CCK8 检测细胞存活率 细胞以每孔1×105个的密度接种到96 孔板上,培养至完全贴壁生长后,按“2.4” 项下分组给药处理后培养24 h,每孔加入10 μL CCK-8 试剂,在培养箱避光孵育1 h,用多功能酶标仪测定每组细胞在450 nm 波长下的吸光度,计算细胞存活率。
2.6 免疫荧光检测细胞LRP1、RAGE、ZO-1 的荧光强度 在显微镜下观察细胞状态后弃旧培养基,用1×PBS 洗2 次,每次3 min; 每孔加入4%多聚甲醛200 μL,室温培养1 h; 除去多聚甲醛,1×PBS 洗3 次,每次3 min; 每孔加入7% 山羊血清200 μL,室温封闭2 h; 弃封闭液,加入1×PBS 稀释的一抗LRP1 (1 ∶200)、RAGE (1 ∶200)、ZO-1 (1 ∶200),每孔100 μL,4 ℃孵育过夜; 回收一抗,1×PBS 洗3 次,每次3 min,每孔加入荧光二抗100 μL (1 ∶500),室温孵育1 h,避光操作;弃去二抗,1×PBS 洗3 次,每次3 min; 每孔加入DAPI 溶液50 μL 染核,避光孵育3 min,1×PBS 洗4 次,每次5 min。从24 孔板中取出爬片盖于加含2 μL 抗荧光淬灭剂的载玻片上,于荧光显微镜下观察并采集图像。
2.7 Western blot 法检测细胞 LRP1、RAGE、MMP9、MMP-2、ZO-1、BDNF 蛋白表达 收集细胞蛋白,使用BCA 试剂盒测定蛋白浓度,根据蛋白浓度加入5×上样缓冲液,95 ℃变性10 min,冷却后上样,凝胶电泳后将蛋白转至聚偏二氟乙烯膜(PVDF) 上; 用TBST 配制的5%脱脂奶常温摇床封闭2 h; 加入稀释好的一抗LRP1、RAGE、MMP-9、MMP-2、ZO-1、BDNF (1 ∶1 000) 4 ℃冰箱孵育过夜; 使用TBST 摇洗3 次后加入相应的二抗(1 ∶10 000) 室温摇床孵育1 h,再用TBST摇洗3 次; 使用ECL 显影液显影,使用Image J 图像分析软件进行定量分析。
2.8 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以(±s) 表示,组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
3 结果
3.1 Aβ1-40对bEnd.3 细胞活性的影响 如图1 所示,与空白组(0 μmol/L) 比较,随着Aβ1-40浓度的增加,细胞存活率逐渐降低,呈现剂量依赖性(P<0.01)。结合前期研究基础,选择10 μmol/L Aβ1-40为合适的造模浓度。
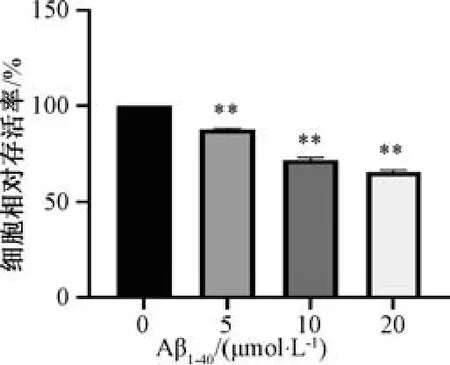
图1 Aβ1-40对bEnd.3 细胞活性的影响(±s,n=6)Fig.1 Effects of Aβ1-40 on the viability of bEnd.3 cells(±s,n=6)
3.2 MSLDP 对Aβ1-40损伤bEnd.3 细胞活性的影响 如图2 所示,与对照组比较,Aβ1-40组细胞存活率降低(P<0.01); 与Aβ1-40组比较,随MSLDP浓度增加细胞存活率升高(P<0.05,P<0.01)。MSLDP 浓度为12%时,细胞存活率不再升高,故选择10%作为MSLDP 最佳作用浓度。
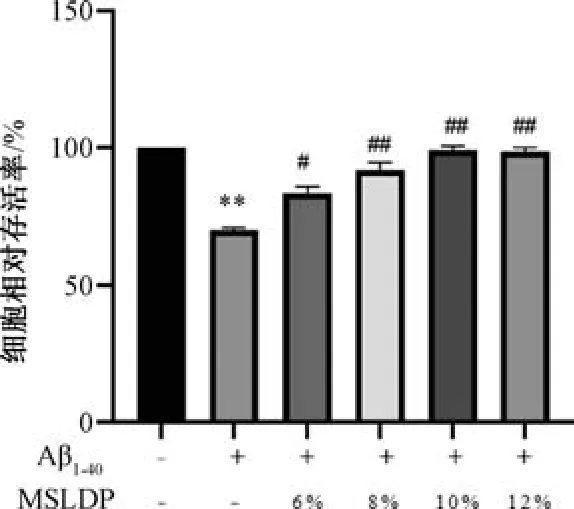
图2 MSLDP 对Aβ1-40损伤bEnd.3 细胞活性的影响(±s,n=6)Fig.2 Effects of MSLDP on the viability of bEnd.3 cells injured by Aβ1-40 (±s,n=6)
3.3 MSLDP 对Aβ1-40损伤bEnd.3 细胞LRP1、RAGE 蛋白表达的影响 Western blot 结果如图3 所示,与对照组比较,Aβ1-40组LRP1 蛋白表达降低(P<0.05),RAGE 蛋白表达升高(P<0.01); 与Aβ1-40组比较,MSLDP 组和MSLDP+Aβ1-40组LRP1蛋白表达均升高(P<0.05),RAGE 蛋白表达均降低(P<0.05)。免疫荧光定位如图4 所示,与对照组比较,Aβ1-40组LRP1 荧光强度降低(P<0.01),RAGE 荧光强度增强(P<0.01); 与Aβ1-40组比较,MSLDP 组和MSLDP +Aβ1-40组LRP1 荧光表达均增强(P<0.05,P<0.01),RAGE 荧光强度均减弱(P<0.01),与Western blot 结果相一致。
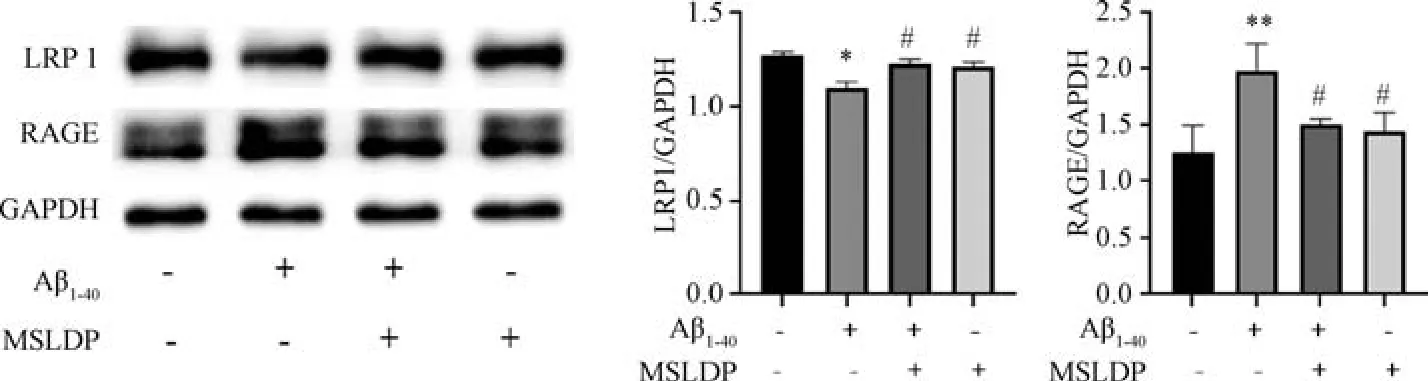
图3 MSLDP 对Aβ1-40损伤bEnd.3 细胞LRP1 和RAGE 蛋白表达的影响(±s,n=3)Fig.3 Effects of MSLDP on the protein expressions of LRP1 and RAGE in bEnd.3 cells injured by Aβ1-40 (±s,n=3)
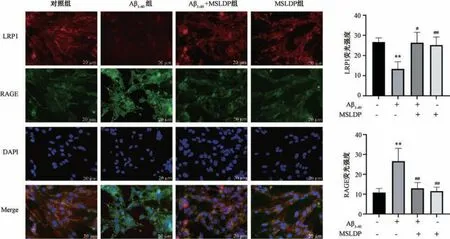
图4 MSLDP 对Aβ1-40损伤bEnd.3 细胞LRP1、RAGE 荧光表达的影响(±s,n=3)Fig.4 Effects of MSLDP on the fluorescence expressions of LRP1 and RAGE in bEnd.3 cells injured by Aβ1-40 (±s,n=3)
3.4 MSLDP 对Aβ1-40损伤bEnd.3 细胞MMP-2、MMP-9、ZO-1、BDNF 蛋白表达的影响 如图5 所示,与对照组比较,Aβ1-40组细胞MMP-2、MMP-9蛋白表达升高(P<0.01),ZO-1、BDNF 蛋白表达降低(P<0.01); 与Aβ1-40组比较,MSLDP 组和MSLDP+Aβ1-40组细胞MMP-2、MMP-9 蛋白表达均降低(P<0.01),ZO-1、BDNF 蛋白表达均升高(P<0.01)。
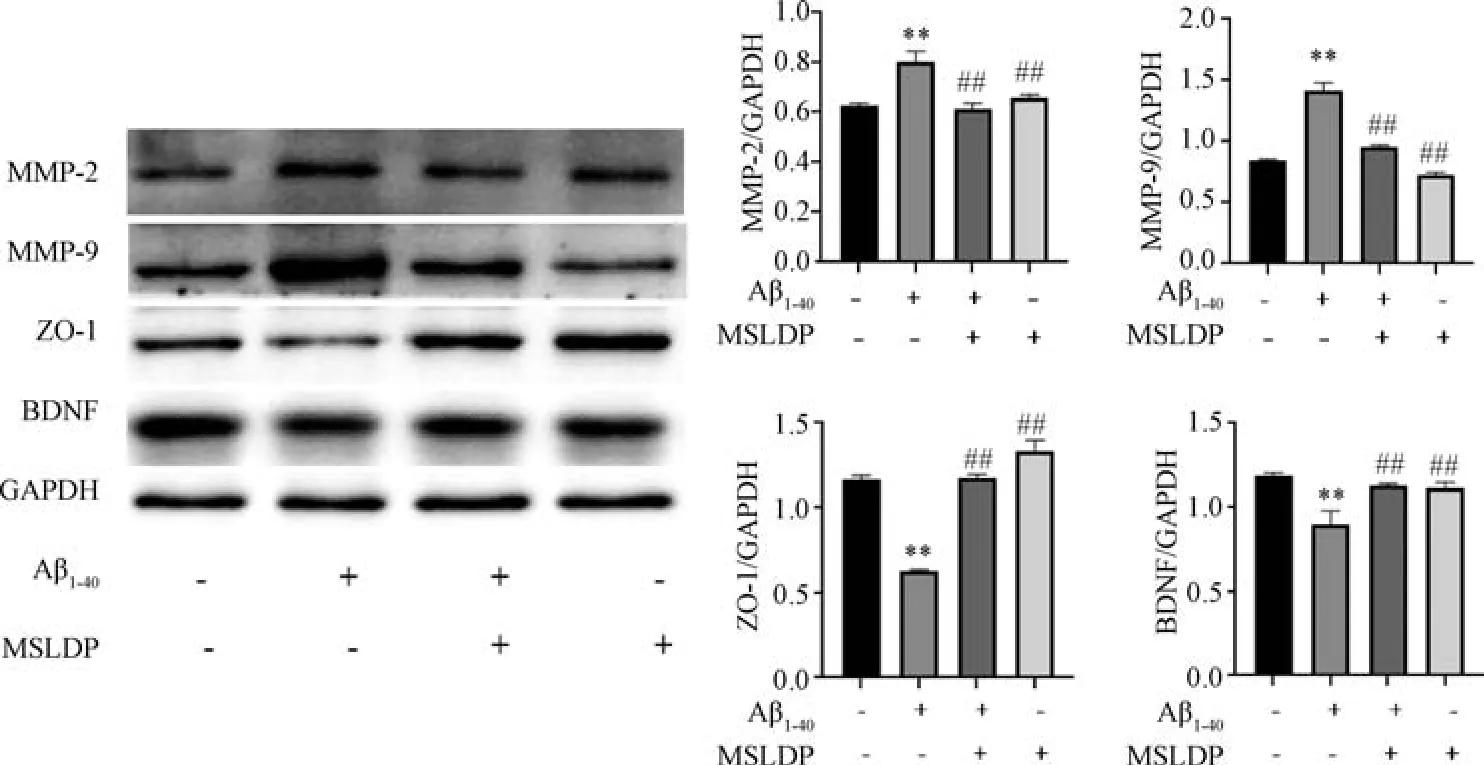
图5 MSLDP 对Aβ1-40损伤bEnd.3 细胞MMP-2、MMP-9、ZO-1、BDNF 蛋白表达的影响(±s,n=3)Fig.5 Effects of MSLDP on the protein expressions of MMP-2,MMP-9,ZO-1 and BDNF in bEnd.3 cells injured by Aβ1-40 (±s,n=3)
3.5 MSLDP 对Aβ1-40损伤bEnd.3 细胞ZO-1 荧光表达的影响 如图6 所示,与对照组比较,Aβ1-40组ZO-1 荧光强度减弱(P<0.01); 与Aβ1-40组比较,MSLDP 组和MSLDP +Aβ1-40组细胞ZO-1 荧光表达均增强(P<0.05,P<0.01)。
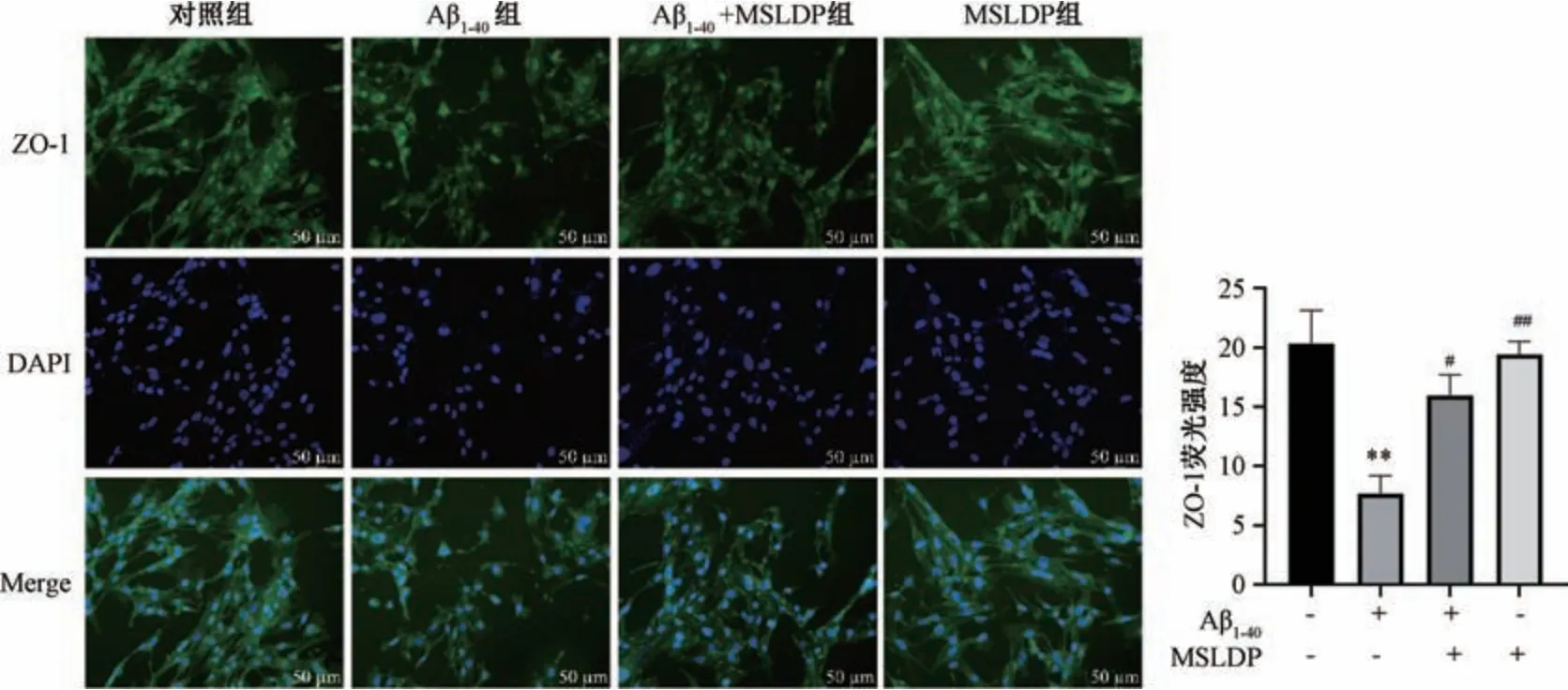
图6 MSLDP 对Aβ1-40损伤bEnd.3 细胞ZO-1 荧光表达的影响(±s,n=3)Fig.6 Effects of MSLDP on the fluorescence expression of ZO-1 in bEnd.3 cells damaged by Aβ1-40 (±s,n=3)
3.6 MSLDP 及FPS-ZM1 对Aβ1-40损伤bEnd.3 细胞RAGE、MMP-2、MMP-9、ZO-1 蛋白表达的影响 如图7 所示,与对照组比较,Aβ1-40组细胞MMP2、MMP-9、RAGE 蛋白表达升高(P<0.05,P<0.01),ZO-1 蛋白表达降低 (P<0.05); 与Aβ1-40组比较,Aβ1-40+FPS-ZM1 组和Aβ1-40+FPSZM1+MSLDP 组细胞MMP-2、MMP9、RAGE 蛋白表达均降低(P<0.05,P<0.01),ZO-1 蛋白表达均升高(P<0.05,P<0.01)。
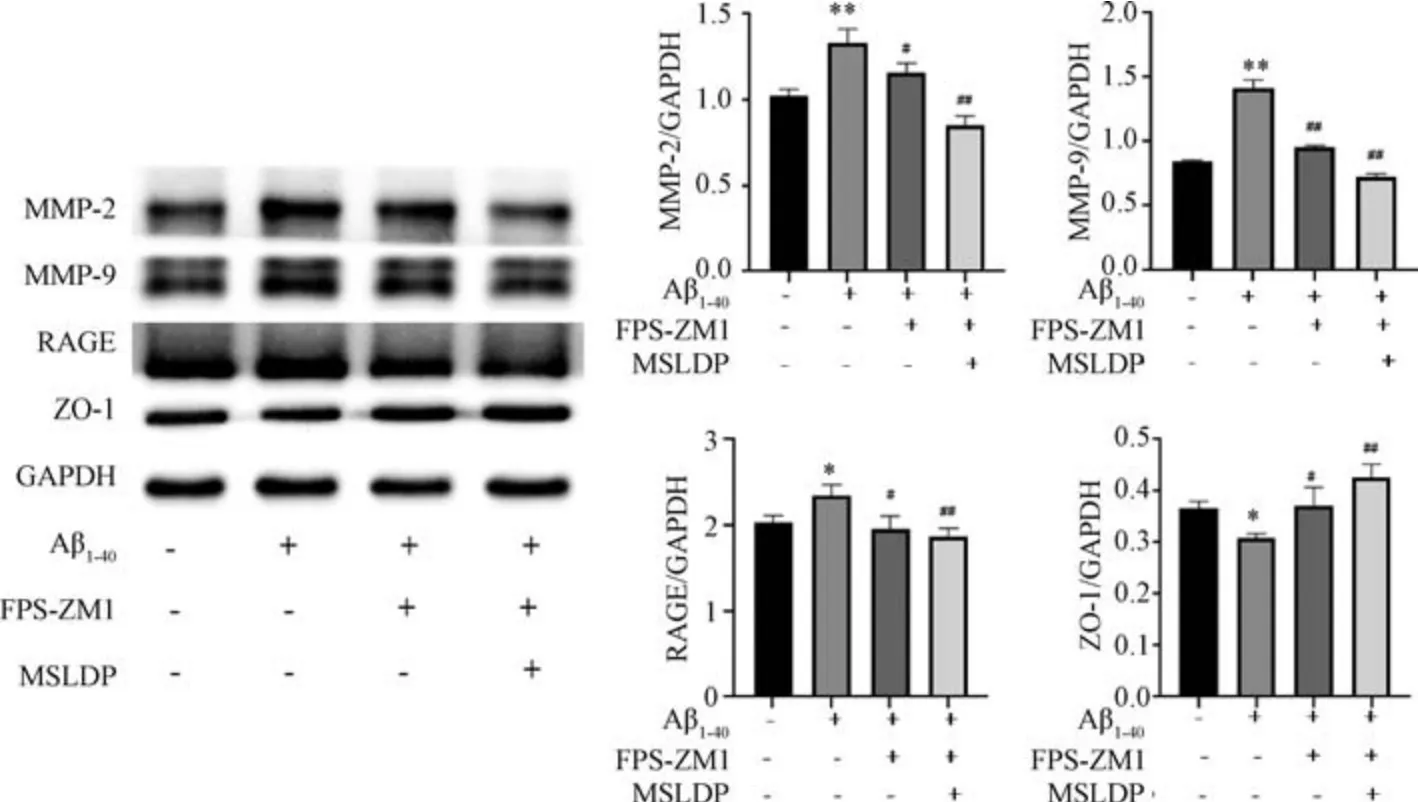
图7 MSLDP 及FPS-ZM1 对Aβ1-40损伤bEnd.3 细胞RAGE、MMP-2、MMP-9、ZO-1 蛋白表达的影响(±s,n=3)Fig.7 Effects of MSLDP and FPS-ZM1 on the protein expressions of RAGE,MMP-2,MMP-9 and ZO-1 in bEnd.3 cells injured by Aβ1-40 (±s,n=3)
4 讨论
中医并无AD 这一病名的记载,但关于AD 相关症状记载于中医“痴呆” “善忘” “健忘” 等中。张锡纯在《医学衷中参西录》[12]中提出: “人之脑髓空,……甚或突然昏厥,知觉运动俱废。”AD 发生的原因主要是由于髓海不足。肾主骨生髓,可见补肾对治疗AD 的重要意义。六味地黄丸是经典补肾方剂之一,网络药理学研究表明六味地黄丸可通过多靶点、多途径发挥治疗AD 的作用[13]。课题组前期研究发现六味地黄丸能够保护神经细胞,对VEGF 调节的作用可能与脑微血管内皮功能有关[14],同时也发现六味地黄丸能够调节RAGE/LRP1 受体系统影响Aβ 代谢,改善SAMP8小鼠的脑微血管损伤[9],本次实验进一步深入研究其作用机制。
血脑屏障是大脑与外周循环系统的一道重要生理性的屏障,阻止外周有害物质进入脑内,保护脑内部环境的稳定。研究表明,Aβ 毒性作用介导了血脑屏障结构破坏,并致使其通透性增加[15]; 而通透性增加又会促进外周Aβ 更容易透过血脑屏障进入脑内,造成AD 病程的恶性循环[16-18]。血脑屏障通透性增加也与MMPs 相关,尤其是MMP-2 和MMP-9[19]。有研究表明AD 模型小鼠海马内MMPs表达明显增多,MMPs 可以降解毛细血管基底膜蛋白从而破坏血脑屏障,增加其通透性[20]。本研究发现,Aβ1-40作用于bEnd.3 细胞后,细胞活性降低,RAGE 表达升高,LRP1 表达降低,这可能导致Aβ 转运失调,在细胞内过度累积,进而加重细胞毒性。同时本研究还发现,Aβ1-40作用于bEnd.3 细胞后,MMP-2、MMP-9 蛋白表达升高,ZO-1表达降低,进一步说明了Aβ 诱导的MMPs 通过破坏细胞紧密连接,损害血脑屏障功能,增加其通透性。MSLDP 作用后,细胞活性增加,RAGE、MMP-2 和MMP-9 蛋白表达下调,LRP1 和ZO-1 表达上调,说明六味地黄丸能够抑制Aβ 的向内转运,增加了对脑微血管内皮细胞的保护作用。BDNF 是体内含量最多的神经营养因子,可保护神经元免受Aβ 集沉积所致的神经毒性损伤[21]。本研究发现,Aβ1-40抑制BDNF 的表达,而六味地黄丸能够增加其表达,进一步说明了六味地黄丸具有保护神经元的作用。
进一步探讨MSLDP 的调控作用是否以RAGE为靶点,采用了RAGE 特异性抑制剂进行研究,发现RAGE 抑制剂可以改善Aβ1-40引起的ZO-1、MMP-2、MMP-9 改变,说明RAGE 在损害AD 血脑屏障中起重要作用。且RAGE 抑制剂与MSLDP 联用对ZO-1、MMP-2、MMP-9 表达调控更为明显,因此推断MSLDP 对Aβ1-40损伤的AD 细胞模型的保护作用与调控RAGE 途径密切相关。这说明了六味地黄丸能够通过RAGE 途径调节MMP-2/MMP-9 改善内皮细胞连接和血脑屏障,发挥防治AD 的作用。但RAGE 在AD 中还有其他作用机制,如其与NF-κB 相互作用的炎症机制、与配体的相互作用途径等,需要进一步深入研究,为六味地黄丸调控RAGE 途径防治AD 提供更多的实验依据。
