基于心理痛苦和静息态脑电成分的多模态数据对抑郁症自杀未遂的分类效能
2024-03-11安依雯李杨李欢欢温晓通郭婷王湘
安依雯,李杨,李欢欢,温晓通,郭婷,王湘
(1.中国人民大学心理学系,北京 100872;2.中南大学湘雅二医院医学心理研究中心,长沙 410011)
自杀是全球性重大公共卫生问题,每年约造成70 万人死亡[1]。重性抑郁症(major depressive disorder, MDD)是自杀死亡中最常见的精神障碍之一。MDD患者终生自杀未遂的发生率为31%[2]。因此,以MDD 患者为研究对象,探索能有效区分高、低自杀风险的关键心理因素及其相关神经基础,是自杀研究领域的一个重要方向。
近年来,心理痛苦能有效预测MDD患者自杀意念和自杀未遂的行为学证据逐渐累积。心理痛苦是一种复杂的负性情绪内省体验,表现为羞耻、恐惧、内疚、悲伤、绝望和愤怒等[3]。来自横断面和纵向研究结果显示,心理痛苦在大学生的抑郁与自杀未遂之间起部分中介作用,且只有大学生入学时的心理痛苦水平能显著预测10年后的自杀未遂,而抑郁和无望感则不能[4,5]。Li[6]进一步提出自杀的心理痛苦三因素模型(痛苦唤醒、痛苦体验和痛苦逃避),强调高痛苦逃避动机才是预测自杀行为的关键因素。传统线性回归分析结果显示,在国内MDD患者中仅有痛苦逃避可以显著预测自杀意念和自杀未遂,国内大学生、国外社区和大学生人群中仅有痛苦逃避可以显著预测自杀意念[7-9]。采用分类与回归树算法结果显示,痛苦逃避位于中学生自杀危机分类模型的根节点[10]。以上行为学证据显示,心理痛苦,尤其是痛苦逃避可能是预测MDD 患者自杀未遂的关键心理因素。
情感激励延迟任务(affective incentive delay task,AID)是能够有效分离痛苦加工过程的认知范式[11]。该范式惩罚条件下的期待阶段、目标反应阶段和反馈阶段分别对应痛苦逃避、痛苦唤醒和痛苦体验。来自传统分析的任务态脑电研究结果显示,有自杀未遂史的MDD 患者在AID 任务惩罚条件负反馈时诱发的反馈相关负波(feedback-related negativity,FRN)波幅显著大于无自杀未遂史者[12]。高自杀意念水平的大学生在自我参照惩罚条件和奖励条件负反馈时诱发的晚期正电位(late positive potential,LPP)波幅均大于中性条件,在自我参照惩罚条件下,负反馈诱发的晚期theta能量值显著小于低自杀意念者[13]。由于FRN可能反映了个体对负性刺激的注意偏向和情绪加工[14],LPP 反映了个体对动机性刺激的神经反应[15],theta也与情绪加工有关[16],上述研究结果提示,高自杀风险的MDD患者对惩罚刺激的注意投入过多,并且对其诱发的负性情绪反应难以进行有效调节。
上述研究基于传统分析方法探索区分高低自杀风险者的痛苦加工相关神经电生理指标,可能存在的问题是:一方面,神经电生理指标与自杀意念或自杀未遂之间并非线性关系,而传统分析方法对于非线性数据的处理具有明显的局限性,基于平均值差异的计算结果可能存在偏倚,难以发现区分不同自杀风险的有效神经电生理指标。另一方面,自杀脑机制作为一个复杂的、具有高维空间特征的模型,应综合多模态数据,而非单模态数据进行刻画。机器学习(machine learning,ML)作为一种新兴的寻找疾病生物标记物的非线性数据处理方法,能够整合多模态数据来预测自杀风险,提高自杀分类模型的敏感性和特异性[17]。一项综述表明,基于机器学习对自杀行为的预测效能(AUC=0.87)优于传统回归分析(AUC=0.58)[18]。
在机器学习中,支持向量机(support vector machine,SVM)是具有相关学习算法的监督学习模型,可用于分析和分类连续变量,且当样本量较小时,分类准确率高,泛化能力强[19]。基于此,有研究者结合心理痛苦三因素模型的行为指标、自我参照AID 任务态脑电成分和少数静息态脑电特征,采用支持向量机算法建立多模态大学生自杀意念分类模型,结果显示,该模型准确率(accuracy)高达85.66%。痛苦逃避是模型重要特征集的首位重要特征,排名前十的脑电特征均为任务态脑电成分,包括自我参照惩罚条件下的关联性负变(contingent negative variation, CNV)、LPP、target-P3 和feedback-P3 等,而静息态脑电成分未能进入该模型的前十位重要特征中[20]。提示机器学习构建痛苦逃避及痛苦加工相关脑电成分的多模态模型对于识别非临床群体自杀意念具有较为重要的价值。然而,基于心理痛苦三因素模型的多模态数据是否在MDD 患者自杀未遂分类模型中具有重要作用仍需要探索。
值得注意的是,基于心理痛苦相关的多模态数据建构的自杀分类模型,还缺乏更为丰富的静息态脑电指标。与任务态相比,静息态EEG作为大脑的自发脑电活动,不受任务本身的干扰,有利于了解基线心理痛苦水平的神经电生理指标对于自杀分类模型的贡献。以往研究发现,有自杀未遂史的MDD患者相比于健康对照组在睡眠期间delta 活动减少[21]。在控制抑郁水平后,额叶delta活动可以负向预测心理痛苦水平[16]。由于较低的delta表征了静息态下自发大脑活动较强,上述结果提示,delta功率减少,反映出额叶皮层的高度激活和睡眠质量下降,可能是个体表现出更高的心理痛苦水平和自杀风险的神经电生理特征。
此外,也有研究考察额叶α不对称性、theta、beta和gamma与自杀风险的关系。例如,MDD患者的额叶α不对称指数与自杀风险呈正相关[22];健康人群中高自杀意念水平者额叶中区的theta 相对功率值显著高于低自杀意念水平者[23]。在女性MDD 患者中考察静息态EEG与自杀之间的关系,发现与无自杀意念和自杀未遂史的MDD 患者相比,有自杀意念和自杀未遂史者在额叶区域均表现出较低的beta和gamma 节律[24]。因此,基于多模态数据的自杀分类模型,应纳入上述多种静息态脑电指标进行分析。
综上,本研究以有、无自杀未遂史的MDD 患者为研究对象,结合心理痛苦三因素模型,整合人口学特征、临床量表得分和静息态EEG 成分,使用递归式特征消除(recursive feature elimination,RFE)算法结合支持向量机分类器,建立多模态数据的自杀未遂分类模型。考察该模型的分类效能,并分析心理痛苦和静息态脑电指标在该模型中的重要性。
1 对象和方法
1.1 被试
本研究招募某大学附属医院心理门诊部的73名患者(女性52名),所有患者均由精神科医师根据DSM-5 诊断为MDD。病例组入组标准为:①年龄18~45 岁;②右利手;③初中及以上文化程度;④听力、视力或矫正视力正常;⑤贝克抑郁量表第一版(BDI-Ⅰ)得分≥17。根据有无自杀未遂史,将MDD患者分为抑郁自杀未遂组(major depressive disorder with a history of suicide attempts, MDD-SA,n=30)和抑郁无自杀未遂组(major depressive disorder with no history of suicide attempts,MDD-NSA,n=43)。
健康对照组(healthy control,HC)来自于同期招募的36名健康人(女性20名)。入组标准为:①年龄18~45 岁;②右利手;③BDI-I≤10;④BSI-C<2 且BSI-W<16;⑤既往无自杀未遂史;⑥初中及以上文化程度;⑦听力正常、视力或矫正视力正常。
所有被试排除标准如下:①当前或既往其他轴Ⅰ精神障碍;②既往脑部器质性疾病或既往头部创伤史、头部手术史;③当前或既往患有重大躯体疾病或神经系统疾病;④近一年接受过电休克治疗。
本研究经大学附属医院研究伦理委员会审批,所有被试均自愿参加并签署知情同意书。
1.2 测量工具
采用自编量表收集被试的一般人口学信息,包括性别、年龄、受教育程度等信息。专业医师进行临床结构化访谈并记录被试的既往自杀未遂史。
三维心理痛苦量表(Three-dimensional Psychological Pain Scale, TDPPS)[6]:用于测量心理痛苦水平,包括痛苦唤醒、痛苦体验、痛苦逃避三个分量表。该量表在我国MDD群体中信效度良好[6]。本研究样本中,TDPPS 和痛苦唤醒、痛苦体验、痛苦逃避分量表的Cronbach’s α系数分别为0.96、0.85、0.93和0.91。
贝克抑郁量表第一版(Beck Depression Inventory-I,BDI-Ⅰ)[25]:用于评估个体抑郁状态。该量表中文修订版在中国MDD 群体中具有良好的信效度[26]。本研究样本中,Cronbach’s α=0.96。
贝克自杀意念量表(Beck Suicide Ideation Inventory, BSI)[27]:评估最严重时自杀意念(suicidal ideation at one’s worst point,BSI-W)和最近一周自杀意念(current suicidal ideation, BSI-C)。本研究样本中,BSI-W和BSI-C的Cronbach’s α系数均为0.94。
1.3 EEGs数据采集和分析
1.3.1 脑电数据采集和预处理 在屏蔽电磁和安静的实验室,被试坐于舒适凳子上保持清醒的放松状态,采用美国NeuroScan 4.3(Neurosoft, IncSterling,USA)型64导数字化脑电记录分析系统记录其睁眼静息状态下的5分钟脑电信号。收集电生理数据时使用左乳突(M1)作为参考电极,右乳突(M2)为记录电极,所有电极与头皮之间的阻抗均保持在5kΩ以下。采用0.05~100Hz的带通滤波器,采样频率为1000Hz/电导,通过放大器放大,记录连续脑电图。
使用基于MATLAB 的开源工具包EEGLAB 对脑电数据进行预处理。将M1、M2 的平均值作为重参考数据,进行0.1~50Hz的带通滤波。对数据进行分段(2s/段),对坏电极插值坏导。使用独立成分分析(independent component analysis, ICA)算法,人工去除眨眼、眼动或肌电等伪迹成分。删除振幅超过±100uV分段,保留至少有30个分段的被试。
1.3.2 频谱分析 预处理后的脑电数据进行频谱分析,计算每个被试每个电极的功率谱。每段数据进行快速傅里叶变换(fast fourier transform,FFT),将时域特征转化为频域特征,以获得频段能量。从感兴趣电极点中提取了以下9个频段的平均绝对功率值和相对功率值:delta(1~4Hz,Fz、Pz 和Oz)、theta(5~7Hz,Fpz、Fcz 和Fz)、总alpha(8~12Hz,F3 和F4)、低频alpha(8~10Hz)、高频alpha(10~12Hz)、beta(13~30Hz,Cz、Oz 和Pz)、总gamma(31~49Hz,Fpz、Fz、Cz 和Oz)、低频gamma(31~40Hz)、高频gamma(40~49 Hz)。由于EEG数据高度偏态化,对各频段能量值在统计分析之前均采用自然对数转换以达到正态性。关于额叶alpha 不对称指数,计算FAA=ln[F4alpha]-ln[F3alpha], 低频FAA=ln[F4 低频alpha]-ln[F3 低频alpha],高频FAA =ln[F4 高频alpha]-ln[F3高频alpha]作为其指标。
1.4 统计分析
使用SPSS 26.0 进行数据分析。对人口学变量采用卡方检验/单因素方差分析(ANOVA)进行组间差异检验,进一步以年龄为协变量对临床量表变量进行协方差分析(ANCOVA)。事后检验P值在方差齐性时使用Bonferroni 校正,方差不齐时使用Games-Howell校正。对量表得分与FAA值、各频段各电极点能量值进行Pearson积差相关,设置P<0.05为具有统计学意义。
1.5 机器学习
从每个被试中提取了19个EEG特征(均采用绝对能量值),作为单模态特征集。加上年龄、痛苦唤醒、痛苦体验、痛苦逃避和BDI量表分等人口学和临床特征,得到24个特征,构成多模态特征集。
首先,分别构建痛苦唤醒、痛苦体验和痛苦逃避单模态二分类模型。结果变量根据TDPPS 中各分量表的划界分标记,小于划界分标记为“0”,大于划界分标记为“1”[28]。其次,分别构建自杀未遂的单模态和多模态分类模型。结果变量根据既往有无自杀未遂史进行标记,无自杀未遂史的个体为“0”,有自杀未遂史的为“1”。对结果变量进行编码后,将单模态特征与多模态特征分别作为输入特征集(设变量数为M)。
机器学习需要在数据子集上训练分类器,并在独立子集上测试分类器。第一步,将数据随机拆分为训练集(70%)和测试集(30%)并通过有放回的随机抽样重复1000 次。第二步,采用RFE 的思想,在训练集中应用支持向量机分类器进行M-1 次训练。采用十折交叉验证对测试集数据进行分割,根据10 次验证结果的平均值计算所有输入特征的权重。根据权重对所有特征进行排序,删除权重值最低的特征后,将其余特征存储为新特征集(变量数为M-1),以此为输入变量进行下一次训练。第三步,将每次训练获得的分类应用于测试集进行评估,获取准确率(Accuracy)、精度(Precision)、召回(Recall)和AUC 值随纳入特征的个数变化的函数曲线作为模型分类性能的评估指标[29]。最后,对上述评估指标曲线在1000次抽样之间进行平均,以获取其随分类模型纳入的重要特征数目变化的平均函数曲线,同时对每个特征在1000 次抽样中的权重等级值进行平均,以获取特征权重等级的平均值。
2 结果
2.1 人口统计学和临床量表结果
卡方检验和方差分析结果显示,三组被试的性别比例、受教育程度差异不显著,年龄差异显著(P<0.01)(见表1)。年龄与各量表得分做相关分析显示,年龄与BSI-C 显著负相关(r=-0.20,P<0.05),与BDI、BSI-W、TDPPS 及其分量表得分相关均不显著。后续差异分析将年龄作为协变量。
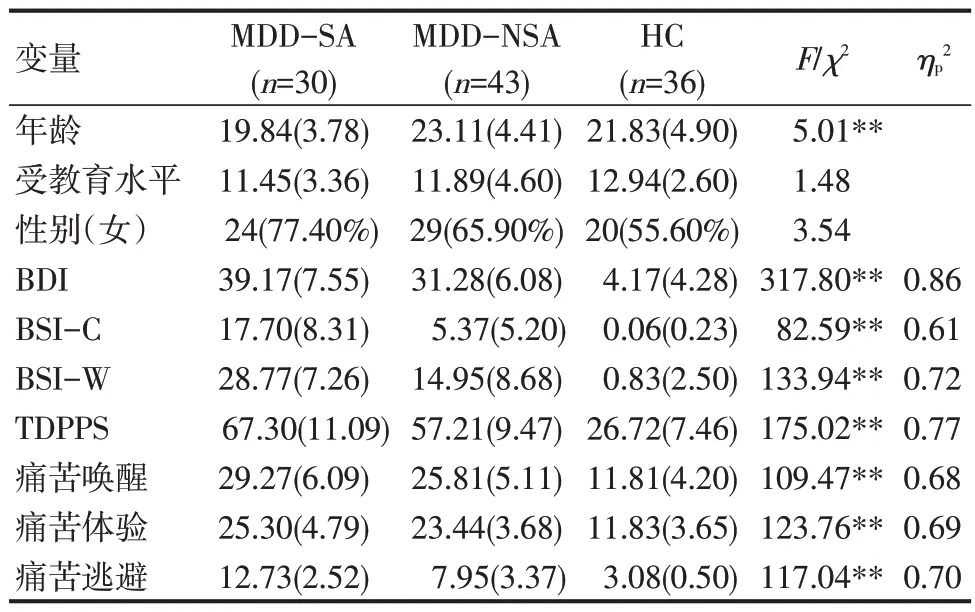
表1 被试人口统计学特征和临床量表得分差异
方差分析显示,三组被试BDI、BSI-C、BSI-W、TDPPS总分及其分量表得分差异显著(Ps<0.01)(见表1)。事后比较发现,MDD-SA 组的BDI、BSI-C、BSI-W、TDPPS和痛苦逃避得分显著高于MDD-NSA组和HC 组(Ps<0.01);MDD-SA 组痛苦唤醒得分显著高于MDD-NSA 组(P<0.05)和HC 组(P<0.01);上述量表得分MDD-NSA 组均显著高于HC 组(Ps<0.01)。MDD-SA和MDD-NSA的痛苦体验得分显著高于HC组(Ps<0.01)。
2.2 机器学习结果
单模态分类模型中,痛苦唤醒、痛苦体验、痛苦逃避和自杀未遂分类模型在分别纳入11、12、8 和8个重要特征时,1000次抽样的模型评估指标平均值达到最佳(见表2)。
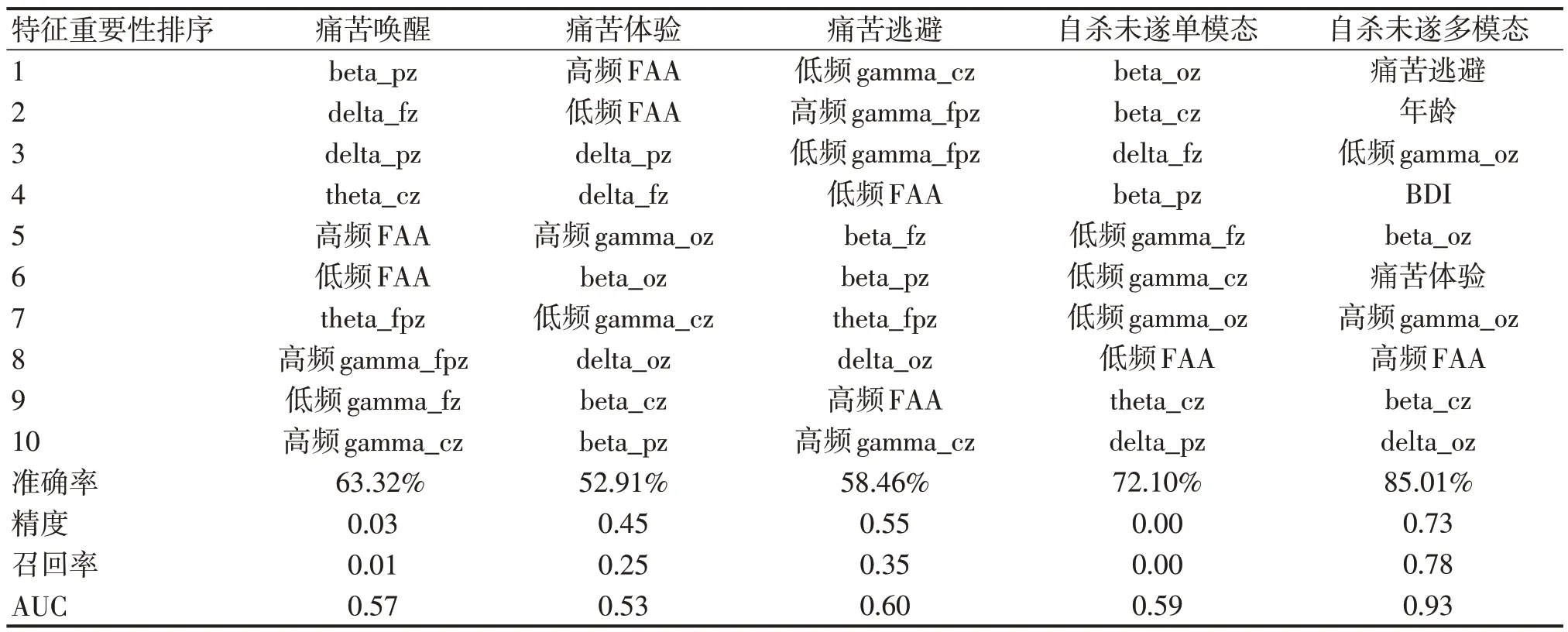
表2 五个分类模型的重要特征集及分类性能
多模态分类模型在1000 次抽样的模型评估指标平均值随纳入重要特征数目变化的函数曲线如图1所示。当纳入3个重要特征时,自杀未遂多模态分类模型各指标达到最佳(accuracy=85.01%, precision=0.73, recall=0.78, AUC=0.93)。自杀未遂多模态分类模型中,痛苦逃避、年龄、oz通道的低频gamma和BDI在重要特征集中排序前四(见表2)。
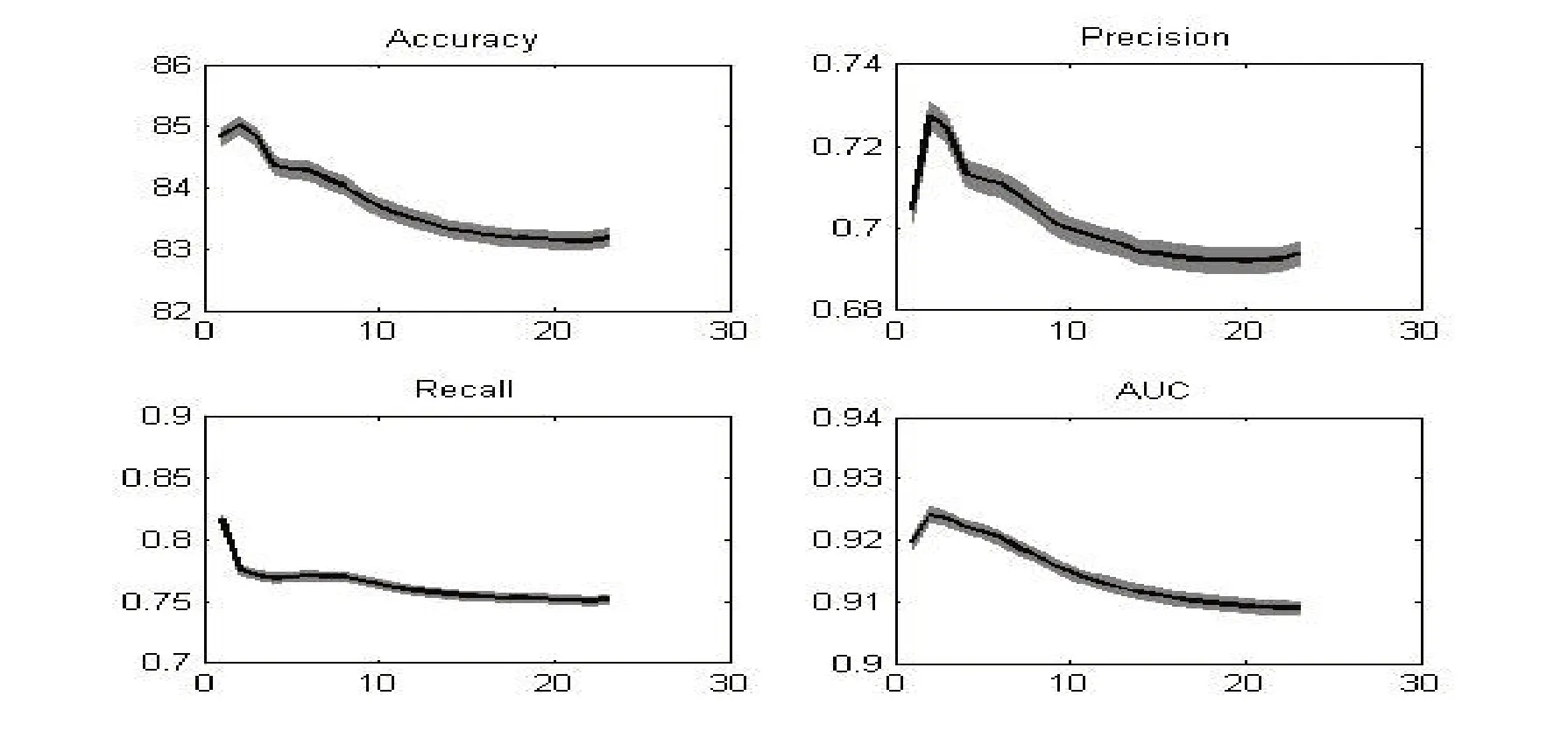
图1 自杀多模态分类模型评估指标变化曲线
2.3 静息态脑电传统分析结果
方差分析结果表明,在低频gamma频段,oz通道的绝对能量值在三组之间差异显著,事后检验显示:MDD-SA 组显著大于MDD-NSA 组。三组被试总FAA 和高频FAA 值差异显著,事后检验显示MDDSA 组显著小于HC 组和MDD-NSA 组。在delta 频段,三组被试的绝对能量值在fz、oz和pz通道上差异显著,事后检验显示在fz和oz通道上MDD-SA 组显著大于MDD-NSA 组和HC 组,且MDD-NSA 组显著大于HC 组;在pz 通道上MDD-SA 组显著大于MDD-NSA 组。三组被试的相对能量值在fz 通道上差异显著,事后检验显示MDD-SA 组显著大于MDD-NSA。在beta频段,三组被试的绝对能量值在oz 通道差异显著,事后检验显示MDD-SA 组显著大于MDD-NSA组。其余频段和通道的绝对能量值或相对能量值三组之间差异均不显著(见表3)。

表3 三组被试额叶alpha不对称指数与各频段绝对/相对能量值差异
相关分析结果表明,总gamma、低频gamma、高频gamma 频段的绝对能量值在fpz 通道上均与痛苦逃避以及BSI-C显著正相关;总gamma、低频gamma和高频gamma 频段的相对能量值在fpz 通道上均与痛苦逃避、BSI-C 和BSI-W 显著正相关。其余脑电指标和量表相关分析的结果见表4。

表4 EEG绝对和相对能量值与临床量表得分的相关分析
3 讨论
本研究首次整合人口学特征、TDPPS 量表得分和多种静息态脑电指标等多模态数据,采用机器学习算法考察MDD 患者自杀未遂分类模型的区分效能及其重要特征集。结果发现,基于多模态数据的自杀未遂分类模型准确率为85.01%,AUC 为0.93,模型区分效能优良。痛苦逃避在自杀未遂多模态分类模型的最优特征集中排名第一,抑郁排名第二,枕叶区域的低频gamma、beta 和高频gamma 是该分类模型特征重要性排名前三的静息态脑电指标。且cz和fpz通道低频和fpz通道的高频gamma是痛苦逃避分类模型中排名前三的静息态脑电指标。进一步验证了痛苦逃避的行为学指标在区分MDD 自杀风险中的重要性,并为gamma 作为自杀未遂和痛苦逃避分类模型有效指标的可能性提供了研究证据支持。
本研究发现,MDD-SA 组TDPPS 总分、痛苦唤醒和痛苦逃避得分显著高于MDD-NSA 组,但两组痛苦体验得分无显著差异,与以往研究结果类似[6,20]。表明痛苦逃避是能够区分有和无自杀未遂史MDD患者稳定的行为学指标。具有高痛苦逃避动机的MDD患者,自杀风险更高。
本研究结果显示,基于支持向量机递归特征消除法构建的痛苦唤醒(accuracy=63.32%)、痛苦体验(accuracy=52.91%)、痛苦逃避(accuracy=58.46%)分类模型准确率较低,AUC 值仅高于随机水平(0.5)。提示使用单模态的静息态脑电指标对心理痛苦进行分类的效能有限。可能的解释是:一是样本量相对较小,所得结果稳定性有待验证;二是作为复杂的内省情绪体验,单模态的静息态脑电指标表征心理痛苦不同成分的效能有限,或是当前构建模型选择的静息态脑电指标对区分不同心理痛苦加工过程的特异性不足。与痛苦分类模型不同的是:无论是自杀未遂单模态(accuracy=72.10%)还是多模态(accuracy=85.01%)分类模型的准确率均较高,且多模态分类模型的AUC 值高达0.93,优于单模态(AUC=0.59)。相比于近期一项基于静息态EEG 建立MDD的自杀意念分类模型结果(accuracy=70.50%,AUC=0.77),本研究中的自杀未遂多模态模型的AUC和准确率均更高[30],提示与仅使用静息态EEG 特征的单模态数据相比,结合心理痛苦三因素模型和静息态脑电特征的多模态数据对MDD 患者自杀未遂的识别更具有优势。
值得注意的是,在自杀未遂多模态分类模型的重要特征集中,痛苦逃避排序第一,与大学生自杀意念分类模型结果类似[20]。此外,排序第二到第四的分别是年龄、oz 通道的低频gamma 和抑郁。提示年龄和抑郁对区分有无自杀未遂个体也有较好的效能。痛苦逃避分类模型与自杀未遂分类模型中重叠的重要脑电特征为gamma。可能的解释是,痛苦逃避作为心理痛苦的动机成分,是一种高级认知过程,而在所有频段中,gamma(30~49hz)与高阶认知功能最密切相关[31]。因此,gamma 可能表征了个体基线的痛苦逃避动机,可以作为自杀未遂的潜在电生理指标。
在传统分析中,本研究发现,相比于MDD-NSA和HC 组,MDD-SA 组FAA 显著降低,且FAA 与TDPPS、痛苦唤醒和痛苦逃避得分呈显著负相关,即右侧额叶更高的激活与高痛苦逃避、自杀未遂有关,与一项任务态脑电研究结果一致。该研究发现相比于低自杀风险组,高自杀风险组在情绪stroop 任务中左额叶区域表现出活动减少[32]。由于左半球在处理积极情绪方面占主导地位,右半球激活则与负面情绪加工有关[33]。该结果提示MDD-SA组表现出对负性刺激的优势加工,可能是促发高水平心理痛苦和痛苦逃避动机的神经基础。此外,MDD-SA 组在delta、beta 以及低频gamma 的绝对能量值上显著大于MDD-NSA 组,这与Benschop[24]等人的研究结果存在矛盾,可能的原因是该研究与本研究关注的对象不同,本研究对象同时包括男性和女性MDD 患者,而非仅聚焦于女性。结合机器学习的结果,提示上述各频段脑电指标在建构自杀分类模型时的重要性值得进一步探讨。从相关分析结果来看,额叶和枕叶delta、前额gamma 频段绝对能量值和相对能量值均与痛苦逃避和当前自杀意念显著正相关,且gamma 与抑郁无显著相关,提示gamma 可能是痛苦逃避与自杀风险共同的神经电生理指标。
本研究尚存在以下不足:第一,本研究中样本量相对较小且线性特征较多,这可能会导致使用支持向量机建构的分类模型过度拟合,未来可进一步扩大样本量,避免过拟合或增加外部验证提高模型的准确性。第二,脑电预处理部分使用ICA 去除伪迹可能会改变固有脑电信号信息,未来可采取从无伪迹的部分选择用于分析的分段,提高脑电信号的稳定性。第三,所采用的临床量表得分均为自我报告,后续研究应考虑纳入他评量表、客观的医疗记录等自杀评估数据,进一步提高模型的分类效能。
