双氢链霉素未知杂质的结构确证与限值设定
2024-03-11赵建强贾欣秒
赵建强 贾欣秒
摘 要:
为了科学制定双氢链霉素产品中未知杂质的限度标准,从分子结构、来源和质量稳定性等3个方面开展研究。首先,采用制备色谱仪从双氢链霉素产品中制得杂质纯品,借助液相色谱-高分辨质谱(LC-HRMS)和核磁共振谱(NMR)进行波谱分析、研究杂质分子结构;其次,采用高效液相色谱法(HPLC),结合双氢链霉素生产过程开展杂质来源考察;最后,设计了多条件的影响因素实验,考证杂质的稳定性。结果表明:杂质分子结构与双氢链霉素的分子结构类似,同属氨基糖苷类物质;杂质来源于双氢链霉素发酵阶段产生的链霉素类似物,类似物在氢化过程被同步还原成为产品中的杂质;杂质对酸、碱、高温、氧化、光照等因素不敏感,具有较好的稳定性。由链霉素发酵代谢产生的相关性杂质稳定性较好,设定其限度标准为≤1.0%(峰面积分数)是安全、合理的,可为临床用药提供重要参考。
关键词:
色谱分析;双氢链霉素;结构确证;杂质限度;临床用药
中图分类号:
R917
文献标识码:A
DOI: 10.7535/hbgykj.2024yx01008
Structure elucidation and limit setting of unknown impurity of dihydrostreptomycin
ZHAO Jianqiang1, JIA Xinmiao2
(1North China Pharmaceutical Huasheng Company Limited, Shijiazhuang, Hebei 0521602, China; 2North China Pharmaceutical Company Limited, Shijiazhuang, Hebei 050015, China)
[HQK]Abstract:
In order to scientifically establish the limit standard of unknown impurity in dihydrostreptomycin products, the study was conducted from three aspects: molecular structure, source and quality stability. Firstly,preparative chromatography was used to prepare pure impurity from dihydrostreptomycin, and LC-HRMS and NMR techniques were used for chromatographic analysis to study the molecular structure of impurities. Secondly, the impurity source was investigated by HPLC method combined with the dihydrostreptomycin production process. Finally, experiments of various influencing factors were designed to verify the quality stability of the impurity. The results show that the molecular structure of the impurity was similar to that of dihydrostreptomycin and belonged to aminoglycoside. The impurity was derived from the streptomycin analogue produced in the fermentation stage of dihydrostreptomycin, which becomes the unknown impurity of dihydrostreptomycin product through hydrogenation reduction. The impurity is not sensitive to acid, alkali, high temperature, oxidation, light and other factors, and has good stability. The related impurity produced by streptomycin fermentation metabolism has good stability, and it is safe and reasonable to set the limit standard that the peak area fraction is less than or equal to 1.0%, which provides important reference value for clinical medication.
Keywords:
chromatography analysis; dihydrostreptomycin; structure elucidation; limit of impurity; clinical medication
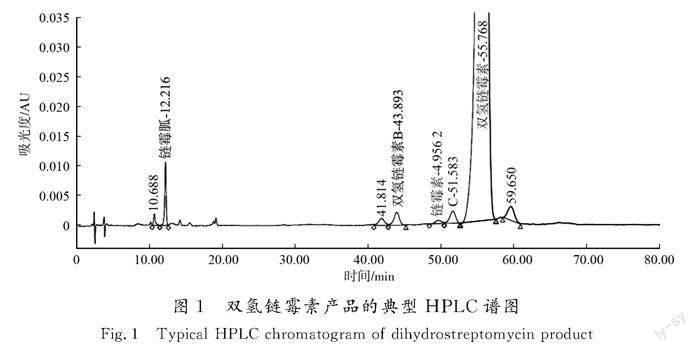
雙氢链霉素属于氨基糖苷类抗生素,对结核杆菌和多种革兰氏阴性杆菌有抗菌作用,在全球范围内广泛用于治疗家畜细菌性疾病。双氢链霉素是链霉素经过氢化得到的衍生物,而链霉素又是由传统微生物发酵法生产获得,即在特定的发酵培养条件下,链霉素生产菌株通过次级代谢合成链霉素,此代谢过程会同步合成少量与链霉素结构近似的杂质,杂质与链霉素结构相似度越高,越难于去除,因此链霉素发酵液虽经过多个工序提取纯化,但仍有少量杂质残留于产品中。华北制药华胜有限公司提供的双氢链霉素样品,经高效液相色谱法(HPLC)检测发现主峰后有一未知杂质,其残留水平约为0.6%(峰面积分数,下同),HPLC谱图见图1。
2013年6月,欧盟EMA发布了《制订抗生素有关物质标准的指导原则》[1](以下简称欧盟EMA抗生素杂质指南)。该指南在国际上首次阐述了抗生素类药品杂质控制策略和要求:针对发酵类兽用抗生素,应对超过0.5%的未知杂质开展结构确证研究,并结合杂质分子结构信息制定合理的限度标准。
欧洲药典中,已收载的双氢链霉素已知杂质包括链霉胍、双氢链霉素B、杂质C等,其他未知杂质尚未载明分子结构及限度标准[2]。近年来,国内外对双氢链霉素未知杂质多有研究,诸多学者借助现代色谱技术对多种药品开展了杂质研究[3-13],并提出了控制思路与策略,但未见对该杂质的研究和报道。用药安全性是评价药品的首要指标,而未知杂质又是影响用药安全性的关键因素,这已成为当前药品上市前审评和药政监管的共识。为了科学制定杂质限度标准,须对其开展系统的质量研究,彻底明晰杂质的分子结构、来源途径和质量稳定性等情况,以便医生临床用药时参考。本研究借助LC-HRMS、NMR等波谱技术,分析确证该杂质的分子结构,采用HPLC考察其来源,并设计多种影响因素实验来评价它的质量稳定性。
1 材料和仪器
1.1 样品与试剂
双氢链霉素产品及各步中间体样品,由华北制药华胜有限公司提供;乙腈、甲醇、三氟乙酸、辛烷硫酸钠,均为色谱纯试剂,由赛默飞世尔科技公司提供;磷酸二氢钾、磷酸、无水硫酸钠,均为分析纯试剂,由天津永大化学试剂有限公司提供。
1.2 仪器设备
制备色谱仪NU300-NP7000,由江苏汉邦科技有限公司提供;Thermo Vanquish-Q Exactive液相色谱质谱联用仪,由赛默飞世尔科技公司提供;Agilent 400 MR 超导脉冲傅里叶变换核磁共振波谱仪,由安捷伦科技有限公司提供;Waters 2695高效液相色谱仪,由沃特世科技(上海)有限公司提供;分析天平AG285、酸度计SevenEasy,由梅特勒-托利多科技(中国)有限公司提供。
2 方法和结果
2.1 杂质的制备与结构确证
2.1.1 杂质的制备
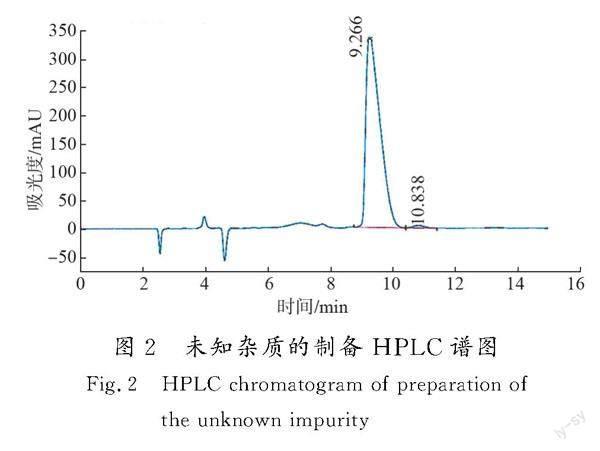
取双氢链霉素适量,加水配制成质量浓度约为50 mg/mL的水溶液,用0.45 μm滤膜过滤,后采用制备色谱仪NU300-NP7000分离制备。色谱条件:色谱柱为Unisil 10-120 PFP(50 mm×250 mm,10 μm);流动相为0.2%(体积分数)三氟乙酸水溶液;流速为100 mL/min;柱温为常温;检验波长为205 nm;进样体积为2 mL;运行时间为15 min。目标峰保留时间约为10.8 min(色谱分析结果见图2),按照出峰时间收集杂质组分,冻干即得到峰面积分数(纯度)为93.6%的杂质品。
2.1.2 液相色谱-高分辨质谱(LC-HRMS)分析
将“2.1.1”项所得的杂质品采用电喷雾电离(ESI)进行质谱分析,在正离子模式下进行一级质谱全扫描,获得谱图数据如图3所示。
通过LC-HRMS测试,获得杂质游离态准分子离子峰[M+H]+的m/z为598.302 73,高分辨质谱计算其分子式为C22H43N7O12;[M+H]+的m/z为598.302 73,通过ddMS2模式进行二级质谱分析,得到的主要碎片离子m/z为263.145 29、190.106 78等,推測其裂解途径见图4。
2.1.3 核磁共振谱(NMR)分析
对杂质品进行一维和二维NMR测试,获得的1H-NMR谱中共给出了27组氢信号,无活泼氢;13C-NMR谱中共给出了22组碳信号,代表22个碳原子,将碳氢数据进行归属,结果见表1。
2.2 杂质来源与影响因素
2.2.1 HPLC色谱条件
色谱柱为Hypersil GOLD(4.6 mm×250 mm,5 μm);流动相为磷酸盐缓冲液,其制备方法:称取无水硫酸钠4.6 g、辛烷磺酸钠1.5 g,用848 mL水溶解,加入色谱纯乙腈102 mL、质量浓度27.2 g/L的磷酸二氢钾溶液50 mL,混合均匀后备用;流速为1.0 mL/min;柱温为45 ℃;进样体积为20 μL;检测波长为205 nm;运行时间为80 min。
2.2.2 杂质流程考察
以链霉素发酵液为起始点,经预处理得到中间体1,再经树脂提取、提纯分别得到中间体2和中间体3,链霉素被氢化还原为双氢链霉素得到中间体4,再经精制得到中间体5,最后干燥得到产品。用HPLC检测发酵液、5种中间体和成品,所得数据绘制未知杂质来源与变化趋势图,见图5。
2.3 影响因素实验
取适量双氢链霉素样品3份:1份溶于5 mL、0.5 mol/L的盐酸溶液,放置30 min;1份溶于5 mL、0.5 mol/L的氢氧化钠溶液,放置30 min;1份溶于5 mL水中,加入2.0 mL、60%(质量分数)的双氧水,放置30 min;分别考察杂质在酸、碱和氧化条件下的稳定性。另取2份双氢链霉素样品:1份置于光照箱内,照度为(4 500±500)lx,放置10 d;另1份置于密封容器中,恒温60 ℃,放置10 d;分别考察杂质对高温和光照的稳定性。待实验结束,样品经HPLC检测,其数据汇总于表2。
3 讨 论
3.1 未知杂质的分子结构
通过LC-HRMS测试,获得未知杂质游离态准分子离子峰[M+H]+的m/z为598.302 73,高分辨质谱计算其分子式为C22H43N7O12;通过一维和二维NMR测试,对1H-1HCOSY、HSQC、HMBC核磁数据进行综合分析,结合降解机理推断出杂质的分子结构,见图6。
从杂质的分子结构可知,它同属于氨基糖苷类,双氢链霉素分子结构中含有N-甲基-L-葡萄糖胺,而杂质分子结构中含有N,N-二甲基-L-葡萄糖胺,即N位上一个氢基被甲基取代,可以推断该杂质是一种工艺杂质,非降解杂质。
3.2 杂质的来源
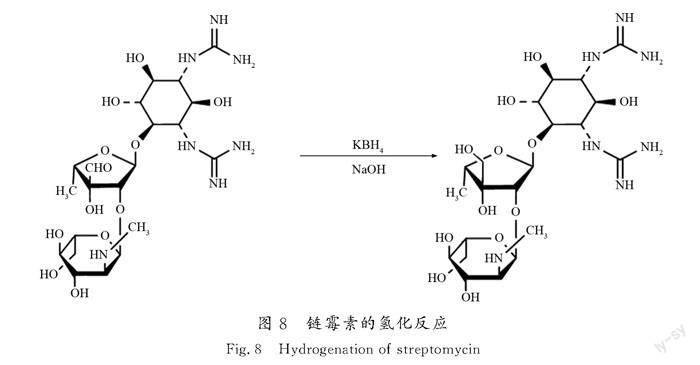
杂质在生产过程的变化趋势表明,杂质在发酵液中含量最高,之后逐步减少,可见该杂质来源于微生物发酵阶段,是与主组分链霉素具有近似结构微生物的代谢物。链霉素的生物合成机制已经很清晰[14-15],其分子结构由链霉胍、链霉糖和N-甲基-L-葡萄糖胺3个部分组成。在N-甲基-L-葡萄糖胺的生物合成过程中,首先L-葡萄糖胺在S-腺甘酰甲硫氨酸条件下发生甲基化反应,生成N-甲基-L-葡萄糖胺,该反应进一步甲基化,可生成副产物N,N-二甲基-L-葡萄糖胺,副产物进一步与链霉胍、链霉糖结合可得到一种特定杂质,其分子结构如图7所示。
该特定杂质与双氢链霉素未知杂质相比,可发现:特定杂质分子结构中的链霉糖上有一个醛基,而双氢链霉素未知杂质的分子结构中是一个羟基。由此可推断,链霉素氢化成双氢链霉素时(化学反应式见图8),该特定杂质分子结构上的醛基同步被氢化还原为羟基,生成双氢链霉素产品中的杂质。
3.3 杂质的稳定性
通过影响因素实验研究发现,杂质在60 ℃高温条件下长时间放置,含量略有降低,比原样降低了0.04个百分点;在酸、碱、氧化等其他条件下,杂质含量基本无变化。主组分双氢链霉素在酸、碱和氧化条件下,与杂质相比其含量呈现出一定的降低趋势,这也佐证了该杂质属于工艺杂质,而非降解杂质,这与杂质在生产过程中的变化趋势一致。另外,从杂质分子结构看,N-甲基-L-葡萄糖胺N位上的氢基被甲基取代后,形成的二甲基结构是稳定的,对酸、碱和氧化等条件具有更强的耐受性。
3.4 杂质的限度设定
经结构确证可知,杂质是与主体化合物双氢链霉素结构相关的杂质,即双氢链霉素的一个氢原子被甲基取代。从分子结构看,杂质无基因毒性警示结构,不存在基因毒性风险[16-17]。考虑到产品中杂质的实际残留水平未超出药典规定的其他已知杂质≤1.0%的限度标准,又鉴于杂质分子结构已明确、无基因毒性且化学性质稳定,可设定其限度标准为≤1.0%,这既能保证用药的安全性,又能满足欧盟EMA抗生素杂质指南的控制要求。
4 结 语
本文借助HPLC、LC-HRMS和NMR等波谱技术,研究获得了双氢链霉素产品中超标杂质的分子结构、来源和影响因素等信息,为制定杂质限度标准提供了客观依据。
从分子结构确证结果看,杂质与双氢链霉素同属于氨基糖苷类,没有基因毒性警示结构及用药风险。杂质来源考察证实,链霉素微生物发酵阶段产生一种链霉素类似物,类似物经氢化得到产品中的杂质,属于典型的工艺杂质。在影响因素实验条件下,杂质含量基本无变化,具有较好的稳定性,在药品贮存或临床用药时,不易受外部因素影响而降解。基于此,可将该杂质作为一个已知杂质来控制,其限度标准设定为≤1.0%。
未来还需进一步研究链霉素发酵工艺,改善微生物代谢过程,从源头上减少杂质的生成,不断提高双氢链霉素产品的纯度。
参考文献/References:
[1] Committee for Medicinal Products for Human Use,Committee for Medicinal Products for Veterinary Use.Guideline on setting specifications for related impurities in antibiotics[EB/OL].(2012-06-30)[2022-10-12].https://www.ema.europa.eu/en/documents/scientific-guideline/adopted-guideline-setting-specifications-related-impurities-antibiotics_en.pdf.
[2] European Directorate for the Quality of Medicines & HealthCare.European Pharmacopoeia 10.5[M]. Strasbourg:EDQM,2021.
[3] 韓志云.抗生素药物质量分析方法研究进展[J].北方药学,2020,17(9):192-194.
[4] 陈航,邓丽明.核磁共振和液相色谱-质谱对氯唑沙宗未知杂质的结构分析及其检查方法研究[J].药物分析杂志,2021,41(12):2132-2142.
CHEN Hang,DENG Liming.Determination and structural analysis of unknown impurities in chlorzoxazone by NMR spectroscopy and liquid chromatography-mass spectrometry[J].Chinese Journal of Pharmaceutical Analysis,2021,41(12):2132-2142.
[5] 孟君,林顺权,蒲含林,等.头孢唑肟钠有关物质的研究[J].中国抗生素杂志,2022,47(7):682-690.
MENG Jun,LIN Shunquan,PU Hanlin,et al.Study on relatedsubstances in ceftizoxime sodium[J].Chinese Journal of Antibiotics,2022,47(7):682-690.
[6] 米旭蕾,王可,李志伟.UPLC-MS/MS法测定土壤中氯霉素类抗生素及其代谢物[J].河北科技大学学报,2023,44(2):177-185.
MI Xulei,WANG Ke,LI Zhiwei.Determination of chloramphenicol antibiotics and their metabolite in soil by UPLC-MS/MS[J].Journal of Hebei University of Science and Technology,2023,44(2):177-185.
[7] 王晓蕾,袁浩,王常顺,等.GC-MS/MS法测定金牛眼药、拨云散眼药、 特灵眼药中麝香酮的含量[J].河北工业科技,2019,36(5):357-361.
WANG Xiaolei,YUAN Hao,WANG Changshun,et al.Determination of muscone in Jinniu eye medicine, Boyunsan eye medicine and Teling eye medicine by using GC-MS/MS[J].Hebei Journal of Industrial Science and Technology,2019,36(5):357-361.
[8] 唐英武,吴世刚,付明.替格瑞洛降解杂质EP-A制备和结构确证[J].精细化工中间体,2022,52(4):38-40.
TANG Yingwu,WU Shigang,FU Ming.Detection and preparation method of impurity EP-A from the degradation of ticagrelor[J].Fine Chemical Intermediates,2022,52(4):38-40.
[9] 温学美,潘红娟,李悦,等.醋酸兰瑞肽强制降解杂质的质谱结构解析及降解机制研究[J].中国医药工业杂志,2022,53(5):703-712.
WEN Xuemei,PAN Hongjuan,LI Yue,et al.Mass spectrometry analysis and forced degradation mechanism of degradation impurities of lanreotide acetate[J].Chinese Journal of Pharmaceuticals,2022,53(5):703-712.
[10]袁耀佐,张玫,金少鴻.氨基糖苷类抗生素质量控制进展[J].中国抗生素杂志,2019,44(11):1244-1255.
YUAN Yaozuo,ZHANG Mei,JIN Shaohong.Progress on qulity control of aminoglycosides antibiotics[J].Chinese Journal of Antibiotics,2019,44(11):1244-1255.
[11]袁耀佐,张玫,胡昌勤.氨基糖苷类抗生素组分控制进展[J].中国药学杂志,2017,52(20):1772-1779.
YUAN Yaozuo,ZHANG Mei,HU Changqin.Advances in the components analysis of aminoglycosides[J].Chinese Pharmaceutical Journal,2017,52(20):1772-1779.
[12]刘真真,齐沛沛,何付香,等.液相色谱-串联质谱法测定葡萄中链霉素和双氢链霉素[J].色谱,2020,38(12):1396-1401.
LIU Zhenzhen,QI Peipei,HE Fuxiang,et al.Determination of streptomycin and dihydrostreptomycin in grapes by liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2020,38(12):1396-1401.
[13]产希康,庄英萍,陈燕平.提高硫酸双氢链霉素产品质量的研究[J].上海食品药品监管情报研究,2006(3):30-34.
[14]王以光,王勇.抗生素生物技术[M].2版.北京:化学工业出版社,2019:246-260.
[15]杨生玉,王刚,沈永红.微生物生理学[M].北京:化学工业出版社,2007:206-226.
[16](荷)简威廉范德兰,(美)约瑟夫J.德乔治.国际药品安全性评价策略:ICH指导原则解读[M]. 陈龙,王克林,李英骥,主译.沈阳:辽宁科学技术出版社,2018:199-203.
[17]BENIGNI R,BOSSA C.Mechanisms of chemical carcinogenicity and mutagenicity: A review with implications for predictive toxicology[J].Chemical Reviews,2011,111(4):2507-2536.
收稿日期:2023-09-08;修回日期:2023-12-06;责任编辑:王海云
第一作者简介:
赵建强(1976—),男,河北蠡县人,高级工程师,主要从事抗生素质量控制与管理方面的研究。
通信作者:
贾欣秒高级工程师。E-mail:3265804@qq.com
赵建强,贾欣秒.
双氢链霉素未知杂质的结构确证与限值设定
[J].河北工业科技,2024,41(1):63-68.
ZHAO Jianqiang,JIA Xinmiao.
Structure elucidation and limit setting of unknown impurity of dihydrostreptomycin
[J]. Hebei Journal of Industrial Science and Technology,2024,41(1):63-68.
