导电剂和粘结剂对高镍正极性能影响分析
2024-03-10黄光瑜常海涛
黄光瑜,常海涛,任 宁,路 密
(1.厦门理工学院材料科学与工程学院,福建厦门 361024;2.福建省高效能电池重点实验室,福建南平 353000;3.浙江超威创元实业有限公司,浙江湖州313100)
电动汽车的轻量化是一直追求的目标,而不断提高动力电池的能量密度是实现这一目标的重要途径。动力电池正极材料已经由LiFePO4为主到LiFePO4与三元材料并重,且三元正极材料由于贵金属钴含量相对较低、比容量更高等优点,已经成为研究开发的重点。所谓高镍三元材料主要指LiNixCoyMnzO2(x+y+z=1,NCM)材料中x≥0.8,也包括LiNixCoyAlzO2(NCA)和无钴体系。但是,随着镍含量的增加,由于Ni2+(0.069 nm)与Li+(0.076 nm)的离子半径十分接近,当大量Li+在充电时脱出后,过渡金属层中的Ni2+就会进入锂层占据锂空位,使得脱出的锂在放电时不能全部回到正极。此外,锂层中的Ni2+会逐渐朝颗粒表面移动,并且形成NiO非活性相,使得材料稳定性降低[1-2]。
一般来讲,层状正极材料的充放电比容量会随充电电压的提高而增加,但是充电电压的提高通常会导致正极材料结构更快地破坏、循环性能衰减加快,并会引发严重的安全问题。通过掺杂和包覆等技术手段,LiCoO2不断将电池充电电压从4.2 V 提高到目前的4.45 V,并有望提高到4.6 V。这使得在材料体系不变的情况下,可以将材料的能量密度提升61%[3]。因此,探讨高电压下高镍电极的性能衰减机理,探寻提升电极充电电压的方法,对未来高能量密度动力电池的开发具有重要意义。
正极是由活性物质、导电剂和粘结剂组成的多孔电极,活性物质-导电剂-粘结剂组成了电极中最小的反应单元。通常认为,导电剂的存在可以增加颗粒之间的电子迁移,减少极化,而粘结剂则会阻碍锂离子向活性物质中的嵌入,导致极化增加。但是,有的研究也表明,由于电子的传导不平衡引起的正极内反应的不均匀性,活性物质颗粒的裂解以及活性物质颗粒与粘结剂区域之间的接触损失,导致了电池循环性能衰减[4]。因此,本文以NCM811为活性物质,通过调整导电剂和粘结剂的含量以及充电电压,探讨活性物质的性能衰减的影响因素及可能的机理。
1 实验
1.1 扣式电池制备
本文所使用的NCM811 正极材料由厦门钨业股份有限公司提供。扣式半电池的制备过程为:将NCM811 与导电剂Super P、粘结剂聚偏二氟乙烯(PVDF)按 照NCM811、Super P 与PVDF 的 质 量 比8∶1∶1、7∶2∶1 或7.5∶1∶1.5 混合,通过玛瑙研钵搅拌均匀后涂覆在铝箔上,样品编号分别为A、B、C;在110 ℃真空干燥箱(升温速率为3 ℃/min)中干燥12 h;使用手动切片机将其冲切成ϕ12 mm 的圆形极片;称重并转移到充满氩气的手套箱内组装CR2025 扣式电池用于测试,在该体系中,金属锂为对电极和参比电极,电解液为1 mol/L LiPF6/(EC+DMC+EMC)(体积比1∶1∶1)。
1.2 电化学测试
1.2.1 充放电测试
在室温下扣式电池的充放电测试电位区间为2.7~4.3 V (1C=180 mA/g,LAND CT-2001A)或2.7~4.7 V(1C=2 009 mA/g)。充放电模式采用恒流充电-恒压充电-恒流放电,即在1C的电流密度下将电池充电到充电截止电压,随后恒压充电至电流降为0.1C,搁置10 min 后,以1C电流密度放电至放电截止电压,以此充放电制度进行循环测试。
1.2.2 电化学交流阻抗谱测试
首次充电及循环后充电态的样品电池的电化学交流阻抗谱(EIS,CHI660e,上海辰华)测试的频率范围为100 kHz~0.1 mHz。
1.3 表面分析
将循环后的电池拆解后用碳酸二甲酯(DMC)反复冲洗以去除极片表面残留的痕量电解液组分。
用扫描电镜(Carl Zeiss AG)以及透射电子显微镜(ZEISS EV018)对电极形貌进行分析;用X 射线光电子能谱(PHI quantum-2000)对电极表面成分进行分析。
2 结果与讨论
2.1 4.3 V 截止电压电极电化学性能分析
电池首次充放电曲线及循环容量和库仑效率如图1 所示。从图1(a)中可以看出,B 电池的放电比容量最高(186 mAh/g),C 电池的次之(184.2 mAh/g),而A 电池的最低(181.8 mAh/g)。表明导电剂含量的增加能有效改善活性物质的电化学反应动力学特征,虽然粘结剂会阻碍离子和电子传递,但同时也增加了活性物质与导电剂的接触,所以样品C 电池的首次放电比容量略高于A 电池。而100 次循环测试结果表明,材料放电比容量的容量保持率(三个样品电池分别为91.89%、93.24%、88.9%)也遵循该规律。因为扣式电池中以金属锂为对电极和参比电极,所以其含量相对于正极中锂含量而言过量非常大,而容量保持率差距较小,并不能得出导电剂和粘结剂对电池循环性能影响的结论。为了进一步分析样品电池的循环稳定性,将三个样品电池100 次循环的充电和放电比容量的差值求和获得不可逆比容量之和[图1(b)的内嵌图],从图可以看出三个样品电池的不可逆比容量之和,三个样品电池分别为135.2、122.7、184.2 mAh/g,差距明显较放电比容量和容量保持率的大,更能反应出电极在循环过程中的循环稳定性。图1(c)为100 次循环后电极的阻抗图,其中电荷传递阻抗Rct(第二个半圆直径)的大小与容量损失之和存在正相关,这说明了容量的损失可能与Rct阻抗的变化有关。

图1 样品电池首次充放电曲线、循环性能图(内嵌图为100次循环不可逆比容量之和)与100次循环后的EIS图
图2 为电极100 次循环后的扫描电子显微镜法(SEM)图像,可以看出NCM811 是由许多一次颗粒组成的球形二次颗粒,粒径约为8~12 μm,三种电极均没有出现明显裂纹现象,表面形貌相对完整。结合图1(b)中的内嵌图以及图1(c)的阻抗图可以说明,在4.3 V 充电截止电压条件下,导电剂的增加不仅因为其增加了颗粒之间的电接触,还因为导电剂的高比表面特性,有可能使得电极的孔隙率增加,从而导致活性物质颗粒表面的锂离子极化减小,进而使得活性物质颗粒表面的反应更均匀,导致循环过程中的不可逆容量下降,循环稳定性得以改善。而粘结剂本身的离子和电池导电性差,其含量增加也会使得颗粒表面的电化学反应不均匀,进而导致不可逆容量增加。

图2 样品A电极(a)、样品B电极(b)以及样品C电极(c)在4.3 V截止电压下100次循环之后的SEM图像
2.2 4.7 V 截止电压电极电化学性能分析
图3 是充电截止电压为4.7 V 时不同组分电池的电化学性能图。就放电比容量而言,从图3(a)中可以看出,三个样品电池放电比容量的大小顺序依次为B 电池>C 电池>A 电池,与图1 显示规律略不同。而图3(b)显示的60 次循环后三个样品电池的容量保持率分别为79.6%、90.2%和93.4%,容量保持率表明粘结剂含量高的C 电池在高充电截止电压时循环稳定性最好,导电剂含量高的次之。而进一步对60 次循环的不可逆比容量之和进行对比也发现,C 电池不可逆比容量之和最低,仅为122.1 mAh/g。导电性差的粘结剂在4.3 V 截止充电电压下其含量的增加会使得电极Rct阻抗增大,而在4.7 V 截止电压下C 电池电极的Rct反而最低,如图3(c)所示,这可能是在高截止电压下,活性物质结构的变化成为了电极性能衰减的主要影响因素。

图3 充电截止电压为4.7 V时不同组分电池的电化学性能图
2.3 4.7 V 截止电压电极物性分析
4.7 V 截止电压下充放电循环后的电极的SEM图如图4 所示。电极表面非常致密,这是高电压下电极与电解液反应形成的电化学界面(CEI)膜,这会导致电极内的电解液浸润性降低和颗粒之间电接触的减少,从而导致图3(c)所示的阻抗增加。A 电极的粉化最为明显,B 电极次之,C 的最轻,而裂纹和粉化是导致高镍电极性能衰减最主要的原因,这一结果与图3 显示的循环数据相吻合。结合图3(c)循环后电池阻抗的变化,可以得出结论:适当添加粘结剂能提高颗粒结构稳定性,抑制裂纹的产生。一般而言,高电压下锂离子的脱嵌量较大,会导致内部应力的分布更加不均,从而增加颗粒出现裂纹甚至粉化的风险。Wang 等[4]仔细分析了NCM811 在4.3、4.7 和4.9 V 截止电压下的结构演化规律,证实了颗粒表面阳离子混排都是会发生的,只是严重程度随截止电压的增加而增加。更进一步发现,4.3 和4.7 V 截止电压时,NCM811 结构的演化规律为层状结构-无序层状-缺陷岩盐-岩盐相,但4.9 V 截止电压时不仅会观察到更多的缺陷,而且晶体结构直接从层状结构演变为岩盐相并伴随严重的晶间裂纹,从而导致电极性能的快速衰减。

图4 样品A 电极(a)、样品B 电极(b)以及样品C 电极(c)在4.7 V截止电压下60次循环之后的SEM图像
图5 是60 次循环后样品电极的X 射线光电子光谱法(XPS)图谱,经过拟合后,三个样品电极的Ni2+含量分别为63.76%、53.6%以及54.09%,这表明三个样品电极的活性物质都发生了不同程度的Li+/Ni2+混排现象,从而导致了电化学反应不均匀现象的出现,并最终导致了活性物质出现裂纹甚至粉化的现象,使得电极的循环性能出现明显的衰减。
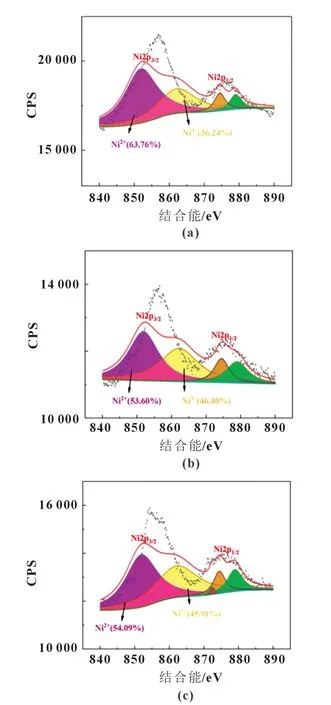
图5 60次循环后样品A电极(a)、样品B电极(b)以及样品C电极(c)中Ni元素的XPS谱
如图6 所示,进一步对循环后的电极活性物质的透射电子显微镜法(TEM)分析表明,三种电极活性物质的相变程度明显不同,A 电极表面的大部分层状结构都已经转变成岩盐相,其厚度为10.6~25.4 nm,而B、C 电极的岩盐相厚度则为2.5~8.3 nm 和2.1~6 nm,其相变程度要远小于A 电极。

图6 循环后的样品A电极(a)、样品B电极(b)以及样品C电极(c)的TEM图像以及选定区域的傅里叶变换图像
一般认为,在高电压下,颗粒周围因为电化学反应不均匀导致应力分布不均,再加上各向异性特点,容易形成大量的晶间裂纹,导致电解液渗透到裂纹中,使得高活性的Ni4+与氧发生反应生成NiO 岩盐相,阻碍了Li+的扩散途径,从而导致阻抗增大。而B、C 电极的岩盐相要明显小于A 电极,这是因为适当地增加导电剂和粘结剂能够有效促进导电剂和活性物质之间的电接触,使电化学反应更加均匀,从而抑制了晶间裂纹的产生以及岩盐相的形成。这说明,导电剂和粘结剂在电极材料循环过程中的作用是改善导电性较差的活性物质的电子电导率以及将活性物质和导电碳颗粒连接在一起,促进了导电剂和活性物质之间的电接触,使电化学反应更加均匀,从而抑制了晶间裂纹的产生以及岩盐相的形成。
然而,因为活性物质、导电剂和粘结剂构成了电极中电化学反应的最小单元,是电化学反应的场所,该单元的组成结构决定了锂离子迁移和电子转移的动力学特征,而由于活性物质颗粒不同晶面嵌入脱出的动力学性质不一样,由粉体材料粘结而成的多孔电极特征进一步使得活性物质颗粒表面的动力学复杂化,在高充电截止电压时其特征更为明显。电极中电化学反应的不均匀特征导致的电池性能衰减现象最近也引起了研究者的关注,如Zhang 等[5]以NCM811 为研究对象,结合二维和三维成像方法,并结合四维(空间+时间)计算建模分析,认为在厚电极中,由于电子传导的不均衡而引起电极反应的不均匀,导致颗粒的粉化裂解增加,导致活性物质颗粒与导电碳之间的电接触损失是材料性能衰减的主要原因。而本文的研究也证实了这一结论:导电剂增加有利于改善活性物质颗粒表面发生电化学反应时电子交换和传导的均一性,而粘结剂的增加则可以保证循环过程中活性物质与导电碳之间电接触。
从上述分析可以看出,虽然导电剂和粘结剂的增加可以提高NCM811 在高充电截止电压条件下的循环稳定性,但是导电剂和粘结剂本身都是非活性物质,且导电剂的密度小、比表面积大,其增加会降低电池的体积比能量,而粘结剂含量的增加会增加电池的初始阻抗,有可能会降低电池的倍率性能和低温性能。但是从本质上来讲,上述结论证实了改善由活性物质、导电剂和粘结剂构成的电化学微区反应的环境,可以改善离子和电子迁移的动力学特征,进而改善高镍正极材料的循环稳定性。一般而言,掺杂和表面包覆是对正极活性物质改性的两种最常用手段,如Wang 等[6]采用包覆La4NiLiO8、褚曼曼等[7]包覆氟化物和硼酸、方苏捷等[8]采用的铝和锰共掺杂,都使得高镍正极材料的循环稳定性得到明显的提升。再辅之以新型电解液或者添加剂等[9]手段,改善CEI 的性质,可以使高电压下高镍材料的使用成为可能。
3 结论
本文通过加入不同比例的导电剂和粘结剂研究了NCM811 在4.3 和4.7 V 充电截止电压下的电化学性能。结果表明,导电剂和粘结剂的增加可以有效提升高镍正极材料在高电压下的循环稳定性,60 次循环后的容量保持率分别为90.2%和93.4%(对比样为79.6%),进一步通过SEM、XPS 和TEM 分析发现粘结剂含量的增加可以延缓高镍材料在高充电截止电压下的结构演化和界面层的生成,防止活性物质颗粒之间失去电接触,从而提升其循环稳定性。本文研究结果初步证实了活性物质、导电剂和粘结剂组成的微区,其构成决定了离子和电子交换的动力学特征,可以影响到活性物质内部的结构演化及界面生成。
