桑葚中性多糖结构及其对D-半乳糖致衰老小鼠的抗氧化作用
2024-03-10刘富饶郭子萌焦丽丽
刘富饶,郭子萌,任 婷,李 波,吴 巍,李 慧,焦丽丽*
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117; 2.长春中医药大学药学院,吉林 长春 130117)
氧化应激是机体受到不良刺激时,产生的过量自由基超出细胞抗氧化防御能力,造成机体氧化与抗氧化作用失衡的现象。持续的氧化应激可导致脂质过氧化、蛋白质和DNA 损伤,引发衰老和肝损伤[1]。D-半乳糖诱导可加速活性氧(ROS) 的产生并使细胞产生氧化损伤,从而导致机体衰老[2],为研究衰老的经典模型。
张培丽等[3]发现,桑葚多糖对H2O2诱导的PC-12 细胞氧化损伤具有保护作用。桑葚多糖可以改善细胞脂质积累、内源性抗氧化性防御能力从而起到抗氧化减缓衰老的作用[4]。已有研究证明了桑葚多糖的抗氧化活性,但其抗衰老的构效关系并未阐明。桑葚中性多糖的分离及其对D-半乳糖诱导小鼠衰老模型的抗氧化作用的研究也未见报道。基于此,本研究进一步分离出桑葚中性多糖,初步检测其一级结构,通过建立D-半乳糖致小鼠衰老模型,探讨桑葚多糖对小鼠肝组织及血清抗氧化指标的影响,以期为进一步开发具有抗氧化能力的桑葚多糖产品和桑葚多糖构效关系提供依据。
1 材料
1.1 仪器 DZKW 型电热恒温水浴锅(天津天泰仪器有限公司); Infinite M200 PRO 型酶标仪(瑞士Tecan 公司);Ultimate 3000 型液相色谱系统、Nicolet5700 型傅里叶变换红外光谱仪(美国Thermo Fisher 公司); Inertsil ODS-3 型色谱柱(北京迪科马科技有限公司); Centrifuge 5810R 型离心机(德国Eppendorf 公司); SCIENTZ-10N 型冷冻干燥机(宁波新芝生物科技股份有限公司)。
1.2 动物 SPF 级昆明小鼠,体质量(20±2) g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号SCXK (辽) 2020-0001,饲养于长春中医药大学实验室,温度(21±2)℃,相对湿度(50±5)%。
1.3 试剂与药物 桑葚购自吉林省中药材商店,经长春中医药大学药学院王淑敏教授鉴定为正品。D(+) -无水葡萄糖 ( 批号 Y19F11J108781)、L-阿拉伯糖 ( 批号Z27O11H128825)、D-半乳糖(批号Z22J9H64187) 对照品均购自上海源叶生物科技有限公司。谷胱甘肽过氧化物酶(GSH-Px,批号20210518)、超氧化物歧化酶(SOD,批号20210518)、丙二醛(MDA,批号20210517)、过氧化氢酶可见光试剂盒(CAT,批号20210517) 均购自南京建成生物工程研究所; BCA 蛋白定量试剂盒(批号20210713) 购自北京索莱宝科技有限公司。无水乙醇为分析纯。
2 方法
2.1 提取与纯化 参考文献[5] 报道,取干燥后的桑葚500 g,加入5 L 蒸馏水,沸水提取3 次,提取时间分别为3、2、2 h,合并提取液,120 目筛过滤,80 ℃水浴浓缩,加入无水乙醇使乙醇终体积分数为80%,室温静置24 h,收集沉淀,蒸馏水复溶后冷冻干燥,得到粗多糖。采用Sevag 法进行脱蛋白,并采用截留分子量3 500 Da 的透析袋进行透析,浓缩透析内液,冻干得到桑葚多糖。
参考文献[6] 报道,将桑葚多糖溶解于蒸馏水中,5 000 r/min 离心5 min,取上清液经DEAE 纤维素进一步分离,用蒸馏水洗脱,苯酚硫酸跟踪检测,Sepharose CL-6B色谱柱(2.6 cm×100 cm) 进一步纯化,用生理盐水洗脱,体积流量0.5 mL/min,每管20 min,苯酚硫酸跟踪检测,收集多糖级分,糖液透析浓缩后冷冻干燥,得到桑葚中性多糖。
2.2 理化性质测定 以D-葡萄糖绘制标准曲线,采用苯酚-硫酸法测定纯度,采用考马斯亮蓝法测定桑葚中性多糖中蛋白质含量。
2.3 分子量测定 采用高效液相色谱法测定桑葚中性多糖的分子量分布[7]。UltiMate 3000 系统,配备示差折光检测器和TSK-G3000 PWXL 色谱柱(7.8 mm×30.0 cm); 流动相超纯水; 体积流量0.5 mL/min; 柱温40 ℃; 进样量20 μL。以分子量5 250、9 750、13 050、36 800、64 650、135 350、300 600 Da 葡聚糖对照品的保留时间和相对分子质量对数绘制标准曲线,求得分子量。
2.4 单糖组成测定 将多糖样品(5 mg/mL,100 μL) 用三氟乙酸(2 mol/L,400 μL) 在水解瓶中120 ℃水解4 h,反复加入甲醇去除过量的三氟乙酸,真空干燥,经苯基-3-甲基-5-吡唑啉酮(PMP) 衍生化后过0.22 μm 微孔水系滤膜。参考文献[8] 报道,色谱条件为Inertsil ODS-3 色谱柱(4.6 mm×150 mm,5 μm); 流动相PBS (pH 7.0) -乙腈(82 ∶18); 体积流量1.0 mL/min; 检测波长245 nm;进样量20 μL。
2.5 傅里叶变换红外光谱测定 将干燥后的桑葚中性多糖与溴化钾粉末按照1 ∶200 比例均匀研磨,取适量压成透明均匀薄片,收集4 000~500 cm-1范围内红外光谱。
2.6 分组与给药 参考文献[9] 报道,60 只小鼠适应性喂养1 周后,随机分为空白组、模型组、阳性组、桑葚中性多糖给药组(10、100、200 mg/kg),空白组小鼠灌胃给予生理盐水(0.1 mL/10 g),阳性组小鼠腹腔注射维生素C,除空白组外其余各组小鼠腹腔注射D-半乳糖(1.35 g/kg) 进行造模,同时给药,连续7 周。
2.7 血清与组织样品制备 末次给药后,小鼠禁食12 h,摘眼球取血后脱颈椎处死,取肝脏、脾脏、脑组织。
2.7.1 血清 小鼠眼球取血后静置30 min,3 500 r/min离心15 min,吸取上清,-80 ℃保存,即得。
2.7.2 10%肝组织匀浆 小鼠肝组织-生理盐水(1 ∶9)在冰浴条件下混合匀浆,匀浆液3 500 r/min 离心15 min,吸取上清,-80 ℃保存,即得。
2.8 SOD、T-AOC、CAT、GSH-Px 活性及MDA 水平检测 严格按照相关试剂盒说明书操作,分别检测各组小鼠血清和肝组织SOD、T-AOC、CAT、GSH-Px 活性及MDA 水平,考察不同剂量桑葚中性多糖在血清和肝组织中对抗氧化作用相关指标的影响。
2.9 统计学分析 通过SPSS 21.0 软件进行处理,数据以(±s) 表示,各组间样品均数比较采用单因素方差分析,组间两两比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 理化性质分析 经水提、醇沉获得桑葚粗多糖,收率为7.23%,经超滤及色谱法进一步分离后获得中性多糖,其收率为19.15%,苯酚硫酸法检测其纯度为76.18%,考马斯亮蓝法检测其含痕量的蛋白(含量<1%)。
3.2 分子量测定 以葡聚糖对照品保留时间为横坐标(X),分子量对数为纵坐标(Y) 绘制标准曲线,得回归方程为Y=-0.355X+9.811 (r=0.995 0)。依据相对保留时间,计算得到中性多糖分子量为1.068×104Da。
3.3 单糖组成测定 经完全酸水解及PMP 衍生检测中性多糖的单糖组成,见图1,可知主要由葡萄糖、半乳糖、阿拉伯糖组成,摩尔比为12.83 ∶1 ∶2.85。另外,中性多糖是以葡萄糖为主的中性杂多糖,其中葡萄糖含量高达76.9%。

图1 桑葚中性多糖的单糖组成PMP-HPLC 色谱图
3.4 红外光谱分析(FT-IR) 由图2 可知,3 404.69 cm-1处较宽吸收峰为中性多糖中-OH 伸缩振动吸收峰;2 922.70 cm-1处为甲基或次甲基的C-H 伸缩振动吸收峰;1 632.35 cm-1处为羟基弯曲振动吸收峰; 在1 740 cm-1附近没有特征吸收峰,说明中性多糖不含糖醛酸[10]; 1 200 ~1 000 cm-1内存在的吸收峰为多糖指纹图谱,证明其为吡喃糖; 804.03、851.23 cm-1处吸收峰则表明中性多糖中同时含有α-糖苷键和β-糖苷键[11]。

图2 桑葚中性多糖红外光谱图
3.5 桑葚中性多糖对D-半乳糖诱导衰老小鼠氧化应激的影响 与空白组比较,模型组小鼠血清和肝组织SOD、GSH-Px、T-AOC、CAT 活性降低(P<0.01),MDA 水平升高(P<0.01); 与模型组比较,阳性组与100、200 mg/kg桑葚中性多糖组小鼠血清及肝组织SOD、GSH-Px、T-AOC、CAT 活性升高(P<0.05,P<0.01),MDA 水平降低(P<0.01),并呈剂量依赖性,见图3 ~4。与模型组比较,200 mg/kg 桑葚中性多糖组小鼠血清中SOD、GSH-Px、T-AOC、CAT 酶活性分别升高49.2%、45.1%、94.5%、63.2%; 肝组织中SOD、GSH-Px、T-AOC、CAT 酶活性分别升高76.1%、54.9%、66.7%、25.8%,MDA 水平降低28.6%,而50 mg/kg 桑葚中性多糖组作用不明显。由此可知,桑葚中性多糖能修复D-半乳糖诱导的抗氧化酶活性降低,并抑制MDA 的产生,进而修复氧化损伤。
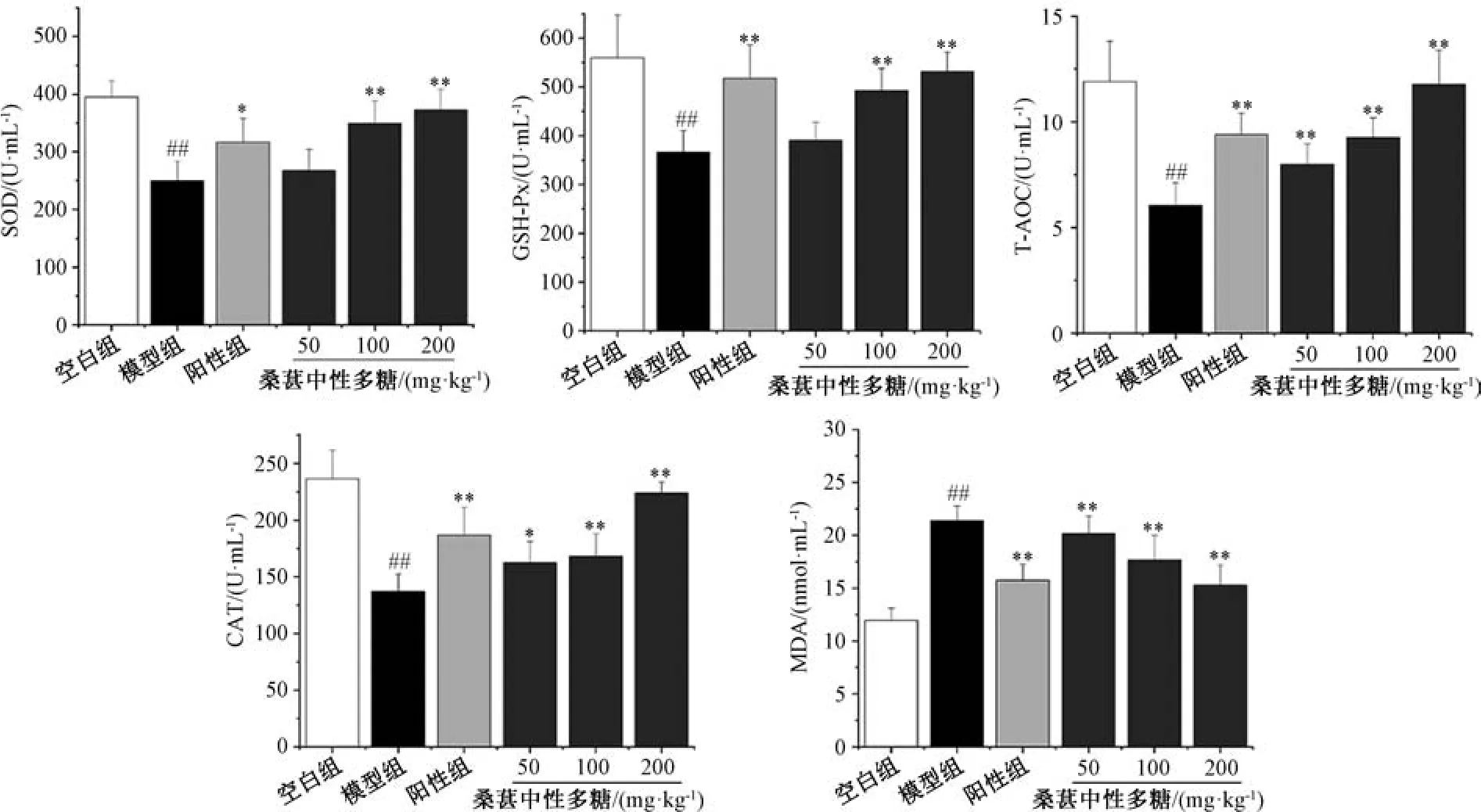
图3 桑葚中性多糖对衰老小鼠血清SOD、GSH-Px、T-AOC、CAT 活性及MDA 水平的影响(±s,n=10)

图4 桑葚中性多糖对衰老小鼠肝组织SOD、GSH-Px、T-AOC、CAT 活性及MDA 水平的影响(±s,n=10)
4 讨论
氧化损伤是指产生的过量自由基和活性氧堆积,超出细胞抗氧化防御能力,造成机体氧化与抗氧化作用失衡的现象,氧化损伤可导致细胞死亡,诱发DNA 损伤、炎症、糖尿病、动脉粥样硬化和神经退行性疾等。抗氧化剂可以清除活性氧并抑制氧化损伤诱导的细胞死亡[12]。人工合成的酚类抗氧化剂如丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)、叔丁基对苯二酚(TBHQ) 在油脂储存中被广泛应用,但其对人体存在一定的副作用[13]。与之相比,天然的抗氧化剂具有无毒、副作用的优势,越来越受到重视。抗氧化作用是多糖重要活性之一,多种植物多糖被证实具有抗氧化作用。
多糖是一类结构复杂的生物大分子,其结构特征如单糖组成、分子量分布、以及糖基排列顺序等均能影响其生物活性。Huang 等[14]研究发现,多糖的抗氧化活性与其单糖的组成和比例关系密切。以往的研究发现酸性多糖具有良好抗氧化活性,其中糖醛酸或蛋白质含量较高的多糖容易贡献氢原子,从而发挥较好的抗氧化活性[15]。张佳琦[16]使用热水提取桑葚多糖,并分利用不同浓度乙醇醇沉获得酸性多糖MFPs-30-80,具有良好的抗氧化活性。但是,Ahmadi 等[17]和Li 等[18]研究也表明,多糖中的阿拉伯糖和半乳糖是抗氧化活性最重要的单位,含有阿拉伯半乳糖聚糖结构域的多糖的抗氧化活力较为显著[19]。而本研究利用沸水提取,80%乙醇醇沉和离子交换柱层析法从桑葚中获得中性杂多糖,其主要由葡萄糖构成,但同时含有约23%阿拉伯糖和半乳糖。利用D-半乳糖诱导的氧化损伤模型研究发现,桑葚中性多糖能够明显修复由D-半乳糖诱导的氧化损伤。
