四氢姜黄素脂质制剂处方优化
2024-03-10凌海燕杨安东赵军宁李小芳
朱 宁,凌海燕,杨安东,赵军宁,李小芳
(1.四川省中医药科学院,四川 成都 610041; 2.成都中医药大学药学院,四川 成都 611137)
四氢姜黄素是姜黄素在体内的主要活性代谢产物,具有与姜黄素类似的药理作用,被认为是体内姜黄素的主要有效形式,是一种极具开发价值的化合物,但低水溶性限制了其活性的发挥。
在现有的提高难溶性药物溶解度的制剂策略中,脂质制剂是改善难溶性药物生物利用度的几种有前景的方法之一[1]。但是由于脂质制剂复杂的体内处置过程,使得目前大部分脂质制剂的处方设计中采用的溶解度、可分散性、乳滴粒径等简单指标[2-3]对生物利用度的影响并不突出[4-7],导致其体外评价结果与体内性能相关性低,成为困扰脂质制剂开发的瓶颈。脂质制剂在口服后,随着分散和消化的进行,药物在消化液中形成过饱和状态[8],可能导致药物迅速沉淀,从而降低吸收。因此,衡量脂质制剂性能的关键指标是制剂在消化后保持药物溶解或过饱和的能力。
大多数药物吸收的主要驱动力是被动扩散,游离药物在胃肠道的浓度越高,吸收驱动力越强。脂质制剂在体外模拟消化条件下药物溶出曲线下面积(AUC) 可反映药物过饱和状态保持的程度和时间,因此能够预示药物吸收的程度[9]。本研究通过D-最优混料设计得到不同处方,参考简化体外消化法[10],以AUC 为考察指标对处方进行了筛选,以期改善现有四氢姜黄素脂质制剂研究缺乏对脂质消化的模拟的现象[11-13]。
1 材料
Zetasizer Nano ZS 纳米粒度电位仪(英国Malvern 公司); ST16R 离心机(美国Thermo Fisher 公司); MIX-25涡旋混合仪(杭州米欧仪器有限公司); XS205 电子天平(瑞士Mettler-Toledo 公司); Agilent 1200 高效液相色谱仪(美国Agilent 公司); HNY-303 恒温水浴摇床(天津欧诺仪器股份有限公司); XP-213 偏振光显微镜(上海天省仪器有限公司); JEM2100 高分辨透射电镜(日本电子株式会社)。
四氢姜黄素原料药(实验室自制,由天然姜黄素催化氢化并纯化所得,纯度≥98%); 四氢姜黄素对照品(美国Sigma 公司,批号BCCB4086,纯度99.3%)。大豆油(浙江田雨山药用油有限公司); 玉米油(江西益普生药业有限公司); 蓖麻油、橄榄油、油酸、油酸乙酯、十二烷基三甲基氯化铵 (分析纯,成都市科龙化工试剂厂);Transcutol HP [二乙二醇单乙基醚,嘉法狮(上海) 贸易有限公司]; 吐温85、吐温80、吐温20、氢氧化钠、无水氯化钙、聚乙二醇400 (分析纯,成都市科隆化学品有限公司); Cremophor EL (聚氧乙烯蓖麻油,南京都莱生物技术有限公司); Cremopher RH40 (聚氧乙烯氢化蓖麻油,德国BASF 公司); Imwitor 742 (辛癸酸单双甘油酯,北京凤礼精求商贸有限责任公司); 模拟禁食人工肠液FaSSIF V2、模拟餐后人工肠液FeSSIF V2 (英国Biorelevant 公司); 猪胰酶(8×USP,上海麦克林生化科技股份有限公司,批号C10234345); 4-溴苯硼酸(上海源叶生物科技有限公司,纯度98%,批号S06A6K2217)。盐酸(分析纯,成都金山化学试剂有限公司); 乙腈(色谱纯,美国Fisher 公司);氨水 (分析纯,成都长联化工试剂有限公司,含量25% ~28%)。
2 方法与结果
2.1 色谱条件 Agilent ZORBAX Extend-C18色谱柱(150 mm×4.6 mm,5 μm); 流动相乙腈-0.05% 氨水(含10 mmol/L 十二烷基三甲基氯化铵) (38 ∶62); 体积流量1.0 mL/min; 柱温25 ℃; 检测波长288 nm; 进样量10 μL。
2.2 溶解度测定 采用振摇法测定四氢姜黄素在油、表面活性剂、助表面活性剂中的饱和溶解度。取过量四氢姜黄素分别加入装有各辅料的离心管中,25 ℃、120 r/min 振摇48 h,8 000 r/min 离心10 min,精密称取上清液0.2 g,用无水乙醇稀释,作为供试品溶液,在“2.1” 项下色谱条件下进样测定,结果见表1。

表1 四氢姜黄素在不同辅料中的平衡溶解度
由此可知,四氢姜黄素在长链油脂中溶解度普遍较低,但在蓖麻油中溶解度较高,为46.3 mg/g; 在中链油脂中MCT、Imwitor 742 溶解度约为12~15 mg/g; 在表面活性剂中吐温80 溶解度最高,超过200 mg/g; 在助表面活性剂中Transcutol HP 对四氢姜黄素的溶解度达381 mg/g,远超其他助表面活性剂。
2.3 处方的初步筛选
2.3.1 四氢姜黄素在处方中的溶解度 参考脂质制剂分类系统的典型处方[14],并结合四氢姜黄素在辅料中的溶解度对部分辅料进行了适当调整,得到9 个空白脂质处方,见表2。按处方中各成分的比例取辅料混合均匀,制备空白处方,将过量四氢姜黄素加入装有空白处方的离心管中,25 ℃、120 r/min 振摇48 h。按“2.1” 项下色谱条件测定四氢姜黄素在各处方中的平衡溶解度。

表2 四氢姜黄素在不同类型脂质处方中的平衡溶解度及分散后的乳滴粒径(n=3)
由此可知,四氢姜黄素在各处方中的溶解度与油脂比例呈负相关关系,ⅢB、Ⅳ型处方中的溶解度比Ⅰ、Ⅱ、ⅢA 型处方有大幅度提升。由于四氢姜黄素的服用剂量较高,溶解度在300 mg/mL 以上的ⅢB、Ⅳ型处方更为适合。ⅢBM 和ⅢB-L 型处方中四氢姜黄素溶解度分别为377.6、330.9 mg/g,较为接近,故对这2 种处方作进一步比较。
2.3.2 乳滴粒径 分别将空白和载药处方以100 倍纯水稀释并充分分散后,用激光粒度仪测定粒径。由表2 可知,粒径随着脂质含量的下降而减小,且含长链脂质的处方的分散粒径明显大于含中链脂质处方。空白脂质处方分散后,中链脂质处方透明度高于同型的长链脂质处方,与粒径测定结果相符。但载药后ⅢB-M 及Ⅳ型处方则变为白色不透明乳液,经显微镜观察,乳液中产生了微小的药物结晶颗粒; ⅡM 和ⅢA-M 型则由于载药量较小,外观与空白处方相差不大。
2.3.3 在人工胃液中的溶出试验 分别将1.5 g 四氢姜黄素溶于5 g ⅢB-M、ⅢB-L、Ⅳ型空白处方中,各取0.50 g装填入0 号硬胶囊中,以人工胃液(0.01 mol/L HCl 和0.15 mol/L NaCl,pH 2.0,由于脂质处方中不含蛋白酶的底物,故未加入胃蛋白酶) 为溶出介质,采用2020 年版《中国药典》 四部通则0931 溶出度与释放度测定法桨法测定,转速为75 r/min,于5、15、30、45、60、90、120 min各取样5 mL,0.22 μm 微孔滤膜过滤,测定四氢姜黄素含量,计算溶出度,结果见图1。

图1 3 种处方在人工胃液中的溶出曲线
由此可知,3 种类型处方的溶出速率从快到慢为ⅢBL、ⅢB-M、Ⅳ,ⅢB-L 型可乳化分散,在15 min 时溶出度即达90%; ⅢB-M 型溶出度较低,2 h 时约为61%; Ⅳ型最终溶出度仅为38%,这是由于其载药后黏度较大,溶出速度较慢,并且随着其中表面活性剂和助溶剂的溶解,残留的四氢姜黄素遇水迅速产生沉淀,导致溶出度较低。
2.3.4 ⅢB-M、ⅢB-L 处方体外消化比较 为了模拟四氢姜黄素-脂质制剂在体内消化过程,参考文献[14] 报道,分别采用模拟禁食肠液和模拟餐后肠液为介质,并加入猪胰酶以模拟餐前和餐后状态下处方在肠道的消化过程。
将0.42 g NaOH、3.44 g NaHPO4、6.19 g NaCl 溶于0.9 L 纯净水中,调节pH 至6.5,纯净水补足体积至1 L,得缓冲液。将2.24 g 模拟禁食肠液粉末溶解于缓冲液中,即得模拟禁食肠液; 将4.04 g NaOH、8.65 g 冰醋酸、11.87 g NaCl 溶于0.9 L 纯净水中,调节pH 至6.5,补足体积至1 L,即得缓冲液; 将11.2 g 模拟餐后肠液粉末溶于缓冲液中,即得模拟餐后肠液; 分别在2 种介质中加入0.5%猪胰酶、氯化钙27.7 mg,涡旋1 min,即得消化介质,组成见表3。
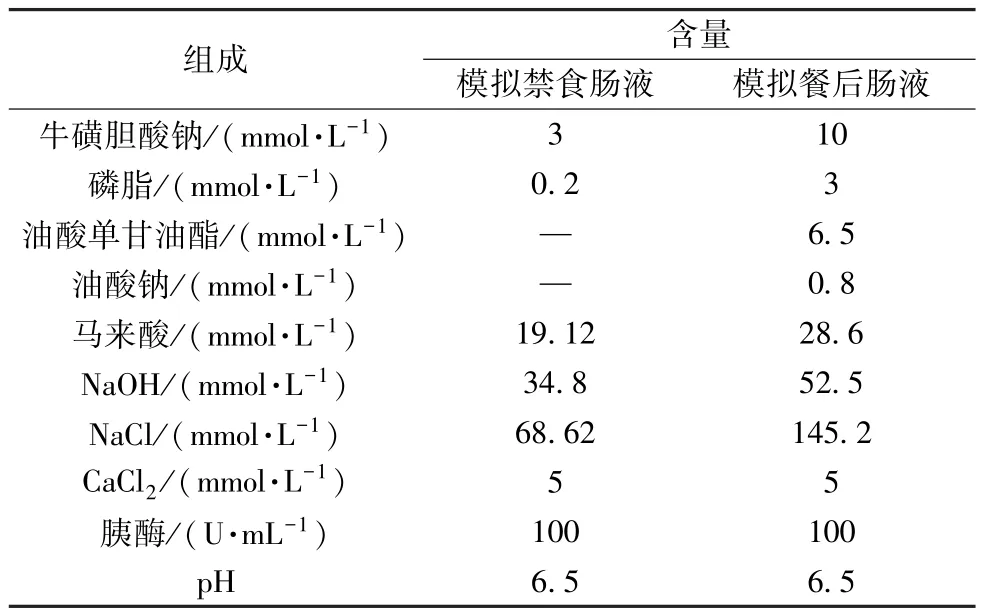
表3 模拟禁食和餐后消化液组成
分别取“2.3.3” 项下含药处方0.50 g,加入37 ℃、含50 mL 模拟肠液消化液的离心管中,60 r/min 振摇,于0、0.25、0.5、1、1.5、2 h 各取消化液0.5 mL,加入0.5 mmol/mL 4-溴苯硼酸甲醇10 μL,摇匀,终止脂解反应[15],0.22 μm 微孔滤膜过滤,即得供试品溶液。
由图2 可知,在消化体系中,四氢姜黄素浓度达到高峰后均有下降趋势,这是由于处方在快速分散达到过饱和后产生沉淀所导致的。在模拟禁食肠液中,ⅢB-L 型溶出AUC 高于ⅢB-M 型,这与模拟胃液中的溶出试验结果一致。而在模拟餐后肠液中,ⅢB-L 型与ⅢB-M 型的AUC 差异较小,可能是由于模拟餐后肠液中具有更高浓度的胆盐、磷脂及脂质消化产物[16],对四氢姜黄素的溶解度增大导致,提示四氢姜黄素的脂质处方可能具有正向食物效应[17],即餐后给药可增加其生物利用度。综合M、L 型处方在2 种消化介质中的表现,选择长链的蓖麻油作为脂质,对四氢姜黄素溶解度更高的模拟餐后肠液作为脂解试验的介质。

图2 ⅢB-M、ⅢB-L 型处方溶出曲线
2.4 D-最优混料设计 根据四氢姜黄素在各型处方中的溶解度结果可知,当蓖麻油比例为25%时(ⅢB 型),载药量可达330 mg/g,因此预估蓖麻油比例≤0.3 时,载药量将大于300 mg/mL。结合Pouton[1]对各类脂质制剂处方组成的界定(表4),将表面活性剂吐温80 范围设置为0.2 (Ⅲ型处方下限) ~0.8 (Ⅳ型处方上限),助表面活性剂Transcutol HP 比例≤0.5。通过Design Expert 12 软件进行D-最优混料设计,结果见表5。
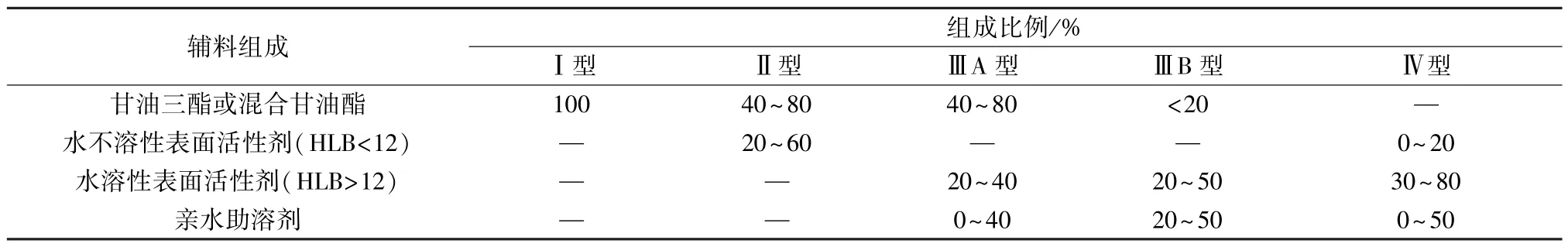
表4 脂质制剂处方分类
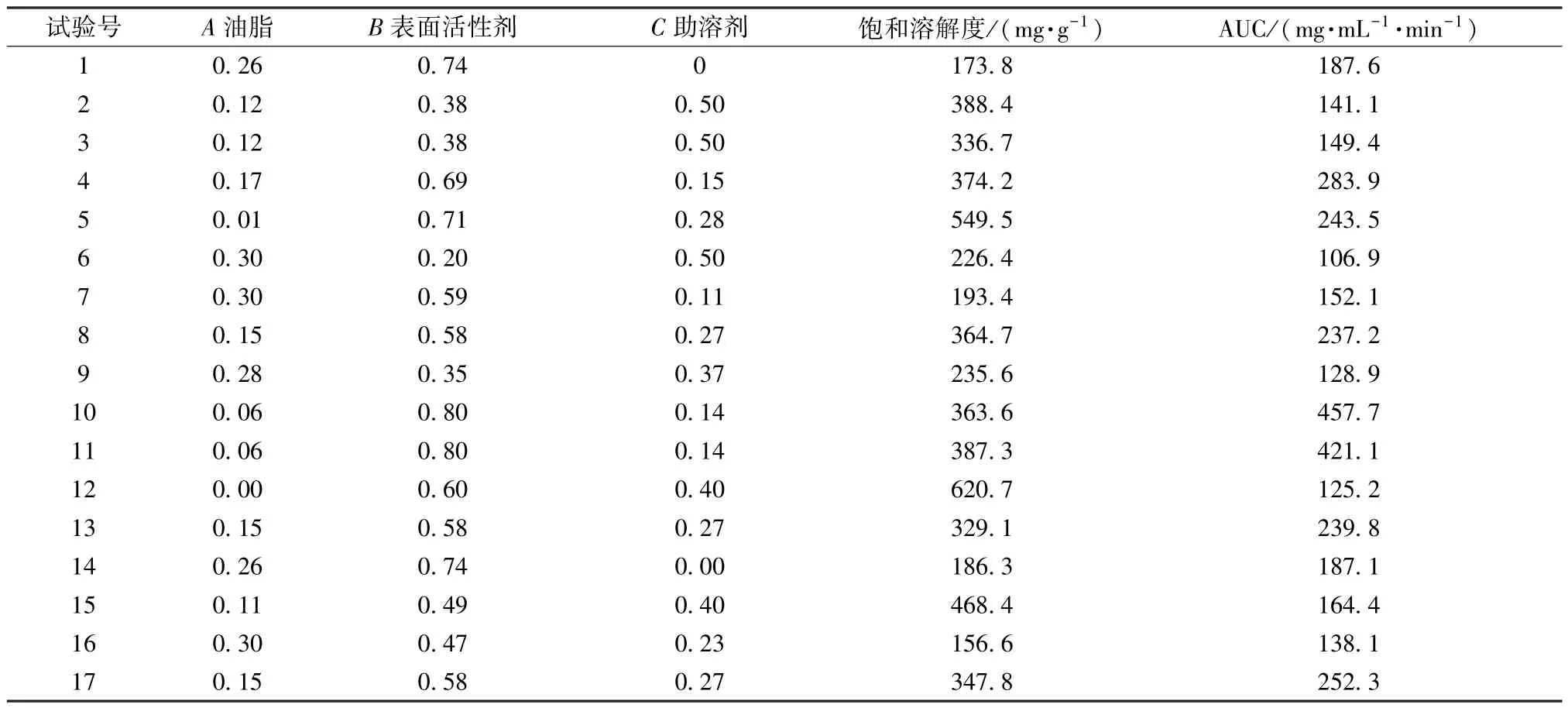
表5 D-最优混料设计结果
按表5 的处方比例制备空白脂质处方,并在处方中加入过量四氢姜黄素,25 ℃下振摇48 h,8 000 r/min 离心10 min,按“2.3.4” 项下方法进行体外消化试验,于0.25、0.5、1、2、3、4 h 各取消化液0.5 mL,加入0.5 mmol/mL 4-溴苯硼酸甲醇溶液10 μL,摇匀,终止脂解反应,0.22 μm 微孔滤膜过滤,测定四氢姜黄素质量浓度。通过Prism 8.0 软件绘制时间-浓度曲线,见图3,计算曲线下面积AUC,结果见表5。
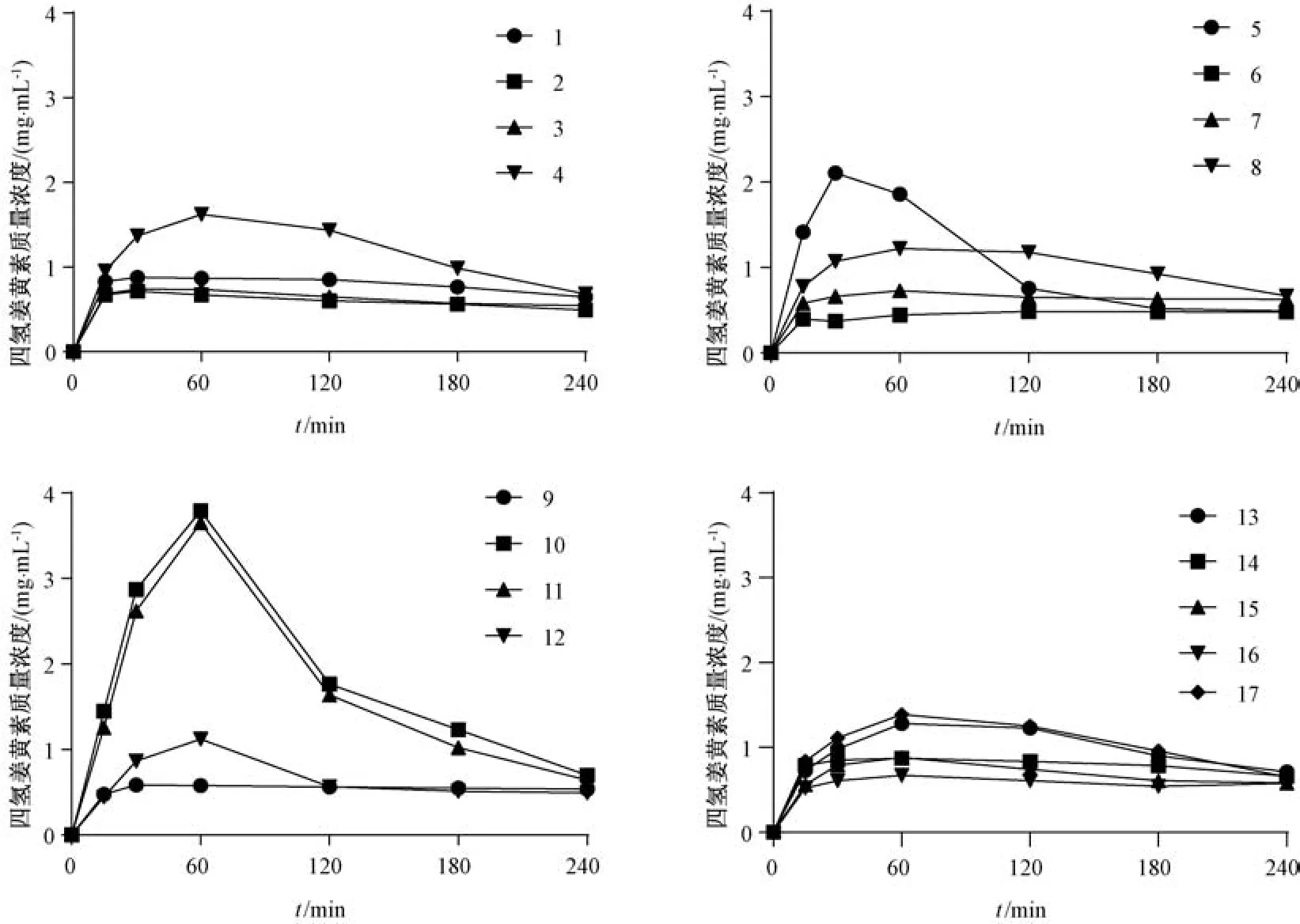
图3 各处方体外消化试验溶出曲线
通过Design Expert 12 软件对表5 数据进行回归拟合,得方程为AUC=-139.98A+846.38B+275.09C-1 547.80AB-51.65AC- 1 673.94BC+4 354.12A2BC+8 010.82AB2C+3 585.47ABC2(R2=0.983 8),方差分析见表6。由此可知,失拟项P=0.272 7,R2=0.989 3,,表明模型拟合程度较好,能较准确地预测评价指标; 当A为0.076,B为0.800,C为0.124 时,AUC 达到峰值,为435.6 mg/(mL·min)。溶解度最佳拟合方程为溶解度=-1 943.4A+78.41B-679.57C+3 315.32AB+6 395.61AC+3 510.66BC-12 512.57ABC(P<0.01)。辅料比例取AUC优化值时,溶解度的预测值为346.52 mg/g。
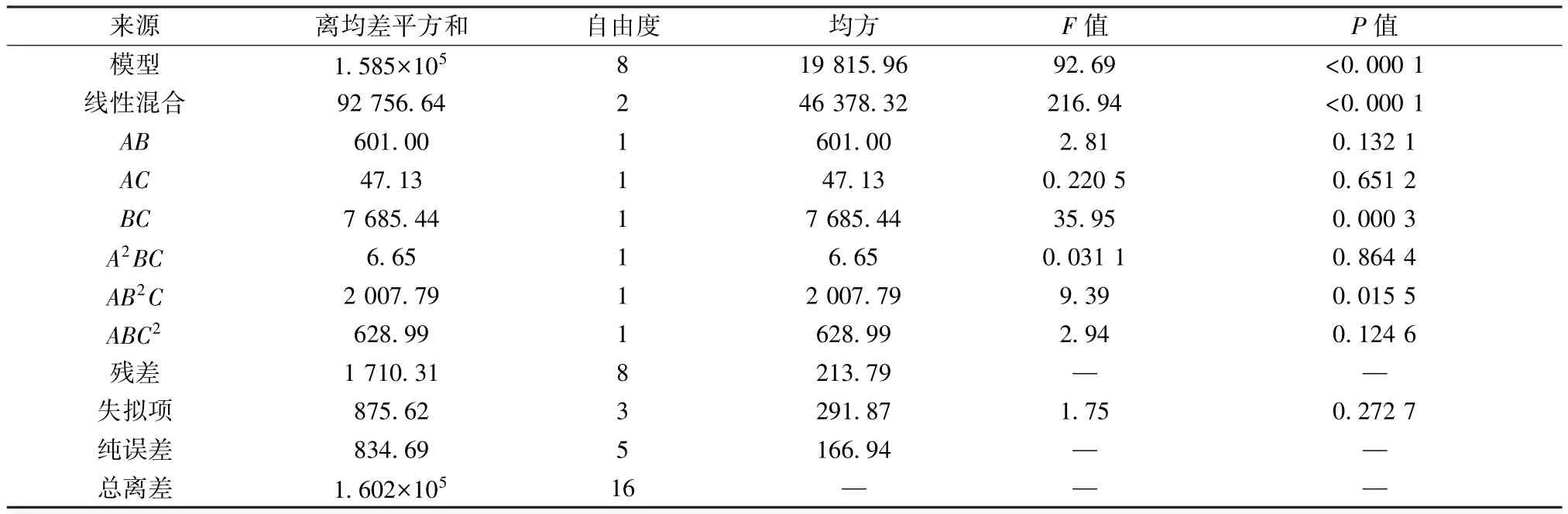
表6 方差分析结果
由等高线图(图4) 可知,四氢姜黄素在处方中的饱和溶解度与油脂的比例量具有负相关关系,但AUC 与辅料比例的关系更为复杂,AUC 随表面活性剂比例增加而增加,但当表面活性剂的量一定时,油脂和助表面活性剂其中之一偏大,AUC 会明显降低。

图4 溶解度(A)、AUC (B) 等高线图
2.5 验证试验 按预测的最优处方进行辅料的配制,加入过量四氢姜黄素混合,振摇48 h 以达到饱和浓度,取离心后的载药处方,进行消化试验,测定其体外释放浓度,重复3 次,结果见表7。由此可知,验证试验与模型预测相符,模型重复性和预测性良好。

表7 验证试验结果(n=3)
2.6 载药量研究 将“2.5” 项下所得饱和载药量的含药最优处方混合,添加空白辅料稀释混匀,制得载药量分别为饱和载药量20%、40%、60%、80%、100% (71、142、213、284、355 mg/g) 的处方F20~F100,按“2.3.4” 项下方法进行消化试验,测定消化液中四氢姜黄素质量浓度。
由图5A 可知,在4 h 的消化过程中,F20、F40 在质量浓度达到最高后几乎保持不变; F60 在60 min 达到最高后缓慢降低; F80、F100 在60 min 达到峰值后迅速下降,4 h后甚至接近F20。释放曲线AUC 顺序为F100、F60、F80、F40、F20,F60~F100 的AUC 差距不大(图5B)。这是由于四氢姜黄素在体系中的过饱和度较低时,可以较长时间保持亚稳态,但过饱和度越高,药物聚集速度越快,形成沉淀速度也加快,导致更快接近平衡浓度(图6)。这一结果提示,药物在消化液中的高过饱和度会带来较大的沉淀风险,可能导致其在体内的暴露低于预期。综上所述,暂定载药量为60%饱和载药量,即213 mg/g。
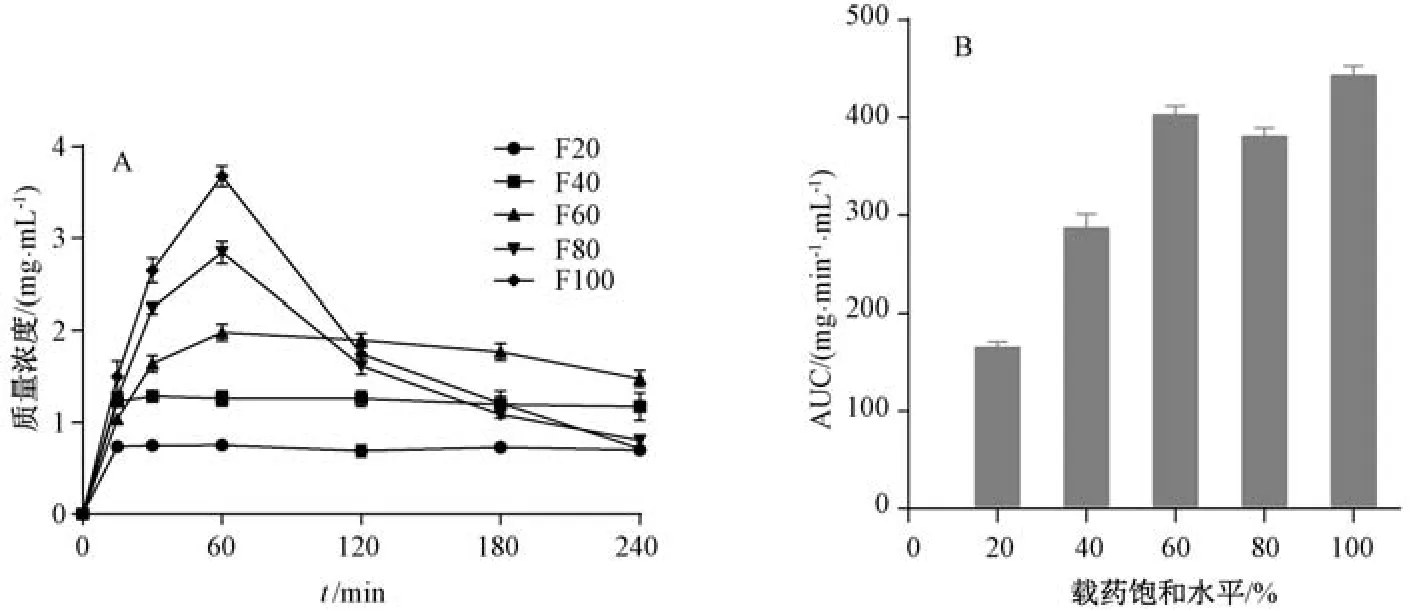
图5 不同载药量四氢姜黄素脂质制剂在体外消化时的溶出曲线(A) 和AUC (B)
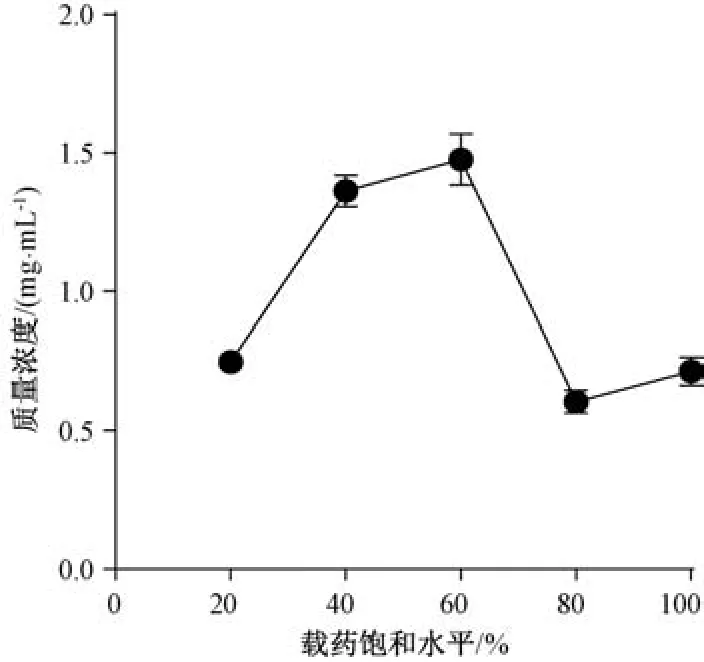
图6 载药量对消化4 h 后四氢姜黄素质量浓度的影响
3 讨论
本研究以四氢姜黄素的脂质处方在简化体外脂解模型中的浓度-时间曲线下面积为指标,采用D-最优混料设计优选了脂质处方,结果表明以蓖麻油、吐温80、Transcutol HP 质量比为7.6 ∶80 ∶12.4 时,脂质处方具有最大的体外脂解试验曲线下面积。在此基础上通过体外消化试验对最佳载药量进行了初步摸索。
本研究采用体外AUC 作为衡量制剂性能的指标,为脂质制剂的处方研究提供了一种新的手段; 改进了简化脂解试验的方法,让处方的分散在脂解过程中进行,能够同时考察处方的分散性能; 让被考察处方以各自的饱和载药量进行脂解试验。因此,就使脂质制剂体外脂解试验中的AUC 成为综合指标,考察了处方的分散性能、载药量、在分散和消化时保持药物过饱和的能力,比通常采用的溶解度、乳滴粒径、乳化时间等简单指标更能反映制剂在体内的性能。
在脂解试验中溶出曲线普遍显示出先升后降的趋势,这是由于药物在初始阶段快速溶出,浓度迅速升高,随后由于过饱和状态的不稳定而发生沉淀,导致浓度下降,被称为“弹簧-降落伞” 过程[18-19],是脂质制剂等过饱和制剂释药的一个共同特点。正是由于这种不规则的释药曲线,使得AUC 而非溶出度成为一个衡量脂质制剂性能的良好指标。
本研究发现,载药量与体外AUC 并不呈完全的等级相关,这可能与试验条件有关。如果增大介质用量,会减小体系的过饱和度,降低沉淀速度,从而使AUC 等级与载药量趋于一致; 若采用较短的消化时间(30~60 min),载药量与AUC 呈较好的等级相关。但本研究采用50 mL 消化液体积及4 h 消化时长能更准确地反映胃肠道的生理状态,其试验结果也更好地体现了脂质处方体内表现的复杂性。但当载药量达到饱和浓度60%以上时,载药量与体内暴露量的关系难以根据本实验预测,需要进一步结合体内生物利用度、药效学研究结果进行确认。
