真菌三萜生物合成途径关键后修饰酶研究进展
2024-03-10占慧慧孟俊华崔培梧
占慧慧,刘 媛,孟俊华,崔培梧
(湖南中医药大学药学院,国家中医药管理局中药药性与药效三级科研实验室,菌物药研究室,湖南 长沙 410208)
三萜化合物(triterpenoids) 是由6 个异戊二烯单元共30 个碳原子组成的一大类天然产物,广泛存在于细菌、真菌、植物及动物中[1],是很多药用真菌的重要活性成分,如灵芝Ganodermalucidum[2]、茯苓Poriacocos[3]、桑黄Phellinuslinteus[4]、桦褐孔菌Inonotusobliquus[5]、虫草Cordyceps[6]、牛樟芝Antrodiacinnamomea[7]、蘑菇Agaricus campestris[8]、猴头菌Hericiumerinaceus[9]等; 其化学结构的多样性也赋予三萜丰富的生物活性,因此被视为新药开发的重要来源之一,如灵芝中的灵芝酸[10-11]、茯苓中的茯苓酸[3,12]、桦褐孔菌中的白桦脂醇[13-15]等,均被证实具有较好的抗肿瘤、抗炎、降糖及降脂活性,且部分已进入临床研究阶段。随着真菌三萜潜在药用价值的持续发掘,真菌三萜的生物合成及其综合开发相关研究吸引了众多科研工作者的关注。目前,真菌三萜类天然产物主要从其子实体中提取,但存在野生资源匮乏、人工栽培周期长、质量稳定性差、子实体中三萜含量低等问题,同时三萜化合物的结构复杂性也限制了化学合成法在大规模生产中的应用。生物合成技术快速发展,利用代谢工程、基因工程等技术超表达或调控参与三萜生物合成途径的关键酶基因,从而实现三萜的高效生物合成,已成为真菌三萜资源开发领域最有前景的开发模式。现有研究表明,三萜生物合成途径可分为3 个阶段,即前体形成、骨架构建及后修饰,目前三萜生物合成途径关键酶的相关研究主要集中在前2 个阶段; 由于关键酶的多样性、后修饰反应的复杂性等问题,后修饰阶段研究进展相对较慢,但其对于三萜化合物的结构形成及多样性必不可少[16-18]。因此,有必要对后修饰阶段的关键酶相关研究进行系统综述,以期为真菌三萜生物合成途径的充分解析、重构和定向强化提供必要参考。基于此,本文就近年来国内外有关真菌三萜生物合成途径及其关键后修饰酶细胞色素P450 单加氧酶和糖基转移酶的研究进行综述。
1 真菌三萜的生物合成途径
所有真菌萜类天然产物均来源于常见的五碳二磷酸异戊烯基中间体异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP) 及其双键异构体二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP),这2 种中间体都是通过甲羟戊酸途径 (mevalonate pathway,MVA pathway) 合成[19],见图1。
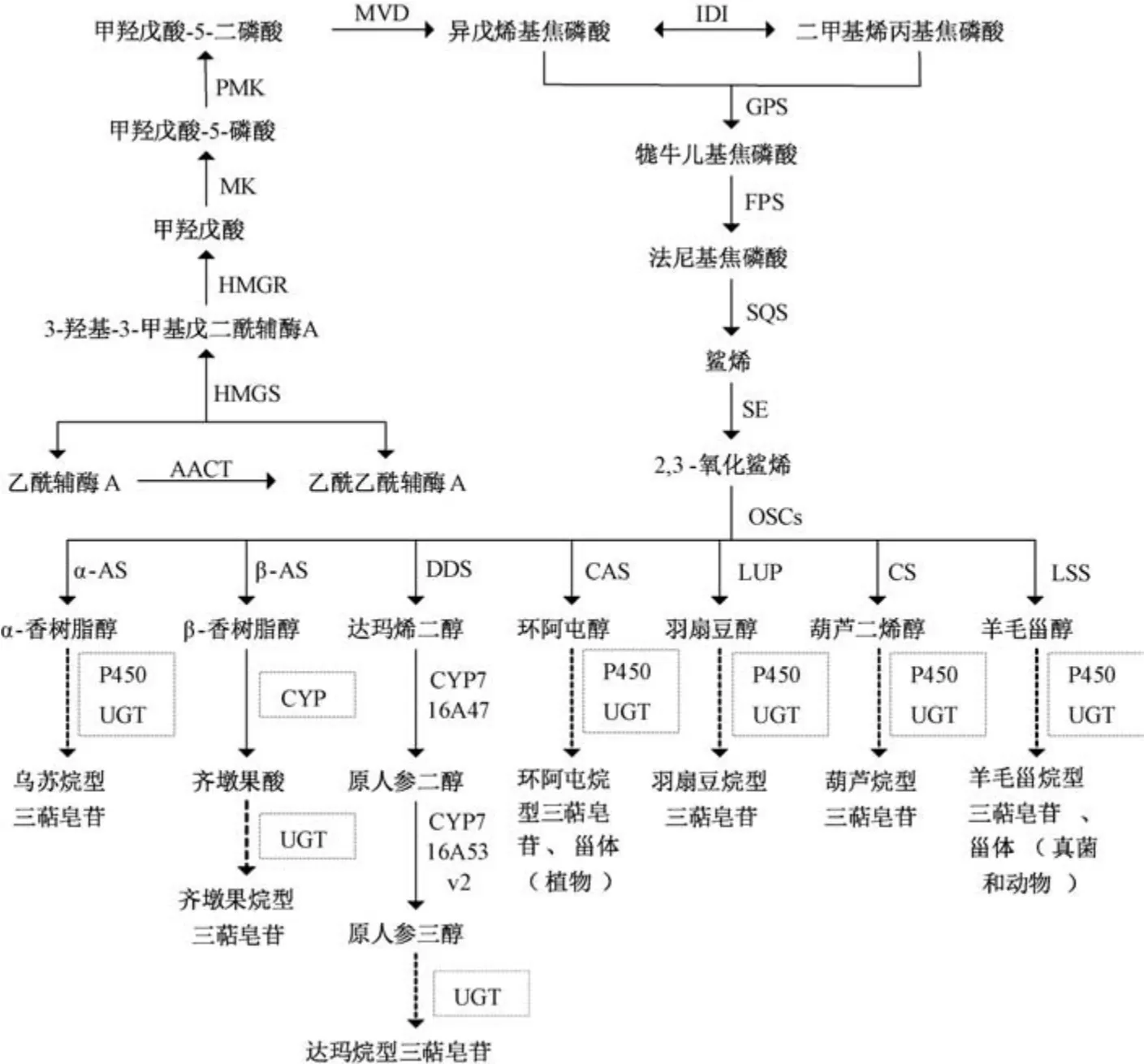
图1 MVA 合成途径
经MVA 途径合成三萜类产物的过程可分为3 个阶段,首先是上游前体物质IPP 和DMAPP 的形成; 其次是4 种中间体牻牛儿基焦磷酸(geranyl diphosphate,GPP)、法尼基焦磷酸 (farnesyl diphosphate,FPP)、鲨烯 (squalene,SQ)、2,3-氧化鲨烯(2,3- oxidosqualene) 的合成及三萜骨架构建; 最后是下游后修饰过程(氧化还原、酰化、糖基化等)。图1 中列举了具有代表性的三萜骨架类型,包括四环的达玛烷型、环阿屯烷型,五环的乌苏烷型、齐墩果烷型、羽扇豆烷型等,其中环阿屯醇和羊毛甾醇也分别是植物甾醇、真菌和动物甾醇生物合成的前体。
真菌三萜主要为羊毛甾醇骨架来源的衍生物,其以羊毛甾醇为底物,在氧化酶、酰基转移酶、糖基转移酶等后修饰酶的催化下合成结构多样的羊毛甾烷类三萜,如灵芝中的灵芝酸A 和灵芝酸C、茯苓中的茯苓酸和茯苓新酸B、牛樟芝中的zhankuic acid E、Astraeuspteridis中的3-epiastrapteridiol、白桦茸中的inotodiol 等[1],因此细胞色素P450 单加氧酶、糖基转移酶等催化酶为这些三萜化合物合成途径后修饰阶段的关键酶,对三萜化合物结构的多样性发挥着重要作用。
2 细胞色素P450 单加氧酶
细胞色素P450 单加氧酶(cytochrome P450 monooxygenases,简称CYP450、P450 或CYP) 属于超基因家族酶,是一类含有血红素的铁硫蛋白,能以还原态与CO 结合,在450 nm 波长处有最大吸收峰,最先在哺乳动物大鼠肝微粒体中被发现,广泛分布在细菌、真菌、动植物、人等各种需氧生物体内[20]。P450 的命名是基于其氨基酸序列的同源性,若P450 基因的氨基酸序列同源性大于40%,则纳入同一家族; 若同源性大于55%,则纳入同一亚家族。
Nelson[21]研究表明,真菌的CYP 基因具有丰富的多样性,目前已对八百多种真菌基因组进行测序,已发现的真菌CYP 基因超过85 000 条,真菌的CYP 家族结构也逐渐形成,有805 个家族,根据系统发育树上的不同分支被分为32 个集团,包括含有3 个家族(CYP52、63、505) 的52 集团、含有7 个家族(CYP53、57、507、65、60、62、58) 的53 集团、含有5 个家族 (CYP54、506、68、69、503) 的54 集团、含有5 个家族(CYP64、66、502、501、504) 的64 集团及其他大量不属于以上任何集团的CYP 家族,如CYP51、56、59、61、67。已分离的真菌CYP 基因多归属于CYP51 ~CYP66 家族[22],其中CYP51 和CYP61的进化较为保守,功能研究较为透彻,主要参与麦角甾醇的代谢途径[23]。
CYP 参与真菌三萜骨架修饰,如催化碳环骨架上的不同位置发生氧化反应以形成羟基、羧基、酮基、双键等不饱和基团,与真菌三萜的多样性密切相关。因此,CYP 的克隆和功能研究对解析真菌三萜生物合成途径及增加活性物质三萜的产量具有重要的作用,但关于真菌三萜CYP 的研究相对较少,目前已报道的参与三萜骨架修饰的CYP 基因绝大多数来自于植物,详见表1[24-25]。

表1 参与三萜结构修饰的CYP 基因
田风华[26]将真菌中的元蘑Sarcomyxaedulis参考基因组SE1 与植物中已鉴定的32 个CYP 超家族中三萜合成相关的基因进行序列比对,植物包括糙伏毛燕麦、拟南芥、百脉根、大豆、蒺藜苜蓿、乌拉尔甘草、葡萄、人参和长春花,共获得142 个相关CYP 基因,经转录组结果分析,有82 个基因呈现显著差异表达,其中有21 个参与以β-香树酯醇为骨架的三萜氧化修饰过程,并对其在相应三萜后修饰途径中的作用进行了预测,属于CYP51 类型 (cyp51h10) 的CYP 基因有5 个(SE.1A1769、SE.1A3105、SE.1A6400、SE.1A8868、SE.1A8872),主要参与对β-香树酯醇的12、13 位的氧化修饰; 属于CYP71 类型(cyp93E1、cyp93E2、cyp93E3) 的CYP 基因有2 个(SE.1A5016、SE.1A7086),参与对β-香树酯醇的24 位的氧化修饰,也可能参与对β-香树酯醇的一级修饰产物槐二醇(Sophoradiol) 的氧化修饰;属于CYP72 类型 (cyp72A63、cyp72A154、cyp72A612) 的CYP 基因有5 个(SE.1A5981、SE.1A0547、SE.1A2193、SE.1A7668、SE.1A7798),其中SE.1A5981 基因参与对β-香树酯醇的30 位的氧化修饰,且上调表达修饰,而其他4 个基因则可能参与多种二级修饰途径; 属于CYP85 类型(cyp88D6) 的CYP 基因有3 个(SE.1A3202、SE.1A7455、SE.1A3577),其中SE.1A3202 和SE.1A7455 参与对β-香树酯醇11 位的氧化修饰,而SE.1A3577 基因则参与对β-香树酯醇的羧化修饰,三者均为一级修饰。以上研究表明,众多的CYP 也都来源于同一个祖先,基因序列具有一定的同源性,因此在植物中报道的与三萜合成相关的CYP 基因,如朱灵英等[24]总结的植物中近100 个与三萜合成相关的CYP 基因,可以为真菌三萜CYP 基因的挖掘提供参考。
方星等[27]通过检索NCBI 数据库,根据已报道5 种真菌的CYP51 氨基酸序列比对后获得了CYP51 氨基酸序列保守区域,并利用PCR 技术克隆得到灵芝CYP51 基因(Glcyp51)。农杆菌介导的转化法实现了Gl-cyp51 在灵芝内的超量表达和灵芝三萜含量的增加。结合其他相关研究,CYP51 在三萜骨架修饰中的重要意义被普遍证实,如孙婷婷[28]在研究中利用已鉴定功能的CYP 氨基酸序列与桑黄基因转录组数据进行比对,筛选出7 个同源性大于55% 的CYP 候选基因,蛋白结构域分析表明这7 个候选基因全部具有P450 保守结构域,其中4 个被注释为羊毛甾醇14α-脱甲基酶,属于CYP51 家族; 随后刘增才等[29-30]在此基础上克隆得到暴马桑黄Sanghuangporusbaumii羊毛甾醇14α-脱甲基酶基因(lanosterol14-alpha-demethylase,LSD) 的2 条cDNA 序列,分别命名为SbLSD (登录号MN864180) 和SbLSD1 (登录号MN640689),通过生物信息学及原核差异表达分析,表明两条基因都属于CYP 超家族成员,与灵芝的LSD 蛋白同源性最高(99%),高度的同源性说明SbLSD蛋白与灵芝等物种的LSD 蛋白在三萜合成过程中可能具有相似的功能。
除了通过与植物和真菌中已鉴定的三萜合成相关CYP基因氨基酸序列进行比对分析从而获得目标真菌三萜合成相关的CYP 基因外,也有学者直接对多种目标真菌CYP 家族基因进行富集、鉴定和分析,从整体上比较和把握真菌三萜合成相关CYP 基因的共性。如Syed 等[31]首次对黄孢原毛平革菌Phanerochaetechrysosporium、Phanerochaete carnosa、双孢菇Agaricusbisporus、褐腐菌Postiaplacenta、Ganodermasp.和干朽菌Serpulalacrymans这6 种模式担子菌富集的CYP 家族进行鉴定和进化比较分析,发现在68 个CYP 家族中富集了11 个CYP 家族基因,分别是CYP63、CYP512、CYP5035、CYP5037、CYP5136、CYP5141、CYP5144、CYP5146、CYP5150、CYP5348 和 CYP5359。CYP 系统发育分析和基因结构分析显示,除黄孢原毛平革菌和Phanerochaetecarnosa的CYP 家族外,其余4 个菌种的CYP 家族均具有种特异性排列,表明CYP 家族在模式担子菌中存在副同源进化; 在这6 个真菌基因组中也存在相同基因结构的CYP 序列。此前,Chen 等[32]对灵芝菌株进行全基因组测序,发现含有的219 个CYP 基因中有78 个CYP基因(包含cyp512 基因15 个、cyp5144 基因1 个) 在灵芝菌丝体到原基阶段的发育过程中上调表达,并在原基阶段达到最高表达水平,在子实体阶段则下调表达,这些CYP基因的表达与灵芝三萜的含量变化呈正相关且与羊毛甾醇合酶基因的表达变化一致,提示这78 个CYP 基因可能与灵芝三萜的生物合成相关。Wang[33]、Yang 等[34]在此基础上利用过表达策略和UPLC-MS 等检测手段从灵芝菌株中分别鉴定出参与灵芝三萜生物合成的CYP 基因cyp5150l8 和cyp512u6,这是迄今为止发现的仅有的2 个参与灵芝酸生物合成后修饰CYP 基因。此外,Yang 等[34]还克隆了灵芝的NADPH-细胞色素P450 还原酶(GLCPR),该酶可以协同cyp512u6 进行灵芝三萜的催化反应,为体外研究真菌三萜CYP 基因的功能提供了试验参照。另外,通过比较真菌不同用药部位或不同菌种培养时的三萜成分差异,针对性地寻找与三萜合成相关基因,近年来已成为一种新的产物合成基因研究策略。在具有代表性的药食两用真菌茯苓中,王维皓[35]采用UHPLC-DAD-FT/MSn技术对白茯苓和茯苓皮定性分析,发现茯苓皮中三萜酸的含量明显高于白茯苓,尤其是3,4-开环型三萜酸类化合物,为进一步探寻其成分差异的分子机制,采用转录组测序等技术初步筛选到56 条可能与3,4-开环型三萜酸生物合成相关的CYP450 基因,并预测3,4-开环型三萜酸可能的生物合成途径。
3 糖基转移酶
真菌三萜结构通过 UDP-糖基转移酶 ( UDPglycosyltransferase,UGTs) 在羟基和或羧基上的糖基化进一步多样化。UGTs 基因属于超基因家族,其数量庞大、底物灵活且具有高度的专一性,能够利用已活化的糖基供体如UDP-葡萄糖、-半乳糖、-阿拉伯糖、-鼠李糖、-木糖或-葡萄糖醛酸转移到不同受体分子上,激活或抑制一系列化合物或者调节其溶解度,从而参与到生物体的多种调控和代谢途径中。与P450 一样,UGTs 的命名是基于氨基酸序列的同源性,同源性超过40%归为同一家族,超过60%归为同一亚家族。
近年来,基于expressed sequence tag (EST) 分析、454焦磷酸测序技术、表达谱、系统发育树等方法,越来越多来自细菌、植物和动物的GT 基因被挖掘出来,但目前从真菌中克隆和表征的UGTs 只有数个,如来自于冻土毛霉菌的MhGT1[36]、来自Rhizopusjaponicus的UGT58A1[35]和来自Absidiacoerulea的UGT59A1[37]。郭溆等[38]采用RT-PCR 方法根据灵芝基因组中1 条可能参与灵芝三萜合成的UGT 基因转录本(GL2527) 克隆得到了茯苓UGT 基因并将其命名为GLUGT1,基因全长1 491 bp,编码含有496 个氨基酸的多肽,与云芝UGTs 中EIW63452 的相似度较高(50%),其成功克隆和序列分析为进一步研究灵芝三萜或其他真菌三萜的代谢途径奠定了基础。
Xie 等[39]利用基因组挖掘和异源表达技术相结合的方法,从Hypocreales真菌中鉴定出4 个新的糖基转移酶-甲基转移酶(UGT-MT) 功能模块,这些模块显示出良好的底物杂泛性和区域特异性,能够将类黄酮、二苯乙烯类、蒽醌类、苯二醇内酯等天然产物的甲基葡萄糖基化。有学者将这些来源于真菌的底物杂泛性的UGT 应用到植物三萜的异源生物合成中,如Zhuang 等[40]通过利用来源于酿酒酵母的UGT51 来异源合成人参三萜,由于微生物中关键的人参糖基转移酶的催化能力低,于是通过解析UGT51 的晶体结构并进行半理性设计,使得UGT51 体外催化原人参二醇底物生成人参皂苷Rh2 产物的效率提高了1 800 倍,将突变的UGT51 基因导入到具备原人参二醇合成途径的酿酒酵母中进行真核表达,可将Rh2 的产量从0.003 2 mg/g 增加到0.39 mg/g 细胞干重(dry cell weight,DCW)。Dai 等[41]利用一种来自于枯草芽孢杆菌168 的具有底物杂泛性的UGT酶Bs-YjiC 来合成人参三萜,分别以原人参三醇、UDP-葡萄糖作为糖基受体和糖基供体进行体外催化反应,结果表明Bs-YjiC 能将葡萄糖基团转移到原人参三醇的C3、C6 和C12 位的OH 上生成5 种原人参三醇型人参三萜(包括人参三萜Rh1 和4 种非天然的人参三萜)。Zhang 等[42]则利用另一种来自于枯草芽孢杆菌的具有底物杂泛性的酶UGT109A1在大肠杆菌中异源合成人参三萜,分别以人参三萜Rh1、R1、Re、Rf 及UDP-葡萄糖作为糖基受体和糖基供体进行体外催化反应,结果发现UGT109A1 可以将糖基转移到人参皂苷Re 和R1 的C3 位OH 上,也可以将糖基转移到人参皂苷Rf、Rh1 的C3 及C-12 位的OH 上,合成的产物中包括多种非天然的人参皂苷。以上研究揭示了不同来源的UGT酶在三萜类天然化合物生物合成中的巨大潜力,为利用底物杂泛性的GT 修饰酶进行三萜天然产物合成提供了参考。此外,UGT51 亦可催化胆固醇、谷甾醇等甾醇底物的糖基化,为甾醇类化合物的结构多样化发挥着重要作用[43]。
除了利用来自真菌内源性UGT 合成其它物种三萜外,也有学者利用来自于其它物种的UGT 来合成真菌内源三萜,Wu 等[44]使用4 种芽孢杆菌UGTs,包括来自苏云金芽孢杆菌GAA07 菌株的BTGT16345 和来自枯草芽孢杆菌ATCC6633 菌株的3 种UGTs (BsGT110、BsUGT398 和BsUGT489),对真菌三萜灵芝酸G (GAG) 进行生物转化并合成了2 种新化合物GAG-3-O-β-葡萄糖苷和GAG-26-Oβ-葡萄糖苷。对于真菌三萜合成途径中UGTs 基因元件的挖掘及其参与的具体步骤的解析尚处于初步研究阶段,通过设计合成路径、构建细胞工厂实现高效获取三萜类化合物的方法一直是近年来的研究热点。Wang 等[45]在对真菌酿酒酵母底盘宿主MVA 途径及P450 表达水平优化的基础上构建了一系列生产人参皂苷Rh2 的细胞工厂,通过提高C3-OH 的糖基化效率、增加UGTPg45 的基因拷贝数、改造UGTPg45 的启动子提高其表达水平,并挖掘新的糖基转移酶UGTPg45,建立了一个迄今为止人参皂苷Rh2 产量最大的酵母细胞工厂,摇瓶产量达到179.3 mg/L,10 L 发酵罐中的产量达到了2.25 g/L,该研究结果为酵母细胞工厂生产稀有天然产物,特别是糖基化产物,提供了成功的范例。
上述研究表明GTs 在三萜结构的糖基化修饰过程发挥着重要作用,因此挖掘可作用于不同三萜骨架、合成不同皂苷的GTs 并探索其结构改造、重组表达、体外催化等相关研究,将为实现三萜皂苷类化合物的高效开发提供重要数据。
4 结语和展望
真菌中含有丰富的具有多种生物活性的三萜类化合物,是发现新颖三萜的重要资源宝库。真菌三萜的MVA生物合成途径从乙酰辅酶A 开始,经由3 个阶段,包括IPP 和DMAPP 前体物质的形成、三萜皂苷骨架的构建及调控三萜结构多样性的后修饰过程,第三阶段中参与三萜后修饰催化的CYP450s 和GTs 基因研究报道依然很少,因此挖掘真菌中可能参与到三萜合成的后修饰酶基因并解析其功能,将有利于实现真菌三萜的人工生物合成,同时也为真菌三萜产物合成途径的解析奠定基础。目前,可用于寻找、克隆和鉴定真菌三萜生物合成相关基因的方法已有很多种,如EST 分析可鉴定不同组织中的转录组和识别新基因,表达谱及系统发育分析可以鉴别候选基因,结合基因重组表达、无细胞催化及高效分析技术,可为MVA 途径关键后修饰酶CYPs、GTs 等基因的挖掘提供重要手段。
本文从真菌三萜MVA 生物合成途径切入,介绍了后修饰阶段的两大类关键酶CYPs、GTs 及其对三萜合成的相关研究,为真菌三萜生物合成途径的解析、调控、重构提供了理论参考。近年来,随着三萜化合物化学成分、药效活性的发现和在生物医药产业的发展,人们对三萜类天然活性产物的重视度也在不断提升,而在真菌三萜在已有的化学成分、药理作用等研究基础上探索三萜合成途径中关键酶基因的克隆、表达、调控以及在细胞代谢中的作用,不仅很好地顺应了这一发展需求,而且可以进一步的促进真菌三萜资源库的挖掘和三萜MVA 途径关键酶参与合成具体步骤的阐明。
除三萜外,甾醇为真菌通过MVA 途径合成的另一类重要代谢产物,其中麦角甾醇为真菌类的特征甾体化合物,可作为维生素D2 的前体,具有代谢调节、调控激素水平、预防心血管疾病、抗肿瘤等活性[46]。麦角甾醇合成途径为一条由多种Erg 蛋白参与、经羊毛甾醇节点的代谢途径。erg24 基因编码的甾醇 14α-去甲基酶 ( sterol 14αdemethylase) 催化羊毛甾醇、钝叶醇等C-14 位的甲基发生羟基化,属于CYP51 家族,为一类专门负责甾醇氧化的CYP450[47]。由此可见,三萜和甾醇的后修饰过程也存在一些功能相似的酶发挥三萜骨架和甾醇骨架结构多样性的催化作用,对三萜生物合成途径关键后修饰酶的挖掘也可为甾醇生物合成途径的解析提供参考。
