肌肉电阻抗技术应用于神经肌肉疾病评估和机制研究进展*
2024-03-09郭杰承王翔李乐
郭杰承,王翔,李乐
(西北工业大学 医学研究院,西安 710072)
0 引言
神经肌肉疾病是指神经和肌肉之间传递功能出现障碍引起的疾病,包括脊髓前角和背根神经节、神经肌肉接头以及肌肉本身[1]。对临床医生和研究人员而言,及时诊断这些疾病并评估恶化情况和治疗效果是面临的主要挑战之一。临床实践中常用于肌肉形态评估的技术包括磁共振成像(magnetic resonance imaging,MRI)、计算机断层扫描(computed tomography,CT)、双能X线吸收仪(dualenergy X-ray absorptiometry,DXA)和超声成像(ultrasonography)。虽然这些工具可提供可靠和准确的形态学信息,但临床应用受复杂的操作程序、数据分析和费用的限制[2-5]。此外,这些因素也增加了与其他动力仪器(如力矩测力计)同时结合使用的难度[6]。面对上述限制,越来越多的研究人员将目光投向肌肉电阻抗(electrical impedance myography, EIM)技术,以寻找评估肌肉状态的新方法。表1总结了不同评估方式的优缺点。

表1 不同评估方式的优缺点
1 肌肉电阻抗
EIM是一种特定的测量生物阻抗的技术,可以提供有关肌肉组成和结构的详细生理数据。肌肉的电导率(通过电流的能力)和介电常数(存储电荷的能力)特性在肌肉功能发生障碍时会有所改变,导致测量电压发生变化[7]。因此,EIM是通过将低强度、高频率电流经皮肤表面施加于待测肌肉,由测量到的电压与已知电流模型化分析计算肌肉阻抗,从肌肉组织对电流顺应性和阻抗性等电生理情况评估肌肉健康状况的一种新技术[8](见图1)。该方法可帮助诊断和跟踪疾病的损伤程度,评估疾病的康复情况,且不会诱发肌纤维或神经元的动作电位。EIM与传统的生物电阻抗(bioelectrical impedance analysis, BIA)的测量与分析方法有所不同。BIA主要是全身人体组成成分或重点是脂肪含量测试,大多用于营养学研究[9],而EIM全部电极位于局部肌肉,着重分析肌肉组织对变频电流通过的响应情况。
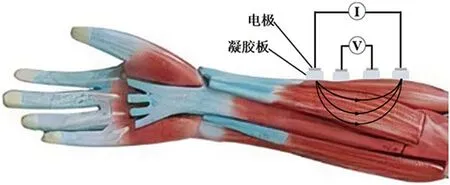
图1 EIM原理示意图
EIM中三个主要参数为电阻(R),电抗(X)和相位(θ)。其中,R可以反映肌肉组织(包括肌内、肌外细胞)对电流的阻抗作用,X主要反映肌细胞膜对电流的通透性影响,而θ是R与X的反正切计算结果,与肌肉内纤维排列和走向有关,具体计算如下[10]:
θ=arctan(X/R);
(1)
(2)
在过去的20年中,出现了各种EIM测量方法。早期方法是应用现成的阻抗系统或用于身体成分测量的生物阻抗系统,将粘性电极手动放置在感兴趣的肌肉上[11],并应根据被测肌肉的大小适当选择电极尺寸和电极间距,以实现 EIM 测量所需的可重复性[12]。经过一系列发展,现在此技术取得了巨大的改进(见图2),多种便携式EIM测量设备已被用于临床评估[13]。
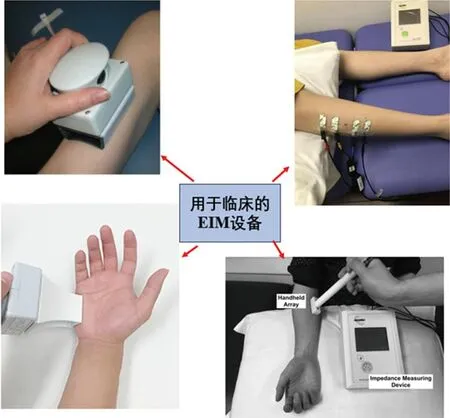
图2 用于临床的EIM设备
2 EIM用于评估神经肌肉疾病进展
神经肌肉疾病的产生可能是由于大量的炎症细胞和水肿,以及脂肪和结缔组织沉积。另一方面,神经源性肌病主要与严重的肌纤维萎缩和纤维类型相关(见图3),主要表现为运动单位减少,肌纤维类型改变,肌肉体积的减少,炎性水肿,肌纤维间脂肪组织堆积,结缔组织堆积,肌纤维被破坏,肌纤维排列紊乱[14]。最终,这些特性将以不同的方式共同作用影响阻抗值。EIM 技术已被初步应用于评估肌萎缩性侧索硬化(amyotrophic lateral sclerosis ,ALS),脊髓性肌肉萎缩(spinal muscular atrophy ,SMA),以及杜氏肌肉营养不良(Duchenne muscular dystrophy, DMD)等病症[15-17]。这些研究发现,EIM可反映肌肉萎缩情况(包括肌内脂肪与肌肉组织比例),以及肌肉内的肌纤维走向和排列(各向异性),肌细胞膜完整性等变化,并与疾病的进展有显著性相关[18-19]。同时,最新研究进展发现,应用不同频率下的电流(1 kHz~8 MHz)经过肌肉组织后的频谱响应也能在一定程度反映肌肉内部特性改变[20]。
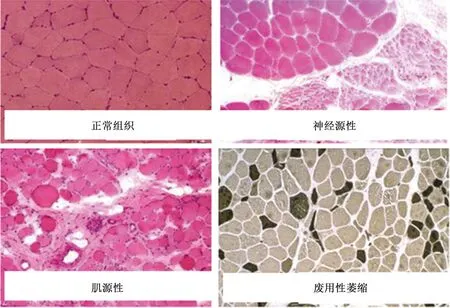
图3 神经肌肉疾病后肌肉的机构或组成的改变
2.1 神经源性疾病
2.1.1肌萎缩侧索硬化症 ALS是一种运动神经元疾病,肌肉无力、肌肉萎缩和痉挛是其常见症状[21],目前无有效治疗方法。EIM用于评估ALS病情发展的一个主要优势是其能灵活、准确地应用于病情恶化部位。因此,易评估多个肢体。Rutkove在2002年首次报道了关于EIM用于跟踪ALS损伤程度的研究,证实该技术在50 kHz时对ALS患者的病情发展具有很高的敏感性,可作为评估ALS损伤程度有效指标[22]。虽然50 kHz下的EIM研究较多,但一项研究证明了100 kHz可作为测量ALS患者舌部EIM相位值的最佳频率。该项研究打破了过去EIM局限于50 kHz频率下的数据采集模式[23]。多频EIM也能评估ALS的损伤程度,一项临床研究采用2~300 kHz的多频EIM评估ALS患者的病变肌肉,证明了多频EIM也可作为临床上评估ALS损伤程度的一项工具[24]。但与单频采集相比,多频采集的信息更复杂,信噪比低,不易重复。
除了临床研究,EIM同样在动物实验方面应用广泛。有研究证实EIM具有应用于ALS鼠模型的能力,以及它与患病状态下的标准电生理学和功能测量密切相关,包括复合运动单位动作电位波幅、运动单位数量估计[25-26]。最近一项研究将多频EIM应用于患有ALS的不同年龄的小鼠,证明了通过使用非侵入性表面EIM和预测模型,可以实现对受ALS影响的肌肉病变的合理评估,包括肌纤维萎缩程度和肌纤维大小[27]。
2.1.2脊髓性肌萎缩症 SMA是儿童中最常见的神经肌肉疾病之一。研究表明,EIM具有区分患有Ⅰ型SMA的儿童与健康儿童的潜力,同时可以在这两组非常年幼的儿童之间评估EIM随时间的变化情况[28]。这些结果证实了EIM可准确地对SMA患者进行分类。另一项临床的纵向研究表明,在健康儿童中,50 kHz阻抗相位会随着时间的推移而逐渐增加。相比之下,SMA儿童中的EIM相位值随时间的推移表现出相对稳定的趋势[29]。
此外,EIM在SMA动物模型中也有相应研究。一项对患有轻度SMA小鼠模型的研究发现,健康小鼠与SMA小鼠在50 kHz的频率下与所测得的复合肌肉动作电位(compound muscle action potential,CMAP)具有非常高的差异性[30]。Rutkove等[31]通过分析EIM结果与CMAP和运动单位数的相关性,首次表明EIM的相位和电抗对严重SMA小鼠模型中的药物作用都很敏感,具有评估治疗效果的潜力。
2.1.3脊髓损伤(spinal cord injury,SCI) SCI患者容易出现肌萎缩、挛缩和脂肪浸润,导致身体活动受限[32]。研究发现SCI后,肌肉的电抗和相位值会降低,电抗降低可能与细胞膜的损伤有关,该恶化不仅限于生理上的恶化,还指控制穿过细胞膜的离子的流动能力。相位值的降低可能与细胞体积减小,肌肉中结缔组织增多有关。研究证实SCI后肌肉的各向异性(纵横比)也会降低,这可能是由于肌纤维萎缩和相关的脂肪组织浸润造成的[33]。Hu等[34]研究发现SCI患者肌肉力学参数均显著低于健康人。这项研究证明了肌张力计与EIM技术相结合评估SCI患者肌肉力学特性和肌肉成分改变的可行性。EIM的变化可间接反映肌肉细胞大小、脂肪和结缔组织的改变。此外,多频EIM研究显示,与健康对照相比,SCI组的对数阻力回归斜率降低[35]。这说明了EIM变化与损伤后的遗传性肌肉变化有关。
2.1.4EIM用于评估脑卒中患者 脑卒中长期以来一直受到关注,特别是在运动功能恢复方面。运动的控制不仅依赖于神经通路的完整性,还依赖于肌肉骨骼系统的功能[36]。因此,评估肌肉功能对于了解脑卒中后运动功能障碍的潜在因素至关重要。
研究发现,脑卒中后上肢肌肉的电抗及相位角均较健侧明显下降,电阻电抗的各向异性比小于健侧,说明肌纤维细胞数量或细胞膜面积减少,反映了痉挛肌肉的结构、成分和膜完整性异常[37]。
与其他评估方法的结合将促进EIM在临床评估中的应用。在亚急性脑卒中幸存者中,EIM与超声肌肉成像联合应用可提高对肌肉结构评估的准确性。虽然超声记录的肌纤维长度、厚度和羽状角被认为可说明脑卒中后损伤中的肌肉状态,但EIM对于肌肉结构变化评估的灵敏度高于超声肌肉成像。与单个测量数据相比,来自EIM和定量超声的复合数据可更好地预测肌肉功能[38]。由于皮下脂肪组织对电阻抗数据的影响很大,Li等[39]在超声辅助下深入研究皮下脂肪对EIM的影响,并找到了适当的电极配置来减少影响,结果表明,当借助超声波的机械性能辅助EIM时,电抗受皮下脂肪的影响最小。通过超声对肌肉形态学评估可指导EIM的应用,以提高测量结果的准确性和稳定性。
卒中后的神经肌肉改变情况比较复杂,即有肌肉萎缩导致肌力减弱,也可能出现因为牵张反射兴奋性增高所致的以速度依赖性肌肉张力增高为特点的痉挛。从电阻抗参数层次可提供相关肌肉神经电生理变化信息,与超声肌肉形态信息结合探讨肌肉结构变化对肌力以及运动功能的影响机制以及对康复效果的评估效应,值得进一步深入研究。有证据表明,EIM记录的电抗与肌张力计的蠕变和弛豫时间显著相关,其中肌肉粘度与相位角显著相关[34]。这些发现提示可以从生理结构角度解释力学性能变化。
功能性电刺激(functional electrical stimulation,FES)和脚踏车训练是用于改善慢性卒中幸存者运动功能的常见康复措施。Hu等[40]研究发现下肢运动功能的改善与肌肉阻抗特性的增加(肌内脂肪消耗、更规则的肌纤维排列等)、更高的肌肉激活能力以及踝关节运动时更好的肌肉协调性有关,证明了EIM和肌电图在联合评估卒中患者下肢肌肉功能和评估康复训练在临床环境中的影响方面的潜力,并且解释了同时评估主动和被动肌肉特性,可以促进对肌肉功能障碍的理解。在随后的一项研究中,使用EIM检测FES和脚踏车训练的即时效果,结果发现,训练后肌肉阻抗特性的改变与临床评分呈正相关,运动功能较高的卒中幸存者可能比运动功能水平较低的卒中幸存者进行循环时,肌肉收缩更随意,表明卒中后的残余运动功能可能在FES联合脚踏车训练后肌肉内在特性改变中发挥作用,该研究证实了EIM评估FES联合联合训练提供的即时训练效果的可行性[41]。
痉挛是脑卒中患者经常出现的临床症状[42],并且一直是康复医学研究的热点。Li等[43]将EIM应用于卒中痉挛后对肉毒毒素注射前后的即时效应分析, 发现EIM参数确有变化。然而其改变机制及对肌肉功能的影响尚不清楚。Leng等[44]通过应用被动关节力矩测量结合生物力学建模、肌肉强度测量和EIM来评估脑卒中后肌肉痉挛的神经和外周因素,并研究了体外冲击波(extracorporeal shock wave,ESW)干预对肌肉痉挛和上肢功能的影响。结果发现,在脑卒中幸存者受影响和未受影响的腕关节之间观察到几个因素和机械参数的显着差异;ESW干预后,生物力学特征参数(即肌张力、僵硬、弹性和粘度)和电阻抗参数显着改善,尤其是在治疗后立即产生效果。这项研究提示可使用EIM评估卒中后肌肉痉挛。
2.1.5腕管综合症(carpal tunnel syndrome,CTS) EIM的另一个潜在应用是CTS,这是最常见的压迫性神经病变[45]。Li等[46]应用一种方便实用的手持式EIM微孔不锈钢电极,评估CTS患者的手肌肉。结果发现,CTS患者受累拇短外展肌的EIM值低于健康受试者。该研究表明,微结构电极具有较低接触阻抗的优点,并且包括此类电极的手持式探头为在健康和患病肌肉状态下进行EIM测量提供了一种省时且可重复的方法。提示EIM作为受CTS影响的肌肉的敏感性生物标志物具有相当大的潜力。
2.2 肌源性疾病
2.2.1杜氏肌营养不良症 DMD是一种治疗选择有限的严重疾病[47]。近年来EIM在评估DMD的应用中有大量研究。Rutkove等[48]提出EIM在50 kHz测量出来的相位能够区分DMD儿童和健康儿童,并且在DMD患者中,平均EIM相位测量值与标准功能测量值具有良好的相关性。该研究表明,EIM可作为评估DMD的严重程度的一项新技术。由于EIM受皮下脂肪影响较大,阻碍了评估DMD严重程度的准确性,Geisbush等[49]利用肌肉和脂肪的不同频率依赖性,证明了50/200 kHz频率EIM相位比可以消除皮下脂肪的影响。EIM对所有年龄段、卧床和非卧床男孩的DMD疾病严重程度都很敏感,而且对类固醇治疗效果也很敏感[50]。
研究发现在DMD小鼠模型中,EIM电阻和电抗值较低,且EIM值与实际结缔组织含量相关[51]。在另一项研究中,这种关系也在MRI T2信号强度的结果中得到了验证[52]。
2.2.2面肩肱型肌营养不良症(facioscapulohumeral muscular dystrophy,FSHD) FSHD是最常见的肌营养不良症之一,可导致进行性运动功能丧失[53]。2016年的一项报告提示EIM是评估FSHD肌肉成分的可靠方法,提供了连续评估受影响肌肉证据[54]。此外,Hamel等[10]通过分析EIM测量结果与MRI结构特征之间的关系,发现FSHD患者的EIM电抗值与MRI异常程度相关,该研究巩固了EIM应用于FSHD的理论基础。由于EIM可灵活地用于床边评估病变肌肉,因此在FSHD中具有良好的应用前景。
2.2.3炎症性肌病 特发性炎症性肌病是一组异质性、获得性肌肉疾病,其特征是肌肉炎症、无力和其他肌肉外在表现[55]。Tarulli等[56]发现炎症性肌病的肌肉EIM相位值较低,证实了EIM可以检测炎症性肌病患者的肌肉炎症。最近的一项研究使用EIM测量包涵体肌炎患者和健康受试者,发现在包涵体肌炎患者中,阻抗值减小,证明了EIM可以检测包涵肌炎患者肌肉的变化,并且测量结果与标准的临床结果量表相关[57]。此外,一项将EIM用于评估肌肉炎症的动物研究表明,低频EIM对注射λ-carrageenan所诱导的肌肉炎症很敏感,并且有可能作为一种不需要活检就能量化炎症的存在和程度的简单方法[58]。
2.2.4肌少症 大多数老年人在执行日常任务时往往肢体不灵活,这是由与年龄相关的肌萎缩、虚弱和肌肉质量下降造成的。这种与年龄相关的肌肉系统的退化通常被称为“肌少症”,或者解释为年龄相关的病理性骨骼肌功能缺陷[59]。Aaron等[60]发现股四头肌和胫骨前肌的EIM在50 kHz相位与年龄增长之间具有相关性,从60岁开始出现明显的快速下降。他们纵向检查了4名老年人的肌肉状况,结果显示,随着时间的推移(3~5年),所有受试者所测得的相位值都伴随着神经肌肉状况的下降而显着减少。在后续实验中发现老年人下肢的电抗和电阻值比年轻人低,而上肢变化无显著差异。这表明与上肢相比,衰老会导致下肢肌肉形态和功能更明显的退行性变化[61]。
2.2.5废用性萎缩 骨骼肌形态和生理的变化在很大程度上受身体需求的支配,较重的负荷会导致肌细胞肥大,而不活动会导致废用性萎缩[62]。Tarulli等[63]对一组踝关节骨折患者进行了6至8周无负重后不久的胫骨前肌测量,以研究EIM评估因废用导致的肌肉萎缩的可行性。发现在所有患者中,胫骨前肌的50 kHz EIM相位增加,这表明EIM具有评估患者病情恢复的能力。相关的基础研究发现在废用性萎缩的狗中,随着疾病的恶化,相位值逐渐下降。这项研究表明,100 kHz EIM相位值对废用性萎缩肌肉很敏感,可作为评估废用性萎缩的一项工具[19]。此外,一项对大鼠进行后肢悬吊的研究结果与在人类身上看到的结果一致。置于悬吊环境下的大鼠多频EIM相位下降,将大鼠置于正常条件两周后,仅部分大鼠多频相位恢复,平均仍比基线低[64]。
3 EIM用于评估慢性腰痛(chronic low back pain,CLBP)
CLBP是一种多因素疾病,在全球发达国家的终生患病率为75%~84%。腰椎旁肌(lumbar paraspinal muscles,LPM)在CLBP患者的脊柱稳定中很重要[65]。Wang等[66]研究发现,无论使用的电流频率如何,CLBP和健康人群的双侧LPM的电特性都不同。这可能表明CLBP患者的LPM具有较少的肌肉纤维,脂肪浸润或结缔组织增加,并且细胞膜未受损,但其振荡特性发生了变化。这表明EIM具有探索CLBP患者LPM的电特性的能力。
4 总结与展望
鉴于EIM的高可重复性且无需患者操作,其可能成为一种替代肌肉标准功能测量手段的可靠方法。然而,根据具体的临床应用,仍有大量的工作需要完成,包括改进测量和分析方法。虽然EIM可以作为评估肌肉状态的技术,但在实践中,EIM可能会受皮肤和皮下脂肪的影响。因此,需要进一步研究通过改善电极特性(如尺寸、电极间距、排列和材料),来减少非肌肉组织的影响,以优化EIM对肌肉状态的敏感性。其次,阻抗对肌肉结构进行成像可以更直观地显示患病肌肉成分的空间分布,以帮助肌肉疾病的活检定位。因此,在未来EIM可逐渐成为临床医生和研究人员所青睐的一项用于神经肌肉病变的评估技术。
