细胞外囊泡分析方法*
2024-03-09杨立敏李景虹
杨立敏,李景虹
(1. 青岛农业大学 化学与药学院,青岛 266109;2. 清华大学 化学系,北京 100084)
0 引言
细胞外囊泡(extracellular vesicles, EVs)是细胞分泌的磷脂双层囊泡,主要分为外泌体、微囊泡和凋亡小体[1]。目前,“外泌体”常用于指小EVs的混合群体。根据国际细胞外囊泡协会的命名建议,本文使用“EVs”表示不同的囊泡。EVs富含来源于亲本细胞的生物活性成分,包括脂类、蛋白质和核酸等信息,是细胞间通讯的载体,在不同的生理病理过程中发挥着重要作用[2]。EVs广泛分布于大多数体液中,是液体活检的有效生物标志物之一,可用于非侵入性疾病诊断和治疗效果监测,对疾病诊断及预后监测具有重要价值[3]。因此,对EVs及其携带生物分子(蛋白质、核酸分子)的分析已成为近年的研究热点。
本文综述了基于抗体或核酸适配体的EVs及其表面蛋白质的高灵敏、高特异性检测新方法;基于传感探针直接递送或膜融合介导传感探针递送的EVs内部核酸的原位、准确检测新策略。最后对该领域未来的发展方向进行了展望。
1 EVs直接分析
EVs是液体活检的重要生物标志物之一,其直接分析有利于非侵入性疾病的早期诊断。基于抗体和核酸适配体能够特异性识别EVs这一特性,研究者们提出了一系列生物传感新方法用于EVs高灵敏、高选择性检测。
1.1 基于抗体的EVs分析方法
抗体可特异性地识别并结合抗原,且对核酸酶降解具有抵抗力,已广泛应用于生命科学研究、医学诊断和疾病治疗中。Song等[4]发展了一种基于表面分子印迹技术的人工磁性胶体抗体用于EVs的快速分离和检测(图1(a)),实现了血浆中EVs的灵敏检测。Jin等[5]利用上转换纳米粒子的光学性质和全内反射荧光成像技术的背景消除特性,实现了单一EV的检测,见图1(b)。Lu等[6]将免疫金银染色技术和泊松分布统计相结合,实现了无需细胞计数的高通量单一EV分析。Song等[7]结合智能手机开发了一种快速、灵敏、便携的生物传感器用于EVs的定量检测,见图1(c)。
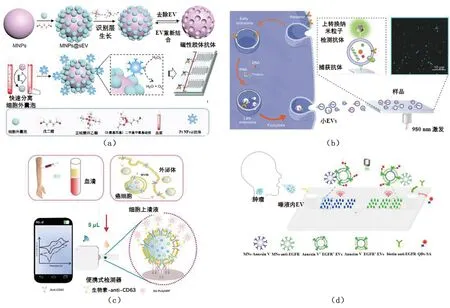
图1 基于抗体的EVs分析方法
为解决临床EV检测面临的样品制备费力和检测通量有限等问题,Lee等[8]构建了一种用于从血浆中快速分析肿瘤EVs的集成磁电化学装置,样品处理简单,无需对EVs进行纯化,实现了高通量检测EVs。针对EVs的高度异质性,Zhang等[9]基于磁性纳米微球和荧光标记技术,提出了一种简单的微流控方法用于检测两种不同蛋白表达的EVs表型,见图1(d)。Shi等[10]报道了一种简便的纳米流体活检测定方法,通过双特异性生物标记抗原共识别和捕获策略,实现了对目标肿瘤EVs的准确检测。
体液中含有高浓度的EVs,但也存在细胞碎片、水溶性或脂溶性代谢物和蛋白酶等干扰物。相比之下,眼泪不含这些干扰物,可认为是一种“更清洁”的液体。建立无需样品预处理的泪液内EVs检测方法,实现简便、快速、高灵敏直接检测泪液的EVs,对患者进行诊断可能会更方便[11-12]。
1.2 基于核酸适配体的EVs分析方法
利用核酸适配体对EVs表面蛋白的特异性识别,是实现EVs表面蛋白质检测的有效途径[13]。Luo等[14]基于DNAzyme触发的组装和去组装系统,通过普通离心方式即可实现EVs高效分离和精确定量,见图2(a)。Wu等[15]提出了一种流动多价磁界面用于肿瘤EVs的高效分离、超灵敏检测及蛋白质组学分析。Zhu等[16]开发了一种两性离子电致化学发光传感界面,实现了免标记检测EVs,见图2(b)。
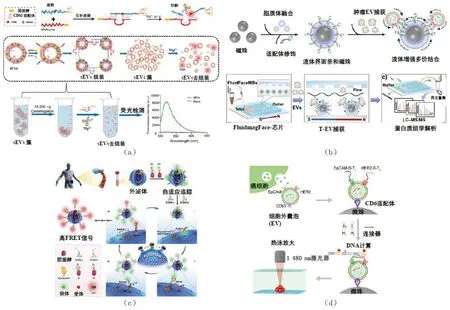
图2 基于核酸适配体的EVs分析方法
将EVs识别与核酸信号放大策略结合是提高EVs检测的有效途径。Yang等[17]开发了一种基于三维(3D)DNA机器联合机器学习算法的新策略,实现了EVs的稳定、高灵敏检测。Wang等[18]以靶标EVs作为3D轨道,以分裂适体作为识别元件,开发了一种自助式跟踪的DNA行走器,通过EVs糖蛋白分析实现了免清洗、准确检测肿瘤EVs,见图2(c)。
热泳技术利用温度梯度下EVs的定向移动,高效地提取纯化操作等过程,有利于实现EVs的简单、快速检测。Sun等[19]研究了一种热泳介导的DNA计算装置用于肿瘤EVs的检测,见图2(d)。进一步将双适体识别、聚乙二醇增强EVs热泳累积和EVs膜上的AND门操作结合,建立了一步热泳AND门操作分析方法,无需复杂的样品制备与预处理,实现了在15 min内的EVs直接检测[20]。
2 EVs表面蛋白质分析
EVs表面蛋白反映母细胞的信息,可区分不同的EVs亚群。开发EVs表面蛋白质的精准定量分析方法,准确解析EVs蛋白异质性和含量,对于疾病的诊断与病情评估具有重要意义。
2.1 基于抗体的EVs表面蛋白质分析
EVs表面多种蛋白质检测可提供更多的分子信息。Revzin等[21]提出了一种电化学免疫分析方法(图3(a)),实现了EVs表面两种蛋白质标志物的定量检测。Li等[22]基于微阵列的夹心免疫分析,开发了一种简单、灵敏的方法用于EVs表面蛋白质的多重检测。Chen等[23]研究了纳米等离子体夹心免疫分析方法,实现了EVs表面程序性死亡配体1(PD-L1)的快速、高灵敏检测。Qiao等[24]制备了磁性捕获探针用于高效EVs的捕获和释放,实现了原位一步高通量筛选EVs PD-L1。Kelley等[25]提出了一个纳米级细胞检测平台NanoEPIC,可对血浆中的sEV进行表型分选和sEV PD-L1分析,对单个sEV具有高分辨率能力,见图3(b)。
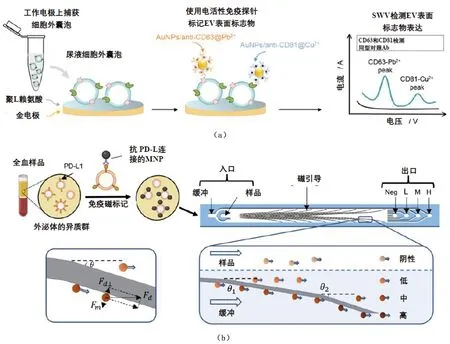
图3 基于抗体识别的EVs表面蛋白质分析
EVs表面单分子标志物表达水平分析有利于鉴定EVs异质性表型。Ko等[26]提出了一种无液滴的高灵敏、双数字分析方法,实现了单个EV中绝对定量单个分子。基于双成像单囊泡技术,可实现单个EV表面蛋白分析和目标特异性EV亚型的量化[27]。Weissleder等[28]提出了一种基于抗体的免疫测序方法,可从单个EVs中对蛋白质分子进行多重测量。
2.2 基于核酸适配体的EVs表面蛋白质分析
利用核酸适配体能够特异性识别蛋白质这一特性,研究者们提出了多种基于核酸适配体的EVs表面蛋白质分析方法。Zhou等[29]基于可编程的DNA电路提出了一种荧光生物传感方法,实现了EVs表面PD-L1灵敏、准确测定。Liu等[30]建立了新型比率型电化学分析方法用于EVs表面蛋白质的高灵敏检测,见图4(a)。Ye等[31]设计了一种具有多重限制结构的微流控芯片用于EVs的分离富集用于EVs表面蛋白表达量分析。
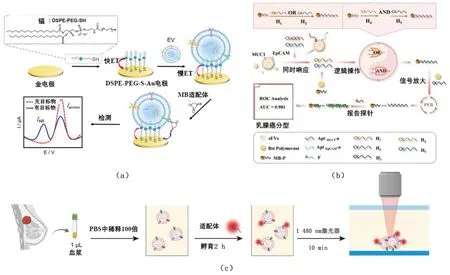
图4 基于核酸适配体的EVs表面蛋白质分析
通过多种适配体同时识别多种蛋白质,可建立EVs表面多种蛋白质同时检测方法[32]。基于聚合酶驱动的逻辑信号放大系统,Zhang等[33]建立了sEV表面蛋白质特异性和超灵敏检测新方法,见图4(b)。基于滚环扩增辅助的流式细胞术方法,可同时识别和分析4个EVs蛋白标志物的细微差别[34]。
大多数EVs表面蛋白质分析方法需要将EVs进行分离与富集,该过程繁琐耗时,建立高灵敏、快速、低成本检测新方法,无需EVs分离提取等操作是EVs相关研究的重点与热点[35]。Sun等[36]利用微流控热泳富集及核酸适体识别技术,无需EV分离提取等操作,实现了多种EV膜蛋白的高灵敏、快速、低成本检测。利用热泳适体传感器分析血浆EV的癌症相关蛋白谱,结合机器学习算法,发现8个EV蛋白标记的加权总和可准确识别转移性乳腺癌,见图4(c)[37]。
3 EVs核酸原位检测方法
EVs内部核酸的原位检测可有效避免传统方法繁琐的分离与提取步骤,且可防止核酸降解产生的影响,具有高精准性。为实现EVs核酸原位检测,通常采用直接递送或膜融合方式将传感探针递送至EVs内部。
3.1 基于传感探针直接递送的检测策略
DNA纳米探针可直接进入EVs,且能够将传感探针限制在局部浓度较高的紧凑空间中,从而提高EVs内核酸检测的反应速度与灵敏度[38]。为增加传感探针在DNA纳米结构上的数量,Cao等[39]制备了多分支DNA结构,实现了高灵敏度检测EVs内miRNA。单一荧光信号易受复杂生物基质的干扰,产生假阳性信号,研究基于荧光共振能量转移的方法可有效避免此问题,提高检测准确度[40]。此外,Li等[41]设计合成了一种双加速DNA级联放大器纳米结构用于EVs原位、超快和灵敏成像,见图5(a)。
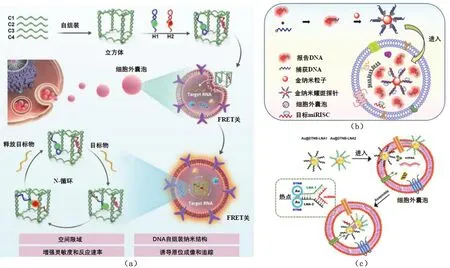
图5 基于传感探针直接递送的原位检测EVs核酸策略
基于Au纳米颗粒的球形核酸探针在EVs原位检测方面备受关注[42]。Duan等[43]发现Au纳米耀斑探针能够直接进入EVs,且荧光信号增加,实现人血浆EVs中miRNA原位检测,见图5(b)。基于Au纳米探针研发的表面增强拉曼散射策略,可实现原位定量EVs内miRNA,见图5(c)[44]。
3.2 基于膜融合方式递送传感探针的检测策略
传感探针直接内化进入EVs的效率有限,可能会影响检测结果。利用脂质体与EVs膜融合策略,将其装载的传感探针递送至EVs内,是原位检测EVs内部核酸的另一有效途径。EVs表面带有负电荷,制备正电荷表面的脂质体便可通过静电作用介导二者发生膜融合,将传感探针递送进入EVs内部,实现EVs核酸的原位检测[45-46]。
在脂质体和EVs上分别修饰核酸,通过拉链式DNA杂交也可有效介导膜融合,将传感探针递送至EVs内,可缩短反应时间,提高检测效率,见图6(a)[47]。EVs具有高度异质性,不同EVs中miRNA的表达水平差异较大,将识别EVs标志物的变构适配体探针作为输入单元构建正交条形码,利用智能脂质体探针,可实现肿瘤EVs亚群追踪及其miRNA原位分型[48]。

图6 基于膜融合方式递送传感探针的原位检测EVs核酸策略
受到自然囊泡运输的启发,Yang等[49]开发了一种核酸适体介导的选择性融合策略,用于原位检测肿瘤EVs内miRNAs,见图6(b)。此外,Li等[50]基于癌细胞仿生囊泡特异性靶向同源肿瘤细胞分泌的EVs,见图6(c),实现了循环EVs内源RNA标志物分选。
4 总结与展望
EVs携带丰富的核酸、蛋白质和脂质等生物分子,与多种疾病的发生和发展密切相关,是液体活检的生物标志物之一。EVs及其携带生物分子的分析与研究有利于实现非侵入性疾病早期诊断和疗效监测。随着对EVs生理和病理作用研究的不断深入,开发EVs分析新方法的需求持续增长。EVs携带的核酸与蛋白质等分子可能因其母细胞类型和病理生理状态而有很大差异。复杂生物流体中的循环EVs可能成为多种疾病的诊断、预后和疗效监测的潜在生物标志物。因此,发展简单、快速、高灵敏度、高选择性的分析方法,实现复杂生物样品中EVs的高效分离与富集,进一步对其携带生物分子进行原位、准确分析,可为探索其生理学功能提供重要的参考信息。总之,EVs及其携带生物分子的分析研究将有助于实现疾病的精准诊疗。
