基于cytb和rag2基因探讨叶须鱼属分子系统进化关系
2024-03-09陈鲆曾如奎杨德英哈西罗文杰徐丹刘飞秦云鑫熊金鑫丁文祥黄俊杰刘日唐子婷何智严太明
陈鲆,曾如奎,杨德英,哈西,罗文杰,徐丹,刘飞,秦云鑫,熊金鑫,丁文祥,黄俊杰,刘日,唐子婷,何智,严太明
(1.四川农业大学动物科技学院,成都 611130;2.长江上游鱼类资源与环境四川省野外科学观测研究站,成都 611130;3.雅砻江流域水电开发有限公司,成都 610051)
叶须鱼属(Ptychobarbus)是鲤形目、鲤科、裂腹鱼亚科中的一个类群,是伴随着青藏高原隆起而逐渐进化形成的特化等级裂腹鱼类。叶须鱼属起源于更新世早期,到中更新世其祖先种逐步消亡[1]。目前,世界上已报道了5种叶须鱼属鱼类,包括中甸叶须鱼(Ptychobarbus chungtienensis)、双须叶须鱼(P.dipogon)、裸腹叶须鱼(P.kaznakovi)、修长叶须鱼(P.leptosomus)和锥吻叶须鱼(P.conirostris)。其中,中甸叶须鱼仅在小中甸河和碧塔海水域中有发现[2],已被列入《中国物种红色名录》,等级为濒危(EN)[3];双须叶须鱼分布于雅鲁藏布江中游干支流中,为当地重要的经济鱼类之一[4];裸腹叶须鱼分布于怒江、澜沧江、金沙江水系,被列入《中国物种红色名录》,等级为易危(VU)[3]。修长叶须鱼是张春光团队于2019年认定的新种[5],现知仅分布于雅砻江上游干流及支流。锥吻叶须鱼产于我国西藏阿里狮泉河和噶尔河,分布于印度河和赫尔曼德河上游各支流[6],为产区主要经济鱼类之一[7]。由此可以看出,叶须鱼属鱼类的分布范围十分局限,而它们的亲缘关系如何目前尚不清楚。
依据形态学特征对叶须鱼属不同种进行鉴定中发现,中甸叶须鱼、裸腹叶须鱼及修长叶须鱼在形态上极为相似[5],仅能从下唇分叶程度、体长/体高等[5]外部特征的细微不同进行区分,故容易造成鉴定结果出现较大差异[8]。而随着分子生物学技术的不断发展和进步,筛选合适的分子标记开展物种鉴定,并结合传统形态分类学的结果,将有助于确定物种分类地位的有效性[9-11]。同时利用分子标记也可以进一步分析物种的起源进化关系。有鉴于此,有必要筛选叶须鱼属鱼类种间鉴定的分子标记,并开展其分子系统进化关系分析。
线粒体细胞色素b(cytochrome,cytb)基因具有进化速度较快、易扩增等优点,通常用于确定物种间的遗传关系[12-14]。核基因重组激活基因(recombination activating genes,rags)在脊椎动物中普遍存在,不同物种之间其碱基组成变化较少,在进化过程中非常保守,故近年来已广泛运用于脊椎动物进化和亲缘关系分析[15-18]。目前,常联合cytb和rag2基因分析鱼的种系发育遗传关系。Zhang R.Y.等[19]利用cytb和rag2等基因分析裸鲤属3种鱼的系统地理演化发现,这3种鱼的系统发育和形态学分析结果与演化收敛或逆转过程最为相容。同时,Chen W.T.等[20]利用cytb和rag2等基因对澜沧江裂腹鱼(Schizothorax lantsangensis)、光唇裂腹鱼(S.lissolabiatus)和云南裂腹鱼(S.yunnanensis)的遗传多样性分析后发现,其种群分化与青藏高原更新世晚期的造山运动有关。由此可以看出,采用cytb和rag2基因研究叶须鱼属分子系统进化关系是可行的。有鉴于此,本文扩增了5种叶须鱼的线粒体cytb基因序列,以及修长叶须鱼和裸腹叶须鱼的rag2序列,并基于此分析了物种间的系统发育关系和种内的遗传多样性水平。本研究结果为叶须鱼属内物种的分类提供分子标记,也能为该属内物种保护措施的制定提供科学依据。
1 材料和方法
1.1 实验材料
依据《中国动物志》和《四川鱼类志》等资料,开展渔获物的形态学鉴定,获得叶须鱼属鱼类30尾,并采集鱼的部分鳍条用于总DNA的提取。其中,中甸叶须鱼(BTH 1~ BTH 10)样本由中国昆明动物研究所提供,采自云南省香格里拉市碧塔海;裸腹叶须鱼样本(OQ 1~ OQ 10)采集自金沙江一级支流偶曲白玉县河段;修长叶须鱼样本(XSH 1~XSH 10)采集自雅砻江一级支流鲜水河炉霍县河段。另外,38条叶须鱼属鱼类cytb基因序列均来自于GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/)。样本及序列信息详见表1。
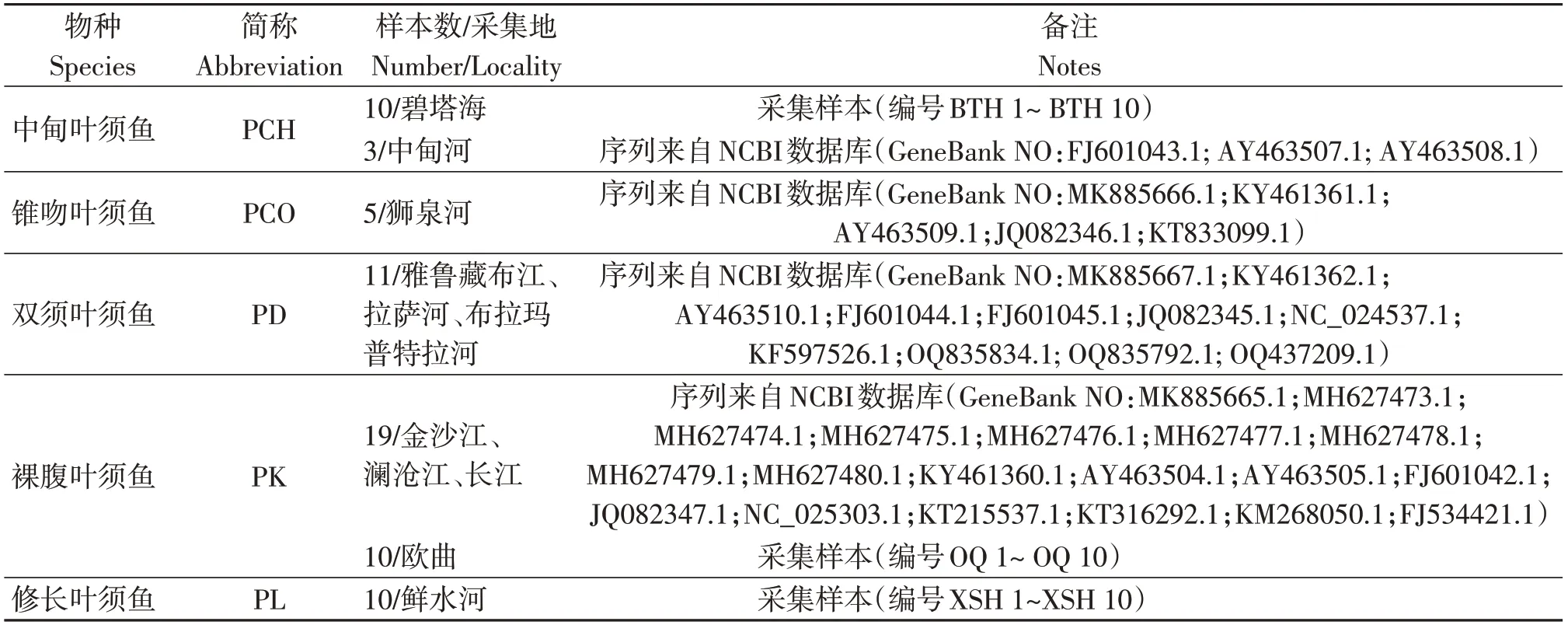
表1 采集样本信息及cytb序列信息表Table1 The cytb sequences of four species in Ptychobarbus from GenBank database
1.2 DNA提取、扩增及测序
采用动物组织基因组DNA提取试剂盒(离心柱型)(X0907,Tiangen BiotechCo., Ltd.)提取鳍条基因组总DNA。采用超微量核酸分析仪检测DNA浓度,同时采用琼脂糖凝胶电泳检测DNA的完整性。使用已报道的引物扩增叶须鱼属cytb基因(上游引物:5′-GACTTGAAAAACCACCGTTG-3′,下游引物:5′-CTCCGATCTCCGGATTACAAGAC-3′)[21]。根据叶须鱼属5个物种rag2基因共有保守区域,采用primer 5.0进行设计,上游引物:5′-GGCTGCGTGCC ATTTCAT-3′,下游引物:5′-GTAGGGCTCCCAGGT GTT-3′。PCR反应体系均为30.0 μL,包括2×Taq PCR Master Mix 15.0 μL,DNA模板3.0 μL,上下游引物各1.5 μL,双蒸水(ddH2O)9.0 μL。PCR反应条件为:94 ℃预变性2 min;94 ℃变性1 min,55 ℃退火30 min,72 ℃延伸1 min,然后循环34次,最后在72 ℃下延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳检测后,用凝胶成像系统照相观察,并将有目的条带的PCR产物送往成都擎科梓熙生物技术有限公司进行测序。
1.3 数据分析
使用DNAstar软件将测序获得的序列拼接后,用MegAlign进行基因序列人工比对。用MEGA_11.0.13分析序列的核苷酸组成、群体内和群体间遗传距离。同时,使用MEGA_11.0.13和MrBayes 3.1分别构建NJ(Neighbor-Joining Method)和贝叶斯(BI)系统进化树。用DNASP 5.0软件将群体分组,统计各物种中单倍型的分布、数量和多样性,计算突变位点和核苷酸多样性等。使用Arlequin 3.5软件计算遗传分化指数(Fst)和基因流(Nm)后,用SPSS21.0进行显著性检验(P<0.05)。为更好地反映叶须鱼属鱼类的遗传分化情况,基于cytb的单倍型,用popArt 1.7软件构建单倍型网络图。
2 结果与分析
2.1 cytb基因多态性分析
统计分析结果表明,获得的68个叶须鱼属鱼类样本cytb基因序列全长为1 034 bp,不存在插入或缺失位点,共检测到154个变异位点,占核苷酸总数的14.9%。其中,包括了11个单一多态位点(Singleton variable sites, NS)和143个简约信息位点(Parsimony informative sites, NPi)(表2)。碱基组成分析显示,T、C、A和G的平均含量分别为29.8%、29.0%、24.1%和17.0%,A+T含量(54.0%)高于G+C含量(46.0%)。
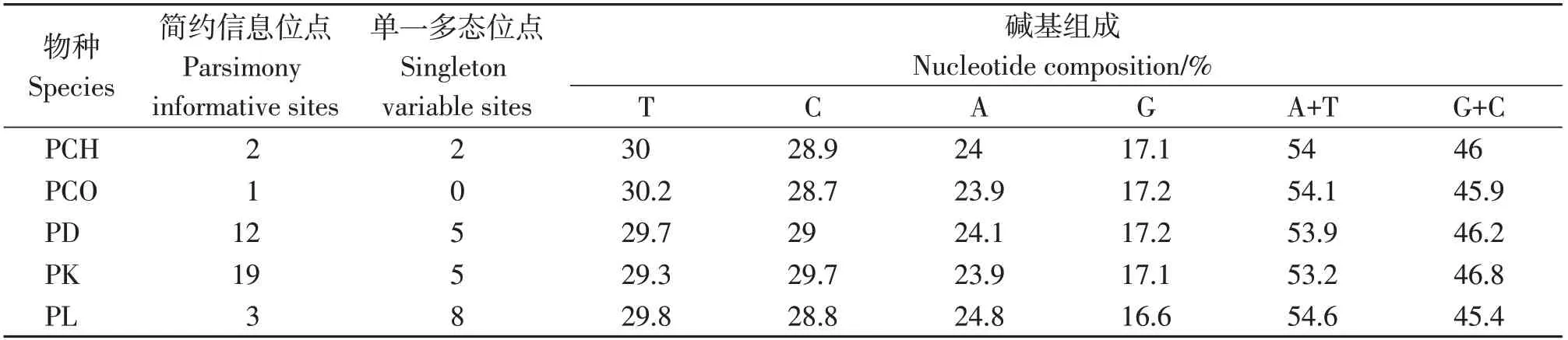
表2 cytb 基因多态性分析Table 2 Analysis of cytb polymorphism
2.2 基于cytb基因分析叶须鱼属系统发育关系
以齐口裂腹鱼的cytb序列作为外群,构建的NJ和贝叶斯(BI)系统进化树拓扑结构一致(图1)。进化树分析结果显示,裸腹叶须鱼和中甸叶须鱼聚为一支,而修长叶须鱼、双须叶须鱼及锥吻叶须鱼形成另外一个较大的分支。其中,采自雅砻江一级支流鲜水河炉霍县河段的XSH1~XSH10样本与修长叶须鱼聚为一支,采自云南省香格里拉市碧塔海的BTH1~BTH10样本与中甸叶须鱼聚为一支,而金沙江水系欧曲白玉县河段OQ1~OQ10样本与裸腹叶须鱼聚为单独的一支。由此可以得出,基于cytb基因序列的分析结果与形态鉴定结果完全一致,该分子标记能较好地区分叶须鱼属的各物种。

图1 基于线粒体cytb基因序列构建的叶须鱼属鱼类BI及NJ系统进化树Figure 1 Construction of BI and NJ phylogenetic trees for the genus Ptychobarbus based on mitochondrial cytb gene sequences
2.3 叶须鱼属cytb基因遗传多样性分析
遗传多样性分析发现,修长叶须鱼单倍型多样性最高(Hd=0.956),有8个单倍型;锥吻叶须鱼单倍型多样性最低(Hd=0.600),含2个单倍型。裸腹叶须鱼核苷酸多样性最高(Pi=0.007 51),中甸叶须鱼苷酸多样性最低(Pi=0.000 17)。双须叶须鱼和裸腹叶须鱼的平均核苷酸差异系数(k=6.073,7.734)明显高于其他物种,尤其是锥吻叶须鱼(k=0.600)、中甸叶须鱼(k=1.154)和修长叶须鱼(k=2.667)(表3)。这些结果表明,叶须鱼属鱼类各群体间遗传多样性大小差异较大,提示各物种间遗传变异程度差异较大。

表3 叶须鱼属5个物种遗传多样性参数Table 3 Genetic diversity index in five groups of Ptychobarbus
单倍型网络图显示,中甸叶须鱼共检测出4个单倍型(Hap-1、Hap-2、Hap-3和Hap-4),锥吻叶须鱼共检测出2个单倍型(Hap-5和Hap-6),双须叶须鱼共检测出7个单倍型(Hap-7~Hap-13),裸腹叶须鱼共检测出13个单倍型(Hap-14~Hap-26),修长叶须鱼共检测出8个单倍型(Hap-27~Hap-34),不同物种之间无共享单倍型。不同物种的单倍型构成一个支系,其中有一个支系包括修长叶须鱼和锥吻叶须鱼群体2个亚支(图2)。这些结果表明,叶须鱼属鱼类为5个独立的进化支系。

图2 基于cytb序列的叶须鱼属单倍型网络结构图Figure 2 Structure diagram of cytb sequence haplotype network of Ptychobarbus
2.4 基于cytb基因分析叶须鱼属物种的遗传结构
种间遗传距离分析结果表明,叶须鱼属鱼类物种间遗传距离位于0.019 7~0.083 8之间,已达到种的分化水平(表4)。其中,中甸叶须鱼和双须叶须鱼种间的遗传距离最大(D=0.083 8),裸腹叶须鱼和中甸叶须鱼种间的遗传距离最小(D=0.019 7)。双须叶须鱼和裸腹叶须鱼种内存在较弱的遗传分化,遗传距离均为0.01。
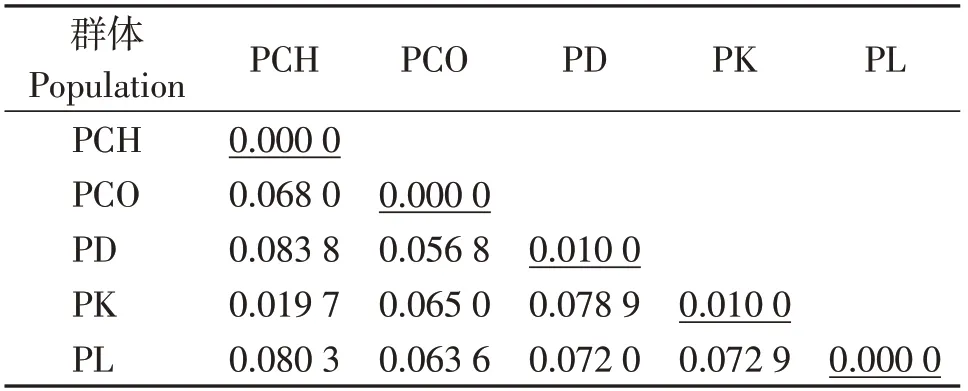
表4 叶须鱼属5个物种种间和种内的遗传距离Table 4 Genetic distance of interspecific and intraspecific differences in five species of Ptychobarbus
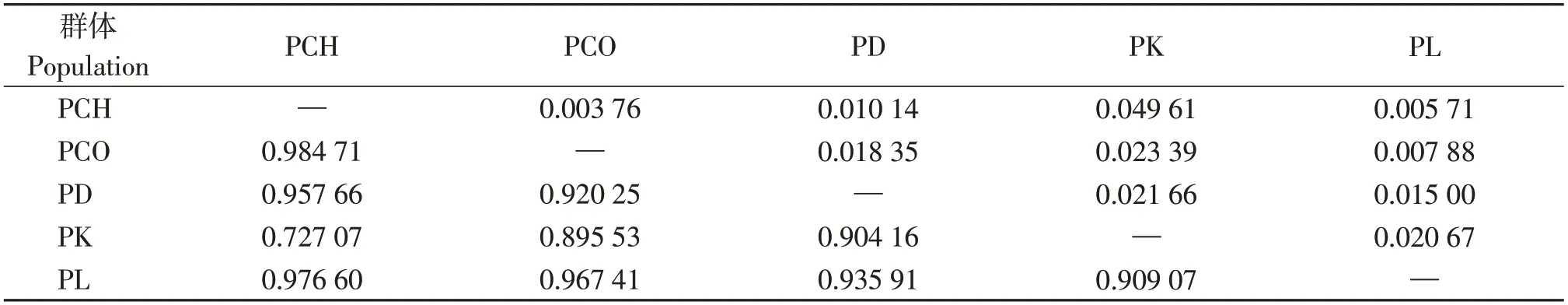
表5 叶须鱼属5个物种种间遗传分化指数(Fst)及基因流(Nm)Table 5 Pairwise fixation index Fst and gene flow Nm of interspecific and intraspecific differences in five species of Ptychobarbus
5种叶须鱼种间的遗传分化系数(Fst)及基因流(Nm)分析显示,Fst介于0.727 07~0.984 71(表6)。其中,中甸叶须鱼与锥吻叶须鱼种间遗传分化系数最大(Fst=0.984 71),中甸叶须鱼与裸腹叶须鱼种间Fst最小(Fst=0.727 07)。5种叶须鱼种间的Nm值大小为0.003 76~0.049 61。其中,中甸须叶须鱼和锥吻叶须鱼的Nm值最小(Nm=0.003 76),中甸叶须鱼与裸腹叶须鱼的Nm值最大(Nm=0.049 61)。表明5种叶须鱼种间分化较大,基因交流较弱。
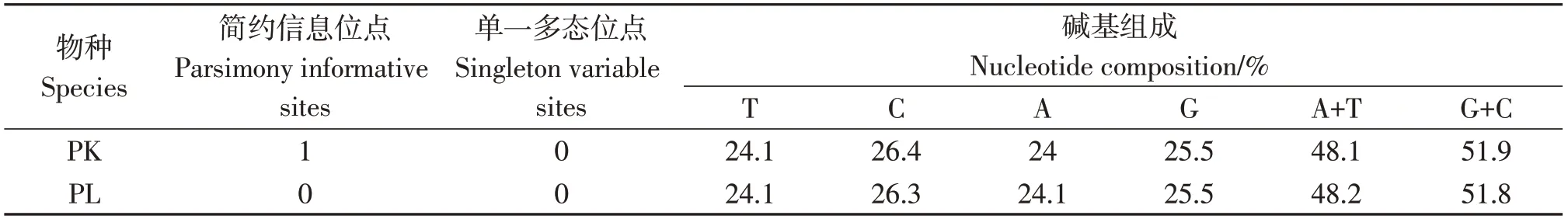
表6 rag2 基因多态性分析Table6 Analysis of rag2 polymorphism
2.5 裸腹叶须鱼及修长叶须鱼rag2基因多态性分析
对采集自金沙江流域的裸腹叶须鱼(10尾)和雅砻江流域的修长叶须鱼(10尾)进一步开展了rag2基因序列分析。共获得20条rag2基因序列,全长为949 bp。在裸腹叶须鱼群体内检测到1个简约信息位点,未检测到单一多态位点。T、C、A、G的平均含量分别为24.1%、26.4%、24.0%和25.5%,G+C含量(51.9%)高于A+T含量(48.1%)(表6)。而在修长叶须鱼群体内未检测到简约信息位点和单一多态位点。T、C、A、G的平均含量分别为24.1%、26.3%、24.1%和25.5%,G+C含量(51.8%)高于A+T含量(48.2%)(表6)。
2.6 基于rag2基因分析裸腹叶须鱼及修长叶须鱼系统发育关系
基于种间遗传距离,以软刺裸裂尻鱼为外群,构建了裸腹叶须鱼及修长叶须鱼rag2基因的NJ和BI系统进化树。结果表明裸腹叶须鱼和修长叶须鱼被明显地分开,分别单独聚为一支,这与cytb分析得到的结果一致(图3)。
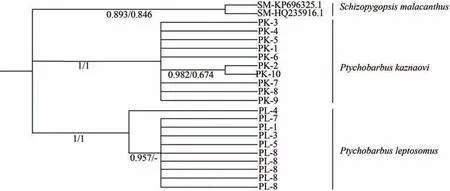
图3 基于rag2基因序列构建的裸腹叶须鱼及修长叶须鱼BI及NJ系统发育树Figure3 Construction of BI and NJ phylogenetic trees for Ptychobarbus kaznakovi and P.leptosomus based on rag2 gene sequences
3 讨论与结论
3.1 分子标记的筛选和确证
目前,线粒体cytb基因被广泛应用于物种鉴定、分子进化、系统地理学和遗传结构研究[22-25],且与核基因rag2常被联合用于鱼类种系发育关系的分析,如裸鲤属3种鱼的系统地理学分析[19]、裂腹鱼类的种群进化分析[20]。这些结果表明,cytb与rag2能用于物种有效性的确定。
本研究中,基于线粒体cytb基因构建了5种叶须鱼的系统进化树。裸腹叶须鱼和中甸叶须鱼聚为一大支,修长叶须鱼、双须叶须鱼及锥吻叶须鱼形成一个较大的分支,修长叶须鱼和锥吻叶须鱼形成一个小的分支。这一结果表明,cytb基因能够将5种叶须鱼从分子层面区分开。rag2基因也能将裸腹叶须鱼和修长叶须鱼能够区分开来,与cytb分析得到的结果一致。由此可以得出,基于cytb与rag2的序列特征,能较好地对叶须鱼属鱼类进行区分。
3.2 叶须鱼属鱼类遗传距离分析
遗传距离大小反映了种间亲缘关系的远近,遗传距离越大物种间遗传分化越大[26]。Y.P.Kartavtsev[27]提出cytb基因在种内的基因遗传距离水平在0.005~0.015之间,而本研究中5种叶须鱼属鱼类物种间的遗传距离变动于0.019 7~0.083 8,这表明其已达到种的分化水平。同时,本研究发现中甸叶须鱼与裸腹叶须鱼遗传距离最小(D=0.019 7),从分子层面证实中甸叶须鱼与裸腹叶须鱼亲缘关系最近。这与陈宜瑜等[1]通过形态特征分析,提出中甸叶须鱼和裸腹叶须鱼是一对具有很近的共同祖先的姐妹种的结论是一致的。中甸叶须鱼历史上分布于金沙江流域的小中甸河、那亚河、碧塔海、属都湖和纳帕海,本次采集样本来自金沙江一级支流硕多岗河的支流[5],而裸腹叶须鱼主要分布在金沙江、澜沧江、长江,本次样本采集自金沙江上游一级支流偶曲。这表明,中甸叶须鱼与裸腹叶须鱼种间的亲缘关系与地理位置有较大关联。这些结果符合地理较近的物种有更近的亲缘关系的说法[28]。
此外,中甸叶须鱼与双须叶须鱼遗传距离最大(D=0.083 8),表明中甸叶须鱼与双须叶须鱼亲缘关系较远,可能与其分布的地理位置和海拔气候有关。双须叶须鱼是分布于雅鲁藏布江中游支流拉萨河和布拉玛普特拉河的特有鱼类[29],种群聚类地位相对独立,并且分布海拔较高,较远的地理隔离导致中甸叶须鱼与双须叶须鱼亲缘关系较远。这些结果进一步从分子层面证实,叶须鱼属是伴随着青藏高原的隆起而逐渐进化形成的特化等级裂腹鱼类。
3.3 叶须鱼属鱼类遗传多样性水平
遗传多样性是生物进化和适应环境的基础[28]。物种遗传多样性越丰富,对环境变化的适应能力就越强[30],而遗传多样性的缺乏对生活在不平衡生态环境中的生物是一个巨大的威胁[31]。单倍型多样性(Hd)及核苷酸多样性(Pi)是衡量种群遗传多样性水平的重要指标[32-33]。W.Grant和B.Bowen[34]在沙丁鱼(Sardina pilchardus)和凤尾鱼(Coilia mystus)的研究中发现,若单倍型多样性(Hd)高于0.5且核苷酸多样性(Pi)低于0.005,这表明该种群的遗传多样性水平低,可能是受瓶颈效应影响后,种群快速扩张所致。本研究结果显示,修长叶须鱼、中甸叶须鱼以及锥吻叶须鱼遗传多样性水平符合高单倍型多样性(Hd>0.5)低核苷酸多样性(Pi<0.005)的遗传模式,推测可能是一个较小的种群在快速进化过程中,种群数量增加的同时单倍型多样性也在提高,但没有时间使得核苷酸发生变异[35]。而双须叶须鱼和裸腹叶须鱼则呈现出高单倍型多样性高核苷酸多样性的遗传模式。这些结果表明,叶须鱼属鱼类存在较大的遗传分化。
3.4 物种有效性鉴定
多年来,叶须鱼属鱼类的分类问题一直是分类学家争论的焦点,特别是中甸叶须鱼、裸腹叶须鱼和修长叶须鱼。张春光等[5]对修长叶须鱼做出了描述,认为修长叶须鱼与中甸叶须鱼在形态上十分相似,但它是区别于裸腹叶须鱼及中甸叶须鱼的有效种,并鉴定为新种。2020年,郭延蜀等在《四川鱼类原色图志》中指出,修长叶须鱼应是中甸叶须鱼的同物异名[8]。
遗传分化系数是反映物种间遗传分化程度的另一个重要指标。根据闫春梅等[36]关于细鳞鱼4个群体遗传多样性分析研究的解释,0.25 了解鱼类的遗传结构和物种多样性现状,有助于开展其种质资源评估[23],进而为其保护策略的制定等提供基础资料[37]。中甸叶须鱼、修长叶须鱼和锥吻叶须鱼遗传结构表明其进化潜力较低,对环境变化的适应能力很弱,存在着较大的灭绝风险。因此,应对修长叶须鱼、中甸叶须鱼和锥吻叶须鱼优先采取保护措施。而双须叶须鱼和裸腹叶须鱼均是高单倍型多样性、高核苷酸多样性的遗传结构,表明其是由一个大而稳定的种群经过了较长的历史演化而来,对环境变化的适应能力较强,具有较大的遗传选育潜力,更容易扩展其分布范围和开拓新的环境[38]。因此,在保护叶须鱼属鱼类种质资源的过程中,应优先对中甸叶须鱼、修长叶须鱼和锥吻叶须鱼开展保护工作。 综上,本研究通过线粒体cytb基因序列分析了叶须鱼属鱼类分子系统进化关系,研究结果支持叶须鱼属鱼类分化为明确的5个物种;基于核基因rag2的分析结果表明金沙江流域的裸腹叶须鱼以及雅砻江流域的修长叶须鱼也达到了种的分化水平。双须叶须鱼和裸腹叶须鱼的遗传多样性高于其他3种叶须鱼属鱼类,应优先对中甸叶须鱼、修长叶须鱼以及锥吻叶须鱼开展保护工作。以上结果均表明,基于cytb和rag2基因可作为叶须鱼属种间的分子标记,本研究结果为该属内物种分类鉴定、保护措施的制定等提供理论基础和科学依据。3.5 种质资源管理和保护建议
