铜死亡相关基因在肝细胞癌中的生物信息学分析*
2024-03-08唐梅文刘文健邹起平
周 玲 唐梅文 刘文健 邹起平
1.广西中医药大学第一附属医院脾胃肝病科 (广西 南宁,530000) 2.广西中医药大学研究生院
肝细胞癌(HCC)是全球第五大常见恶性肿瘤,死亡率居第2位。且发病率正在持续增长,无论男性还是女性,发病率都比任何其他癌症上升得更快。全球疾病负担研究的一项系统分析表明,HCC的发病率和死亡率均居前10位癌症之列,成人肝硬化死亡是HCC死亡的主要原因。肝癌的发生是一个多步骤且复杂的生物学过程,其中许多信号级联发生改变,导致分子谱异质化,并最终导致肿瘤发生、进展和转移[1]。且超过一半的肝癌患者在确诊时已处于晚期,只有15%的患者适合根治性治疗,由于缺乏诊断的生物标志物,患者5年生存率仍然很低,不超过20%[2]。近年来,许多研究表明,多种基因和细胞通路参与了HCC的发生和发展[3]。为更好地揭示HCC与铜死亡之间的联系,本研究旨在对多组数据进行系统研究,通过生物信息学分析确定其对HCC的预后价值和治疗意义。HCC数据和临床信息来自癌症基因组图谱(TCGA),我们在癌变样本和正常样本之间鉴定HCC相关的差异表达基因(DEG),并先后进行GO富集分析、KEGG通路分析、生存分析和免疫功能相关分析,以探索与HCC密切相关的关键基因和通路。为探究HCC发生、发展过程中的分子机制及可用于临床诊疗的分子生物学靶点提供可靠的理论依据。
1 材料与方法
1.1 数据的获取与处理 数据来源从TCGA数据库(https://portal.gdc.cancer.gov/)下载HCC的转录组数据及相应的患者临床信息,其中患者的临床信息主要包括生存时间、生存状态、年龄、性别、等级、阶段、T阶段、N阶段和M阶段。我们初步筛选了424例患者的转录组数据,其中正常50例,肿瘤374例。
1.2 铜死亡相关的LncRNAs的筛选 本文通过R软件构建LncRNAs和铜死亡相关基因之间的共表达,即为铜死亡相关的LncRNAs。其筛选标准为:相关系数r≥0.4,P<0.001,筛选出的结果用桑基图进行可视化。
1.3 铜死亡预后相关LncRNA模型的构建 首先通过单因素Cox回归分析、Kaplan-Meier生存分析和无进展生存期得到与HCC预后相关的铜死亡LncRNA(筛选的标准为P<0.05)。初步筛选与HCC患者预后有关的LncRNA;再次进行LASSO回归,进一步筛选分析以减少数据的过度拟合,筛选关键且与铜死亡相关的LncRNA,LASSO回归使用交叉验证进行参数的选择,并绘制LASSO回归系数谱,最后进行多因素Cox回归分析建立对HCC预后有价值的铜死亡相关LncRNA模型并以列线图形式展示。根据多因素Cox回归分析构建LncRNA的风险评分公式为:风险评分=∑ (相应系数×LncRNA的表达量)。
1.4 预后模型的验证 通过Kaplan-Meier分析收集多个数据集中高低分线组之间的生存曲线,并绘制Kaplan-Meier曲线1、3、5 年的受试者操作特征(ROC)曲线、风险热图以及风险打分等评估该模型预测患者生存的能力,然后将风险文件与临床数据合并后进行独立预后分析,证明该模型是否可以独立于其他临床性状,作为HCC患者的独立预后因子,最后通过临床因素的风险评分对临床数据进行统计分析。
1.5 GO和KEGG富集分析 GO富集分析涵盖生物学的三个方面:生物过程(BP)、分子功能(MF)和细胞成分(CC)。使用KEGG对交集基因进行信号通路富集分析。在本研究中通过org.Hs.eg.db R语言包获得每个DEG的Entrez-ID后,进行GO和KEGG分析,并使用clusterprofiler、enrichment plot、ggplot2和circize R语言包对富集结果进行可视化。
1.6 肿瘤突变负荷(TMB)差异分析和生存分析 我们计算了每位患者的TMB,并将总患者按TMB阈值中值分为低TMB组和高TMB组,我们发现低TMB组肿瘤突变负荷高于高TMB组,随后用R语言包分析HCC患者TMB差异和生存相关在高低风险组之间是否具有差异,进行可视化。
1.7 筛选疾病的潜在药物 通过“pRRophetic”R语言包计算药物的敏感性,可以将药物的敏感性分为高低风险两组,然后将风险文件与药物敏感性的结果合并进行药物敏感性分析,进行可视化。
2 结果
2.1 铜死亡预后相关LncRNA模型的构建 通过基因共表达分析,共得到375个铜死亡相关LncRNA,并以桑基图展示(图1A)。单因素Cox回归分析(过滤标准P<0.05)初步筛选出50个HCC患者预后相关的LncRNA,并森林图形式展示(图1B)。再将初筛变量进行LASSO回归进一步筛选分析以减少数据的过度拟合,筛选出对预后更有价值的铜死亡相关的LncRNA,并绘制LASSO回归(图2C)及交叉验证(图2D)。然后进行多因素Cox回归分析筛选出4个与HCC患者有预后价值的铜死亡相关LncRNA(MKLN1-AS、AC073254.1、WAC-AS1、KDM4A-AS1)。绘制4个与铜死亡相关的LncRNA相关性热图(图2E) 用4个铜死亡相关 LncRNA构建HCC预后预测模型。风险评分方程:风险评分=(MKLN1-AS×1.287 682 473 548 62)+(AC073254.1×1.515 551 816 468 45)+(WAC-AS1×0.482 971 564 313 088)+(KDM4A-AS1×1.300 495 879 398 59)。
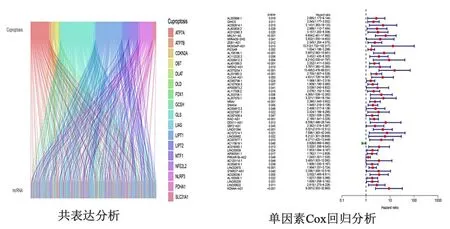
图1 HCC中铜死亡相关LncRNA
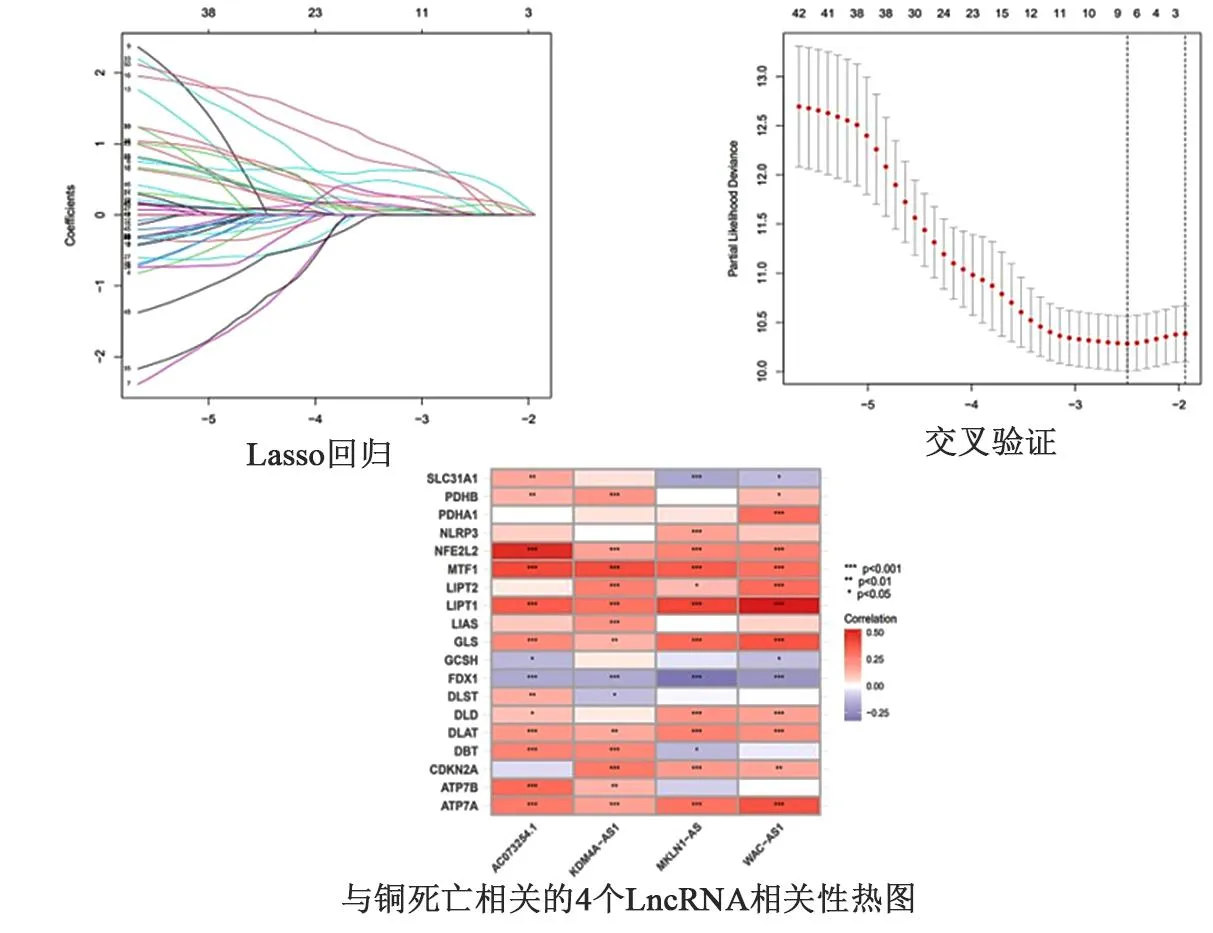
图2 对HCC预后更有价值的铜死亡相关LncRNA
2.2 预后模型的验证 首先对模型中的50个LncRNA进行单因素回归分析并绘制生存曲线,其次对高低风险两组进行生存差异分析。同时为验证我们构建的模型是否适用于不同临床分组的患者,我们将患者分为早期(图3A)和晚期(图3B),说明我们构建的模型不但适用于早期的患者也适用于晚期的患者。通过Kaplan-Meier生存曲线(图4A)、风险评分图(图4B~D)、生存状态图(图5A~C)、风险热图(图6A~C)结果显示随着风险评分的增加,患者的死亡率逐步上升,低风险组的总生存期明显优于高风险组,高低风险两组明显存在生存差异(P<0.001),风险评分对HCC患者的预后有显著影响。然后患者1、3、5年ROC曲线下面积分别为0.738、0.684、0.640(图7A、B)。说明该模型具有较好的预测生存能力。为了更好探究预后模型的临床价值,对风险评分与患者的临床数据(年龄、性别、分级、分期)进行单因素和多因素独立预后分析,单因素Cox回归显示年龄、性别、分级、分期及总风险评分是独立预后指标,而多因素独立预后分析显示年龄、性别、分级、分期及风险评分以独立于其他临床因素,作为HCC患者的独立预后因子。并且将风险评分纳入临床因素,绘制HCC患者的生存列线图,综合评分为527。1、3、5年的校准曲线分别是0.946、0.867、0.794,构建的模型的C-index是最大的(图9A~C)。最后,使用预后模型LncRNA、铜死亡LncRNA及 铜死亡基因构建的PCA分析表明:参与模型构建的LncRNA可以区分高低风险组的患者(图10A~D)。
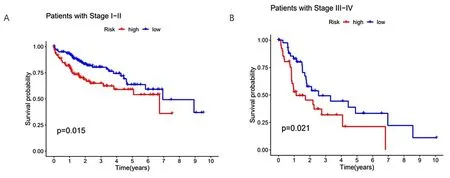
图3 不同分期HCC患者生存差异分析
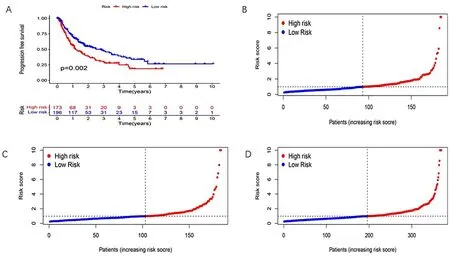
图4 高低风险组HCC患者生存曲线及风险评分分析
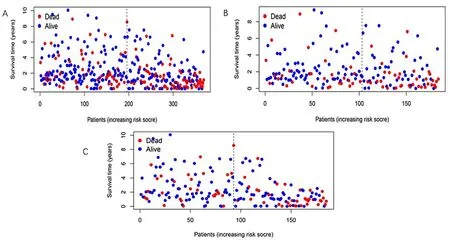
图5 高低风险组HCC患者生存状态分析

图6 铜死亡分型患者风险热图

图7 风险评分对HCC患者预后的影响
2.3 GO和KEGG富集分析 为了进一步分析与风险评分相关的生物学功能和途径,对高低风险两组间的DEGs进行GO和KEGG分析。GO富集分析结果显示铜死亡相关基因参与BP中细胞化学应激和氧化应激反应,在CC方面主要参与烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶复合体和次级溶酶体的构成,在MF方面与NADPH氧化酶活性有关(图8A、B)。KEGG分析显示高表达基因主要涉及铜死亡、癌细胞碳代谢、5-羟色胺能突触和VEGF信号通路等(图9A、B)。

图8 HCC患者铜死亡相关基因GO富集分析
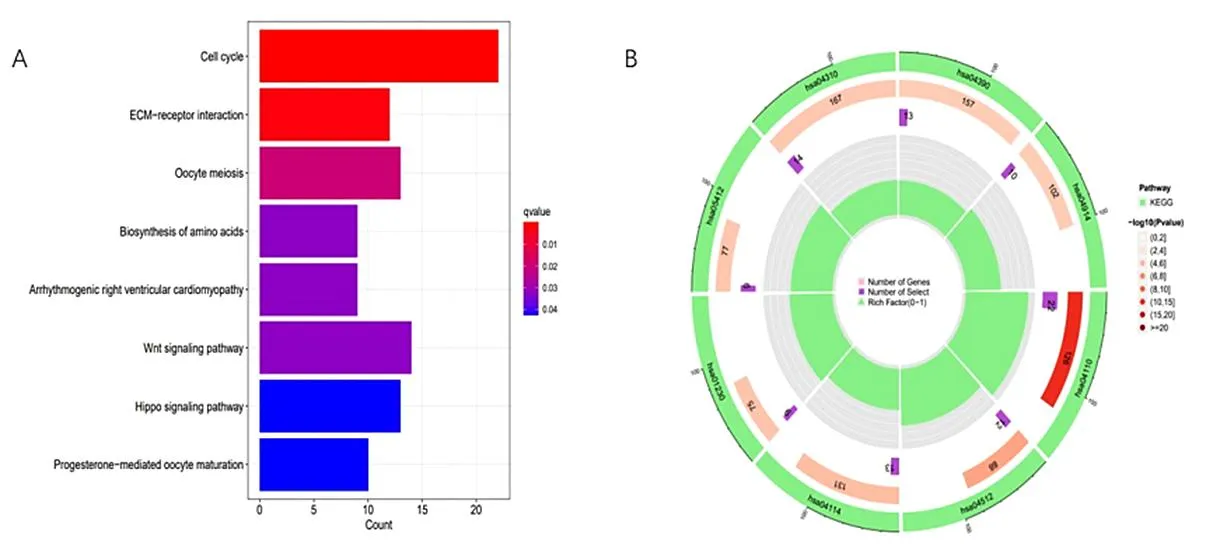
图9 HCC患者铜死亡相关基因KEGG分析
2.4 TMB差异分析和生存分析 为了进一步验证高低风险组患者的生存是否具有差异,将患者分为高风险组和低风险组,对两组进行生存差异分析,同时我们可以看到低风险组患者TMB更高(图10A)。通过TMB生存分析比较高低突变负荷组之间患者的生存是否具有差异就可以得到这样的生存曲线,将TMB与患者的风险进行联合的生存分析,我们就可以得到联合的生存曲线(图10B、C),可以说明高低风险组患者的生存具有差异及TMB与患者的预后相关。

图10 高低风险组HCC患者TMB差异和生存分析
2.5 筛选疾病的潜在药物 为验证高低风险两组患者之间药物敏感性是否具有差异及筛选治疗HCC的潜在药物,将患者分为高低风险两组,通过pRRophetic R语言包对药物敏感性进行循环,得到药物的敏感性,结果表明高风险组患者对药物更敏感,并从93个药物中筛选出4个最敏感药物作为潜在治疗药物的选择(图11A~D)。

图11 高低风险组HCC患者药物敏感性差异分析
3 讨论
HCC是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因,严重威胁我国人民的生命和健康。原发性肝癌(PLC)主要包括HCC、肝内胆管癌(ICC)和混合型肝细胞癌-胆管癌(cHCC-CCA)3种不同病理学类型,三者在发病机制、生物学行为、病理组织学、治疗方法以及预后等方面差异较大,其中HCC占75%~85%、ICC占10%~15%[4]。HCC是一个重大的全球健康挑战,全球发病率稳步上升[5],最常见的原因是慢性感染乙型肝炎病毒,世界上超过一半的HCC是由慢性乙型肝炎引起的[6]。HBV与HCC形成的关系很复杂。到目前为止HBV导致HCC的发病机制包括:HBV DNA整合到宿主基因组[7]、HBV编码蛋白对癌基因的反式激活、HBV诱导的慢性炎症和肝细胞再生等[8]。而且,每年仍然有都有大量肝硬化患者感染肝炎病毒进展为HCC,这大大缩短了这些患者的寿命。虽然已经进行了许多关于HCC的研究,然而,HCC的早期诊断和及时治疗仍然具有挑战性[9]。所以,仍然需要探索肝癌早期筛查方法和治疗的靶点,为HCC治疗提供了新的治疗方案。
铜死亡的提出,为我们探索铜死亡相关基因对HCC患者的治疗增添一种新的治疗手段方案。铜死亡是近期新发现的一种细胞死亡形式,其特征是细胞内游离铜积累,蛋白质脂化导致细胞毒性应激,从而诱导细胞死亡[10]。铜稳态的遗传变异导致危及生命的疾病[11],并且铜离子载体[12]和铜螯合剂[13-15]都被认为是抗癌剂。此外,铜诱导的细胞死亡也可能被天然合成铜离子载体的微生物利用,并且表现出抗菌活性,是铜通过靶向脂酰化循环蛋白诱导细胞死亡[10]。研究表明,与健康人相比,癌症患者的血清和肿瘤组织中的铜含量都明显升高[16,17]。虽然铜平衡失调可能引发细胞毒性,但细胞内铜水平的改变可能影响癌症的发展和恶化。我们的研究具有多重优势。首先,这项研究是第一个在铜死亡相关基因的基础上开发预后模型的研究,细胞死亡是肿瘤研究的一个密集领域,已被证明是癌症起源和发展的基础。铜死亡是一种新型的细胞死亡,与任何已知的细胞死亡机制不同,并且依赖于线粒体呼吸。这种不同寻常的机制可能会为癌症的治疗带来新的解决方案。此外,与大多数主要关注总生存期的预后模型相比,我们的研究还考虑了无进展生存期。无进展生存期增益可能表明肿瘤负荷减轻和症状缓解,特别是对于晚期癌症患者[18,19]。因此,本文针对铜死亡与HCC患者预后相关发病机制的研究进展,并确定更多的预后相关药物治疗。
本研究从TCGA数据库中得到375个与铜死亡相关LncRNA,根据相关分析结果和独立预后分析结果进一步筛选出了4个与HCC预后相关的铜死亡LncRNA。通过生存分析将所有患者分为高风险组和低风险组,采用Kaplan-Meier生存曲线分析两组的生存情况,结果显示患者的死亡率逐步上升,低风险组的总生存期明显优于高风险组(P<0.001),风险评分对HCC患者的预后有显著影响。本文通过ROC曲线分析结果显示,预后风险模型判断HCC患者1、3和5年ROC曲线下的面积分别为0.738、0.684、0.640;C-index曲线分析结果显示,预后风险模型判断HCC患者1、3和5年校准曲线分别为0.946、0.867、0.794。这表明本研究构建的铜死亡相关LncRNA预后风险模型可较准确地评估HCC患者的预后情况。本研究列线图分析结果显示,通过患者临床特征和风险进行评分,可准确评估患者的总体生存率,这些差异基因在高低风险组的生存期,无进展生存期、免疫相关功能分析、TMB生存率及药物敏感性是否是有差异的,对HCC患者的临床管理有一定的参考价值。根据我们的进一步分析,我们发现这4个基因与HCC预后密切相关。关于这4个基因,我们发现它们或多或少与病毒感染、细胞增殖和肿瘤发生有关。MKLN1-AS极大地抑制了HCC细胞在体外和体内的转移和生长[20]。它通过促进细胞增殖、迁移和侵袭,在体外抑制细胞凋亡,在HCC进展中发挥着致癌作用。此外,MKLN1-AS下调导致体内HCC肿瘤生长减少。总的来说,目前结果表明,MKLN1-AS作为癌基因在HCC中起着刺激作用[21]。WAC-AS1可以通过在缺氧条件下抑制糖酵解来抑制HCC细胞增殖[22]。它的下调抑制了HBV复制和自噬。它参与其他癌症的发生,其中包括卵巢癌[23]。KDM4A-AS1通过miR-411-5p/KPNA2/AKT轴促进了肝细胞癌的生长和转移[24]。AC073254.1目前尚未被研究发现,这将为我们进一步研究提供了新的治疗靶点,需要进一步研究证明及其潜在的临床价值,为HCC患者提供新的治疗思路以及有待进一步需要更多研究人员对其进一步探索。这些基因对HBV感染和HCC形成的机制还需要进一步探索。
这项科学研究探索了可以预测和分析HCC的铜死亡生物标志物,有助于癌症治疗探索。首先,我们证明了该特征在癌细胞突变、潜在药物治疗的选择和预测患者生存时间方面的潜在临床价值。其次,该特征也可能在其他癌症中具有良好的预测价值,需要进一步验证。此外,这项研究有几个局限性。该预后模型采用了TCGA数据库的回顾性数据,需要进一步的前瞻性研究来证明其临床价值。更多的基因表达及其与HCC患者临床特征的关系有待研究。未来应该揭示铜死亡的潜在机制。通过TCGA数据库挖掘到与HCC预后相关的4个铜死亡基因并构建了铜死亡相关LncRNA的预后风险模型,可对HCC患者的预后进行准确评估,该模型中的铜死亡基因为HCC靶向治疗策略提供了新的治疗靶点,这将为HCC患者的治疗和预后风险评估提供新的治疗思路。
