miR-126-5p 通过靶向TRAF3 抑制糖氧剥夺再灌注介导的HT22细胞凋亡和炎症
2024-03-08赵莉赵磊谢艾伶王亚梅吴雨娟唐爽
赵莉,赵磊,谢艾伶,王亚梅,吴雨娟,唐爽
遂宁市中心医院脑血管病科 四川省遂宁市,629000
神经元作为神经系统的基本单元,具有接收、处理和传递信息的功能,对缺氧缺血较为敏感,长时间的缺氧缺血会严重影响神经元的功能,引起神经系统功能紊乱和损伤[1]。再灌注是一种治疗缺氧缺血的有效手段,通常通过静脉注射补液、输血等方法来恢复血流量[2]。虽然再灌注可以帮助保护神经元,但治疗过程中大量血液进入脑组织,可能会引起再灌注损伤[2]。缺血再灌注与脑梗死病理生理密切相关,同时可以引起神经化学、生物化学和电生理等反应,最终导致细胞死亡和脑组织的病变[3]。如何有效弥补因脑缺血而导致的神经元损伤,以及缓解在再灌注过程中可能产生的氧化应激和神经炎症已成为众多学者的研究目标[4]。
近年来,在脑缺血再灌注治疗中,分子靶向治疗技术已经取得了不错的进展[4],其治疗方法包括针对特定分子或途径的药物[5]。microRNAs(miRNAs) 是一类长度为22~25 个核苷酸的短RNA 分子,通过与基因转录的mRNA 分子的3′非翻译区(3′ untranslated regions,3′UTR) 互补配对来影响基因的后转录调控[5-6]。如吴亚琨等[7]研究表明miR-30a可通过靶向调控Keap1 缓解大鼠脑缺血再灌注损伤。miR-126-5p是一种非编码miRNA,miR-126-5p的调控与多种疾病相关,如心血管疾病、肿瘤等[8]。近年来,有研究表明miR-126-5p在脑缺血再灌注损伤中可发挥一定的保护作用。例如,刘洋等[9]研究报道上调miR-126 表达可缓解脑缺血再灌注大鼠的脑损伤。miR-126-5p 过表达可降低缺血性脑卒中后促炎细胞因子和黏附分子的表达,减轻局部炎症反应,减轻脑卒中后血脑屏障的破坏。肿瘤坏死因子受体相关因子3 (tumor necrosis factor receptor-associated factor 3,TRAF3) 是一种炎症相关因子,可激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs) 和核因子κB (nuclear factor-kappa B,NF-κB) 信号通路,促进神经元凋亡,但目前有关miR-126-5p 对脑缺血再灌注损伤的调控作用及与TRAF3 的关系和分子机制还有待研究。
氧糖剥夺/复氧 (oxygen-glucose deprivation/reperfusion,OGD/R) 是一种常见的缺血缺氧细胞模型,用于模拟缺血再灌注的情况,该模型主要用于探究神经细胞损害机制的研究。本研究中,我们选择小鼠海马神经元细胞系HT22 作为实验对象,通过模拟缺血/再灌注(ischemia/reperfusion,I/R)损伤。损伤在体外建立OGD/R 细胞模型,探讨miR-126-5p对糖氧剥夺再灌注介导的HT22 细胞凋亡和炎症的影响机制,以期为缺血再灌注脑损伤的治疗提供靶点。
1 材料与方法
1.1 药物与试剂
HT22 细胞购自科佰生物公司;乳酸脱氢酶(lactate dehydrogenase,LDH) 试剂盒 (货号:ml094790) 购自酶联生物公司;胎牛血清(货号:WS500T) 购自缔一生物公司;四甲基偶氮唑盐(货号: 8028) 购自西安百萤生物有限公司;DMEM 培养基(货号: 10569-010) 购自浙江硕烨医疗器械有限公司;细胞计数试剂盒8 (Cell Counting Kit-8,CCK8) 试剂盒 (货号: E-CKA362) 购自Elabscience 公司;凋亡试剂盒(货号:40302 ES20) 购自翌圣生物公司;逆转录试剂盒(货号: K1622) 购自北京智杰方远公司;荧光定量RT-qPCR 试剂盒(货号: RT0411-01) 购自杭州主诺生物公司;双荧光素酶检测试剂盒(货号:11402ES80) 购自翊圣生物公司;miR-126-5p 模拟体和空载质粒购自上海吉玛制药技术有限公司;胰酶(货号: 8129-46-7) 购自武汉荣灿生物科技有限公司;GADPH 抗体(货号: JN22870)) 购自纪宁生物有限公司、肿瘤坏死因子受体相关因子3(tumor necrosis factor receptor-associated factor 3,TRAF3) 抗体(货号: PAB12954) 购自艾美捷科技公司;Bax 抗体(货号: 3032-100) 以及山羊抗兔二抗购自齐源生物公司;cleaved caspase-3 抗体(货号: 9664) 购自优宁维生物公司;Bcl-2 抗体(货号: YLS-K0078) 购自翊立飒生物公司。pcDNA3.1-TRAF3 购自吉满生物;pGL3 质粒购自伯远生物公司;GADPH 内参引物 (货号: B661104-0001) 均购自上海生工生物工程有限公司。脂质体转染试剂Lipofectamine 2000 (货号: GK20005)购自GlpBio 公司;二甲基亚砜(货号: D2650) 购自上海卡迈舒生物科技有限公司;磷酸缓冲盐溶液(phosphate-buffered saline,PBS) (货号: 180327) 购自武汉普诺赛生命科技有限公司。
1.2 仪器
MCO-5AC CO2培养箱购自山东欧莱博医疗器械有限公司;MH-2 型微型振荡仪购自广州越特科学仪器有限公司;DYCP-31DN 电泳仪购自北京鑫诺宸仪器仪表有限公司;TE70XP 半干电转膜仪购自美国hoefer 公司;ZF-258 凝胶成像仪购自嘉鹏仪器设备公司;RT-qPCR 仪购自济南千司生物技术有限公司;HBS-1096B 酶标仪购自南京德铁实验设备有限公司;Attune 流式细胞仪购自赛默飞公司。
1.3 细胞培养及诱导OGD/R 模型
将HT22 细胞在DMEM 培养基中培养,添加10 %的胎牛血清,1 %的青霉素和链霉素混合抗生素,置于37 ℃5 % CO2的培养箱中培养。采用胰酶对细胞进行消化传代。本研究中以对数期的细胞作为实验对象,构建OGD/R 模型。具体方法如下[10]: 采用PBS 清洗细胞,然后将细胞转入不含糖的DMEM 培养基,并置入氧含量为1 %、二氧化碳含量为5 %、氮气含量为94 %的培养箱中进行培养,持续6 h。随后,将细胞置于常规DMEM培养基中,并放入CO2培养箱中生长,持续24 h。OGD/R 构建结束后,HT22 细胞存活率明显下降,HT22 细胞的形态发生明显改变,如细胞体积缩小、细胞变圆或向外突出。这些结果表明建模成功[10]。
1.4 细胞分组与转染
取正常培养的HT22 细胞作为对照组,另取未经转染的OGD/R 诱导的HT22 细胞作为OGD/R组。在构建OGD/R 模型前,将NC-mimic、miR-126-5pmimic、miR-126-5pinhibitor、NC-inhibitor、NC-pcDNA、pcDNA-TRAF3 使用 Lipofectamine®2000 Reagent 转染到HT22 细胞中,分别作为mimic-NC 组、miR-mimic 组、miR-inhibitor 组、inhibitor-NC 组、pcDNA 组、pcDNA-TRAF3 组。然后按上述操作将NC-mimic、miR-126-5pmimic、miR-126-5pmimic+pcDNA、miR-126-5pmimic+pcDNATRAF3 进行转染后,构建OGD/R 模型,分别作为OGD/R+mimic-NC 组、OGD/R+miR-mimic 组、OGD+miR-mimic+pcDNA 组、OGD +miR-mimic +pcDNA-TRAF3 组。
1.5 RNA 分离以及RT-qPCR 检测
根据制造商说明,通过RNA 提取试剂盒对待测细胞进行RNA 分离提取,并依照说明书逆转录得到cDNA 链。通过RT-qPCR 仪以cDNA 链为模板进行扩增。反应条件如下: 94 ℃4 min;94 ℃32 s,62 ℃32 s,75 ℃3 min,共40 个循环。基因表达值以2-ΔΔCt法[11]计算,GAPDH作为内参基因。引物序列如下: miR-126-5p 正向序列: 5′-GGTATAATCCGCCGCTTAGCTGCC-3′,反向序列: 5′-GTGCAGGGTTGCAAGGT-3′;TRAF3 正向序列: 5′-CAGTGTGGTGGAATTCATGGACACCAGTAAGAAGACA-3′,反向序列: 5′-AACGGGCCCTCTAG-ACTCGAGTCAGGGGTCTGGTAGATCCGA-3′;GAPDH正向序列: 5′-CTCTGCTCCTCCTGTTCGAC-3′,反 向序列: 5′-GCGCCCAATACGACCAAATC-3′。
1.6 蛋白质印迹检测TRAF3 及凋亡相关蛋白水平
取各组H22 细胞,在4 ℃下离心10 min,加入裂解液裂解后,加入Loading Buffer 缓冲液,选择蛋白质定量法(波长为562 nm) 检测各组蛋白含量,进行灌胶上样操作。取适量样本与SDS 样品缓冲液混合,加热煮沸5 min,然后离心后取上清液,进行电泳分离。根据胶的大小剪取模和滤纸,在转膜前,先用甲醇浸泡PVDF 膜3 s,然后选择半干法转到PVDF 膜。将膜置于封闭缓冲液中1 h,在室温下进行摇动以封闭。加入一抗TRAF3、cleaved caspase-3、Bax、Bcl-2 和GADPH (1∶1 000)在4 ℃下过夜,加入IgG 二抗(1∶2 000),37 ℃下孵育1 h,取出胶片,浸入显色液中1 min,清洗后定影,并通过Image-ProPlus 软件进行分析,以GADPH(1∶1 000) 为内参,计算各蛋白的相对水平。
1.7 CCK8 法检测细胞存活率
转染48 h 后,向每个孔中添加10 μL CCK8,并置于避光的恒温培养箱中培养2 h。然后,通过酶标仪在450 nm 波长下测量每个孔的吸光度(A)值,并计算每个组的平均A值。最后,计算细胞的存活率[12]。
1.8 特异性细胞毒性试剂盒检测HT22 细胞LDH 的释放量
从细胞培养箱中取出细胞板,加入试剂盒中的LDH 释放试剂,加入量为原有培养液体积的10 %,加入LDH 释放试剂后,反复吹打数次混匀,然后继续孵育24 h。到达预定时间后,将培养板离心5 min,分别取各孔的上清液,加入新的96 孔板中,检测样品的LDH 释放量。
1.9 流式细胞仪检测细胞凋亡率
在转染后,将细胞放置在37 ℃和5 % CO2的培养箱中培养48 h,然后收集每个培养孔上清液,对细胞消化后加入100 μL 二甲基亚砜和20 μL PI,并在避光的情况下进行37 ℃反应20 min。最后使用流式细胞仪检测细胞凋亡率。
1.10 生物信息学分析及双荧光素酶报告实验
基于TargetScan 生物信息学工具的分析发现,TRAF3 基因的3′-UTR 区域存在可被miR-126-5p结合的靶向序列。为了进一步验证该结论,将包含野生型和突变型miR-126-5p靶向序列的TRAF3 mRNA 序列分别克隆至pGL3 质粒中,分别命名为pGL3-TRAF3 和pGL3-TRAF3-mut。使用细胞培养技术,将上述质粒和模拟物转染至细胞中。在转染后48 h,采用双荧光素酶实验测定荧光素酶活性。
1.11 统计学分析
采用SPSS 17.0 对数据进行分析。作图通过GraphPadPrism5 软件。所有的数据用表示。两组间的比较通过t检验,多组间比较采用单因素方差分析检验。
2 结果
2.1 miR-126-5p 和TRAF3 在OGD/R 细胞模型中的表达量
RT-qPCR 结果显示,与对照组比较,各组miR-126-5p表达量均降低,TRAF3 mRNA 表达量均显著性升高(P<0.05)。蛋白质印迹结果显示,与对照组比较,各组TRAF3 蛋白水平均显著性升高(P<0.05) (图1),表明OGD/R 损伤可导致HT22 细胞miR-126-5p表达量降低,而TRAF3 mRNA 表达量、TRAF3 蛋白水平升高。
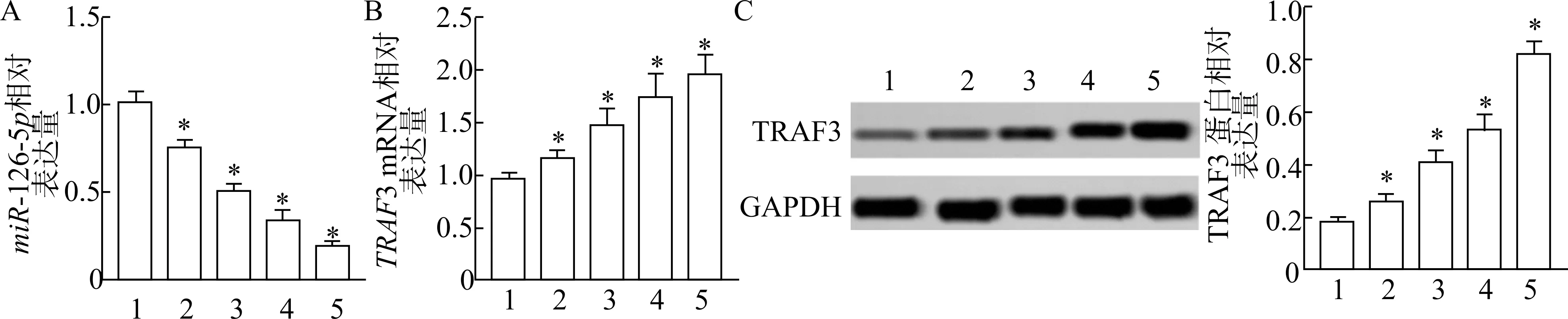
图1 各组miR-126-5p 及TRAF3 表达量
2.2 miR-126-5p 过表达促进OGD/R 诱导的HT22 细胞生长
RT-qPCR 结果显示,与对照组比较,miR-126-5p在OGD/R 组中显著下调 (P<0.05),说明OGD/R 损伤可导致HT22 细胞miR-126-5p表达降低;与OGD/R 组比较,miR-126-5p在OGD/R +miR-mimic 组中显著上调(P<0.05),说明在转染miR-126-5p-mimic (即miR-126-5p过表达) 可促进HT22 细胞miR-126-5p表达。CCK-8 结果显示,与对照组比较,OGD/R 组的细胞存活率显著下降(P<0.05);与OGD/R 组比较,OGD/R+miRmimic 组的细胞存活率显著升高(P<0.05),说明OGD/R 损伤可降低HT22 细胞存活率,而转染miR-126-5p-mimic (即miR-126-5p过表达) 可提高HT22 细胞存活率。特异性细胞毒性试验结果表明,与对照组比较,OGD/R 组的LDH 释放量显著升高(P<0.05);与OGD/R 组比较,OGD/R+miRmimic 组的LDH 释放量显著下降(P<0.05) (图2),说明OGD/R 损伤可导致HT22 细胞LDH 释放量升高,而转染miR-126-5p-mimic (即miR-126-5p过表达) 抑制HT22 细胞LDH 释放。
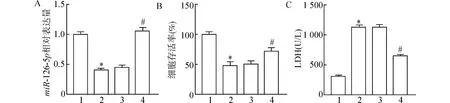
图2 各组细胞存活率及LDH 释放量
2.3 miR-126-5p 过表达逆转OGD/R 诱导的细胞凋亡
流式细胞术结果表明,与对照组比较,OGD/R 组的细胞凋亡率显著上升(P<0.05);与OGD/R 组比较,OGD/R+miR-mimic 组的细胞凋亡率显著下降 (P<0.05),说明转染miR-126-5p(即miR-126-5p过表达) 可降低细胞凋亡率。凋亡相关蛋白检测结果显示,与对照组比较,OGD/R 组Bcl-2蛋白水平显著下调(P<0.05),而Bax 及cleaved caspase-3 蛋白水平明显上调(P<0.05);与OGD/R组比较,OGD/R+miR-mimic 组的Bcl-2 蛋白水平明显上调,而Bax 及cleaved caspase-3 蛋白水平明显下调(P<0.05) (图3),说明转染miR-126-5p(即miR-126-5p过表达) 可促进细胞Bcl-2 蛋白分泌,而降低Bax 及cleaved caspase-3 蛋白水平。
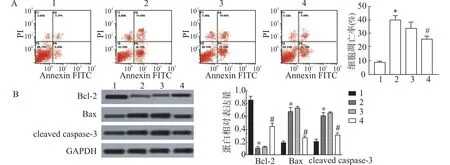
图3 各组细胞凋亡情况
2.4 miR-126-5p 靶向调控TRAF3
靶基因预测发现,TRAF3 和miR-126-5p之间存在互补配对的碱基,说明miR-126-5p可靶向调控TRAF3。RT-qPCR 结果显示,与mimic-NC 比较,miR-mimic 组中miR-126-5p表达量显著上调(P<0.05),与inhibitor-NC 组比较,miR-inhibitor组中miR-126-5p表达量显著下调(P<0.05)。双荧光素酶报告结果显示,共转染后,野生型纯合子TRAF3 的荧光素酶活性显著降低(P<0.05),而突变型纯合子TRAF3 的荧光素酶活性无显著差异(P>0.05)。此外,RT-qPCR 结果显示,与mimic-NC 组比较,miR-mimic 组中TRAF3 mRNA 表达量显著下降 (P<0.05),与inhibitor-NC 组比较,miR-inhibitor 组TRAF3 mRNA 表达量显著上升(P<0.05) (图4)。说明miR-126-5p过表达可导致TRAF3 mRNA 表达量降低。
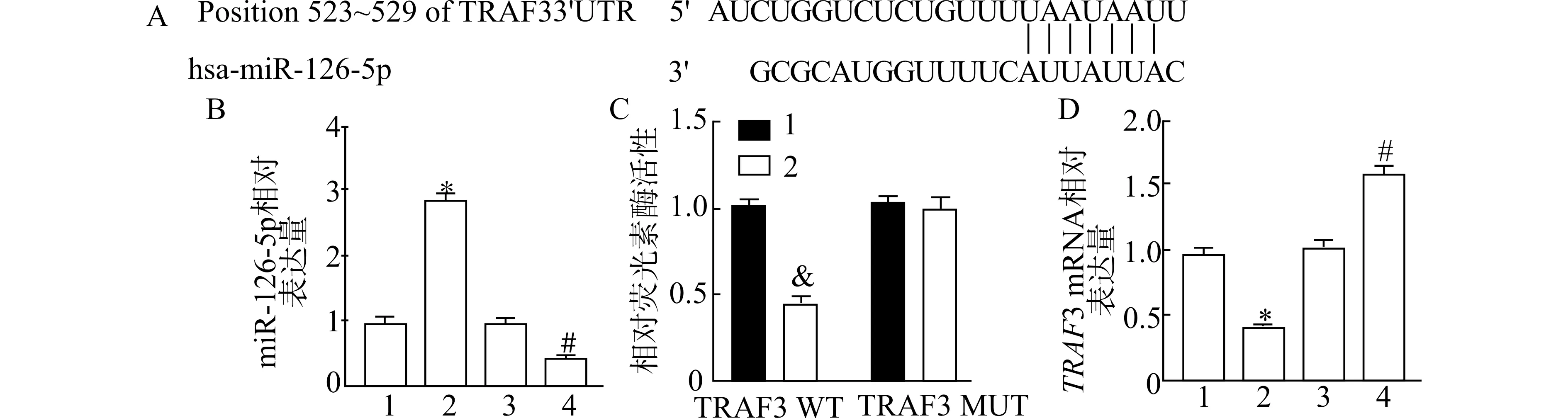
图4 miR-126-5p 与TRAF3 靶向分析
2.5 miR-126-5p 靶向TRAF3 逆转OGD/R 诱导的HT22细胞生长抑制
RT-qPCR 结果显示,与对照组比较,pcDNA组TRAF3 mRNA 表达量无显著差异(P>0.05),pcDNA-TRAF3 组TRAF3 mRNA 表达量显著升高(P<0.05);蛋白质印迹结果显示,与OGD/R +mimic-NC 组比较,TRAF3 蛋白量在OGD/R +miRmimic 组、OGD+miR-mimic+pcDNA 组均显著下调(P<0.05);与OGD+miR-mimic 组比较,OGD+miR-mimic+pcDNA-TRAF3 组TRAF3 蛋白量显著上升(P<0.05)。
CCK-8 结果显示,与OGD/R +mimic-NC 组比较,OGD/R+miR-mimic 组以及OGD +miR-mimic +pcDNA 细胞存活率显著升高(P<0.05);与OGD/R+miR-mimic 组比较,OGD+miR-mimic +pcDNATRAF3 组细胞存活率显著降低(P<0.05),说明TRAF3 mRNA 过表达可导致细胞存活率降低。LDH结果显示,与OGD/R +mimic-NC 组比较,OGD/R+miR-mimic 组以及OGD +miR-mimic +pcDNA 组细胞LDH 释放量显著降低(P<0.05),与OGD/R+miR-mimic 组比较,OGD+miR-mimic+pcDNATRAF3 组LDH 释放量显著升高(P<0.05) (图5)。说明TRAF3 mRNA 过表达可导致LDH 释放量显著升高。
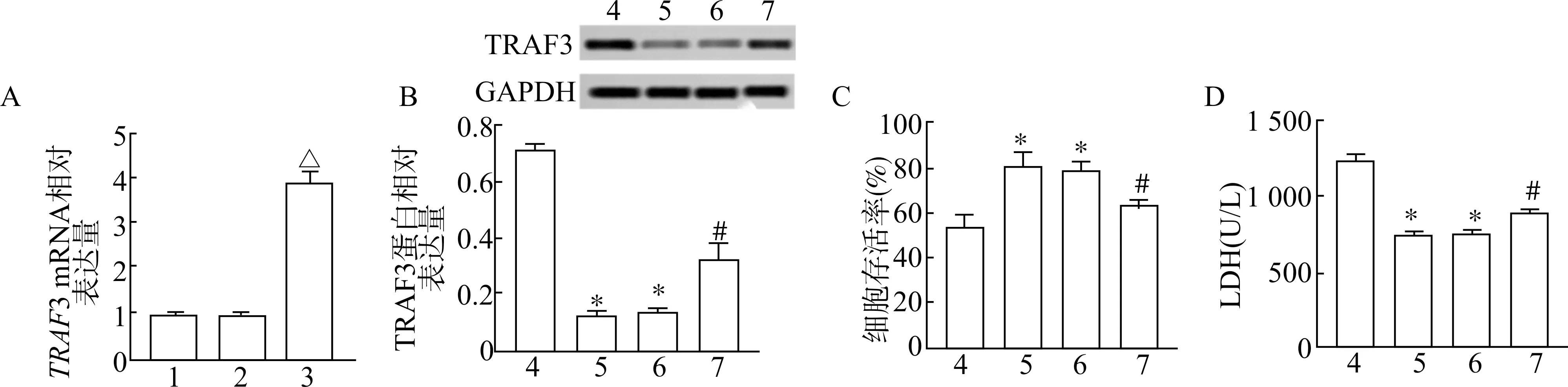
图5 miR-126-5p 靶向TRAF3 促进HT22 细胞生长
2.6 miR-126-5p 靶向TRAF3 逆转OGD/R 诱导的HT22细胞凋亡
流式细胞术结果显示,与OGD/R +mimic-NC组比较,OGD/R+miR-mimic 组以及 OGD +miR-mimic+pcDNA 组细胞凋亡率显著下降(P<0.05)(图6);与OGD+miR-mimic 组比较,OGD+miR-mimic+pcDNA-TRAF3 组细胞凋亡率显著上升(P<0.05),说明TRAF3 mRNA 过表达可导致细胞凋亡率升高。

图6 miR-126-5p 靶向TRAF3 抑制HT22 细胞凋亡
WB 结果显示,与OGD/R+mimic-NC 组比较,OGD/R+miR-mimic 组以及OGD+miR-mimic +pcDNA 组Bcl-2 的表达量显著上升(P<0.05),而cleaved caspase-3、Bax 表达量显著下降 (P<0.05);与OGD +miR-mimic 组比较,OGD+miRmimic+pcDNA-TRAF3 组Bcl-2 的表达量显著下降(P<0.05),而cleaved caspase-3、Bax 表达量显著上升(P<0.05),说明TRAF3 mRNA 过表达可导致Bcl-2 表达量降低,cleaved caspase-3、Bax 表达量升高。
3 讨论
miR-126-5p是一种由miR-126 前体RNA 基因细胞内加工剪切产生的成熟miRNA。近年来的研究表明,miR-126 是维持血管完整性最重要的miRNA 之一,在脑缺血再灌注后的神经保护中发挥重要作用[12]。miR-126-5p 过表达可降低缺血性脑卒中后促炎细胞因子和黏附分子的表达,减轻脑卒中后血脑屏障的破坏[13]。TRAF3 是一种调节细胞凋亡、免疫应答和炎症反应的信号转导蛋白,与脑缺血再灌注和神经元有着紧密的关系[14]。LDH 是一种存在于体内细胞内的酶,其主要作用是将储存在细胞内的乳酸氧化成丙酮酸,并在能量代谢过程中起重要作用[15]。当身体发生炎症反应时,组织受损会导致细胞破裂,并释放出LDH 等细胞内酶和蛋白质等成分,导致LDH 水平升高[16]。因此,LDH 在体内的水平可以反映细胞破坏的程度和炎症反应的严重程度。本研究结果显示,miR-126-5p在OGD/R 模型中下调而TRAF3 上调,提示miR-126-5p在脑缺血再灌注的损伤中起保护作用。全脑缺血和局灶性脑缺血后血管完整性降低,而影响miR-126-5p表达,进而可加重了神经元的死亡。对HT22 细胞中miR-126-5p行过表达处理后HT22 细胞存活率显著升高,而LDH 释放量和细胞凋亡率显著降低,且OGD/R 诱导的Bcl-2 蛋白水平降低,Bax、cleaved caspase-3 蛋白水平升高被逆转。这一结果提示miR-126-5p过表达处理减轻了OGD/R 诱导的神经细胞凋亡及细胞损伤引起的炎症反应。结合miR-126-5p与TRAF3 在HT22 细胞差异表达的结果,我们推测miR-126-5p与TRAF3 可能存在靶向调控性,通过生物信息站靶基因分析发现miR-126-5p与TRAF3 存在结合位点;此外,双荧光素酶报告试验结果表明miR-126-5p与TRAF3 靶向结合。
同时,RT-qPCR 结果显示,miR-126-5p过表达后HT22 细胞TRAF3 相对表达量显著降低,而敲低miR-126-5p后,TRAF3 水平降低被逆转。这些证据表明,miR-126-5p可以靶向TRAF3 从而降低TRAF3 表达量,为后续研究奠定一定的理论基础。本研究在OGD/R 诱导的HT22 细胞中miR-126-5p低表达,而TRAF3 高表达,且miR-126-5p与TRAF3 存在靶向结合片段,由此我们推测miR-126-5p可能通过负向调控TRAF3,抑制糖氧剥夺再灌注介导的HT22 细胞凋亡和炎症反应。为验证此猜想,设计了TRAF3 回复实验显示miR-126-5p过表达对TRAF3 表达的抑制作用又被TRAF3 上调重新激活,且上调TRAF3 后,miR-126-5p过表达对HT22 细胞存活率,LDH 释放量和细胞凋亡率的影响也被逆转。LDH 作为一种重要的细胞质酶,其在I/R 损伤过程中会被释放到细胞外,导致细胞死亡和炎性反应的加剧而TRAF3 可以通过抑制NFκB 通路等途径来抑制LDH 的释放,从而减轻炎症反应和细胞死亡[17]。同时,TRAF3 还可以抑制MAPK 途径的活化,降低细胞凋亡的水平,使细胞更加抵抗I/R 损伤。基于此,我们推测miR-126-5p通过靶向TRAF3,降低TRAF3 表达量,进而MAPKs 和NF-κB 信号通路被抑制,从而减轻炎症反应以及减少神经元细胞的凋亡。
综上所述,miR-126-5p可以靶向结合TRAF3基因,从而抑制OGD/R 诱导的HT22 细胞凋亡和炎症反应。但关于其具体作用机制还有待更深入探索与分析。
