水质简分析试验过程解析及数据审核
2024-03-07侯世昌
侯世昌
(河北省水利水电勘测设计研究院集团有限公司,天津 300220)
水电工程构筑物大多由混凝土或钢筋混凝土构成,其所处环境离不开水和土。当自然水经过复杂的地质变化和环境影响,会富含可溶物质和悬浮物。当这些物质达到一定浓度时, 就可能对混凝土或钢筋混凝土产生侵蚀性。 有时这些有害物质是由于人类活动造成的,如不经处理的化工废料的排放、事故造成有害物质的泄漏、生活垃圾的随意堆放等。当雨水降临或在不利环境条件的促使下, 这些污染物就会渗透到土壤和地下水中,一旦与水工建筑物接触,就可能造成侵蚀性破坏, 严重时可危害到建筑物的安全或功能的使用。因此,水质简分析试验是工程地质勘察项目中一个重要内容, 当水质检测指标出现不利于工程情况时, 可作为工程技术人员在设计或施工时采取防范措施的依据。
当评价水的侵蚀性时,需进行水质分析试验。根据检测可分为水质简分析和全分析。 当只对水的化学类型做一般性了解时,可进行简分析试验[1]。水质简分析对外观、透明度、臭、悬浮物无特殊要求时,仅作定性描述,需要定量检测的指标:电导率、pH 值、游离CO2、 侵蚀性CO2、 总硬度、Ca2+、Mg2+、K++Na+、。 下面针对NB/T35052—2015《水电工程地质勘察水质分析规程》的试验过程予以解析,并对数据的合理性进行检验。
1 水质简分析试验解析
1.1 游离CO2
待测水样pH﹤8.3 时, 水样中存在游离CO2,用酚酞做指示剂, 标准NaOH 溶液滴定, 当CO2与NaOH 完全反应时,水样变红且pH=8.3,到达终点。反应方程式如下:
1.2 总碱
总碱是水中能与强酸发生中和反应的物质总量。采用酚酞作指示剂测得的碱度为酚酞碱度,采用甲基橙作指示剂测得的碱度为甲基橙碱度。
1.3 侵蚀性CO2
侵蚀性CO2是游离CO2的一部分,溶解于水中,超过平衡量并能与CaCO3反应生成可溶性重碳酸盐的CO2。反应方程式如下:
试验时通过在水样中加入过量CaCO3粉末,用以模拟环境水与混凝土的接触,充分振荡、静置,使侵蚀性CO2充分反应,形成当量的,然后用盐酸标准溶液测出新增加的含量, 从而确定侵蚀性CO2的含量。
1.4 氯离子
一般用AgNO3滴定法测定水样中Cl-。采用分级沉淀原理,以K2CrO4作指示剂,用AgNO3标准溶液滴定,Ag+先与Cl-反应,再与反应,当Cl-完全沉淀后, 过量的Ag+与反应生成砖红色沉淀。反应如下:
因为采用分级沉淀原理, 所以AgNO3的用量比实际偏高,因此需做空白试验,消去误差。另外滴定须在中性或弱碱性溶液中进行,当溶液pH﹤6.5 时,部分可转化为浓度降低, 导致AgNO3用量偏高; 当溶液pH﹥10.5 时,Ag+则会与OH-反应生成常温下极不稳定的AgOH,进而分解为微溶于水的Ag2O[2]。
1.5 总硬度
水中钙、镁离子的总浓度称为总硬度。其中,通过加热能形成碳酸盐沉淀的钙、 镁离子浓度称为碳酸盐硬度(或暂时硬度),反之,称为非碳酸盐硬度(或永久硬度)。EDTA 滴定法适于CaCO3含量在2 mg/L以上的水样。反应原理为在pH=10 的溶液中,EDTA与Ca2+、Mg2+生成的无色络合物比铬黑T 指示剂与Ca2+、Mg2+生成的酒红色络合物稳定, 滴定过程中,EDTA 先与游离的Ca2+、Mg2+生成无色络合物, 再夺取和铬黑T 络合的Ca2+、Mg2+, 当Ca2+、Mg2+全部被置换出来时, 溶液的颜色由络合物的酒红色变为铬黑T 的蓝色,此时即为滴定终点。以Ca2+为例,反应过程如下:
在碱性溶液中,铬黑T 会随着时间流逝被氧化,影响最后反应结果。因此,要保证其在5 min 内完成反应,测出结果。但要注意滴定时速度不要过快,否则可能导致溶液黏在滴定管壁上,产生误差。
1.6 钙离子
EDTA 滴定法测定范围:Ca2+含量在2~100mg/L,试验过程为在加酸并煮沸过的水样中加NaOH 缓冲溶液并用EDTA 标准溶液滴定。其原理:在pH﹥12溶液中,EDTA 与Ca2+形成无色络合物比Ca2+与Ca指示剂形成的酒红色络合物稳定,当指示剂被完全还原,溶液由络合物的红色变为Ca 指示剂的亮蓝色。
1.7 硫酸根离子
水样加酸并煮沸, 可除去HCO3-的干扰。 因为Ba2+与铬黑T 形成的络合物不稳定, 显色灵敏度低,Mg2+形成的络合物稳定,显色灵敏度高,所以钡镁混合溶液中Mg2+起指示终点的作用。
1.8 钾钠离子
水中主要阴、阳离子均为测定值时,那么其参加平衡计算的阴离子之和与阳离子之和应基本相等。水样中阳离子以钙、镁离子为主的水质简分析,钾钠离子可采用差减法计算[4]。
式中c(K++Na+)为水样中钾、钠离子浓度(mmol/L);为水样中阴离子物质的量浓度之和(mmol/L);c (Ca2++Mg2+) 为水样中钙、 镁物质的量浓度之和(mmol/L)。
2 数据审核
水质分析数据的合理性可采用校准曲线检测,阴阳离子平衡,pH 值与游离CO2、之间关系,侵蚀性CO2与、Ca2+之间关系,测定电导率与计算电导率的相对差值等方法检查。
2.1 阴阳离子平衡
阴阳离子两者在理论上是相等的。当水样的K+、Na+为直接测定时,实际上由于在水质分析中存在着各方面的误差和未检测到的离子,两者往往不相等。如果按公式计算,其相对差值不得超过±2%。误差应按式(2)计算:
式中∑c阳为阳离子总和(mmol/L);∑c阴为阴离子总和(mmol/L)。
2.2 pH 值与游离之间关系
(1)水中出现酚酞碱度时,pH 值应大于8.3,按式(3)计算:
(2)含游离CO2和的水的pH 值应与实测值进行比较,pH 值应按式(4)计算:
(3)对于清洁的水样,水样离子强度小于0.01 mmol/L,pH 值在5~8 时,pH 的计算值与实测值之差不应大于0.2。水样离子强度大于0.01 mmol/L 时,应对按式(5)进行活度校正:
不同离子强度的lgf 值应按表1 的规定取值。

表1 不同离子强度的lgf 值
2.3 侵蚀性CO2 与之间关系
对于一般的天然水,由侵蚀性二氧化碳所形成的溶蚀CaCO3容量的实测值与理论计算值两者相近。
理论值计算公式:
当系数项的K2/(K1Kap)值采用2.07×104时,计算结果较符合实际值。 以上计算结果为水中平衡CO2浓度, 侵蚀CO2含量还要根据水与CaCO3构成的新平衡进行计算。计算可按式(8)进行:
式中CCO2为水中游离CO2的含量 (mg/L);X 为侵蚀性CO2的含量 (mg/L);CCa为钙离子的含量(mg/L);CHCO3为的含量(mg/L);为Ca2+、离子的活度系数。
离子强度与活度系数可参考表2 取值。
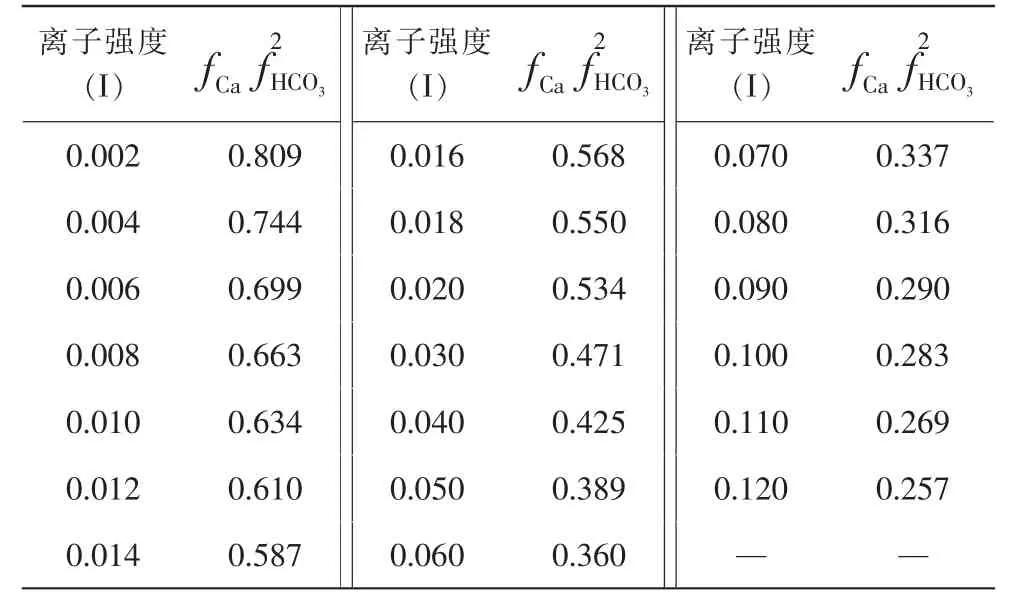
表2 离子强度与活度系数
2.4 校准曲线检查
校准曲线是描述待测物质浓度与相应仪器响应值之间定量关系的曲线。绘制校准曲线图1 步骤:
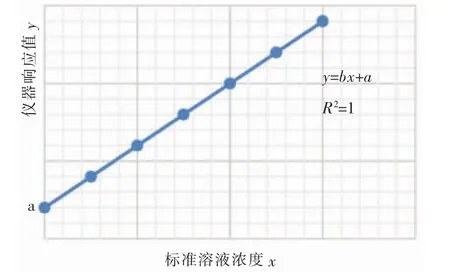
图1 校准曲线
(1)配制在测量方法范围内的一系列已知浓度的标准溶液,一般不少于6 个,且所配溶液浓度应均匀分布于测量量程内。
(2)依照与待测水样相同的步骤测定各个浓度的标准溶液的响应值。
(3)测得的仪器响应值扣除零浓度的响应值后,以响应值为纵坐标,浓度为横坐标,通过各点绘制一条合理的曲线。
(4)由于物质浓度与相应仪器响应值之间呈高度线性相关,一般采用最小二乘法,求出回归线性方程式:
式中n 为测试点数;y 为仪器的响应值;x 为各个标准溶液的浓度;a 为回归线在Y 轴的截距;b 为斜率,也称回归系数。
2.5 测定电导率与计算电导率的相对差值
用计算电导率和实测电导率进行比较, 其相对差值的绝对值不应大于5%~10%。
水样的计算电导率按式(10)计算:
式中κ 为计算电导率 (μs/cm);Nn为离子n 的浓度(mmol/L),二价离子以1/2 基本单元计算,三价以上类推;λn为离子n 的极限当量电导,按表3 取值;[X]为离子n 的常数值, 按表3 取值;I 为离子强度(mmol/L)。
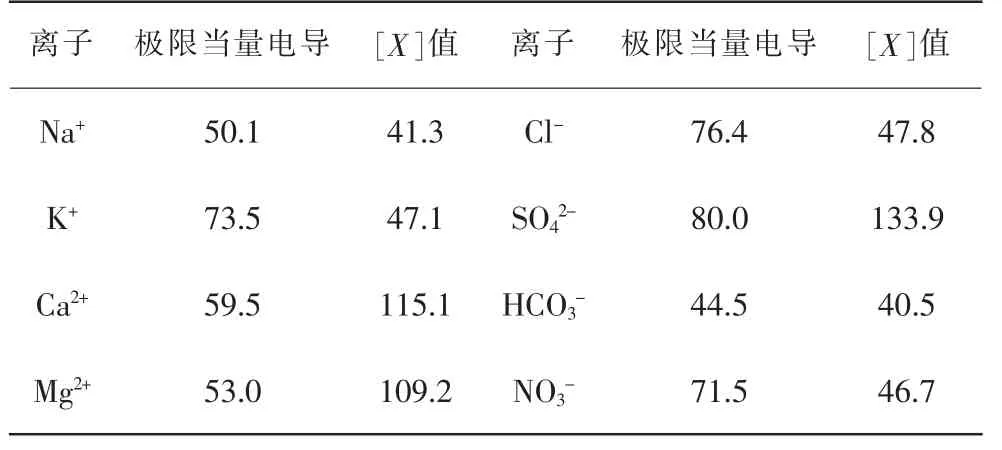
表3 极限当量电导和[X]值
离子强度I 可按式(11)计算:
式中Zi为i 离子的电荷数;ci为i 离子的浓度(mmol/L)。
3 结语
(1)一般情况下,自然界的水中阴阳离子处于平衡状态,二者试验值相差不能超过±2%。
(3)受试验条件、检测方法和样品本身等因素影响,水质分析的实测值和理论计算值存在一定误差。
