以骨痛及贫血为首发表现的乳腺癌骨髓转移一例
2024-03-07钟成明白熠洲
钟成明, 罗 斌, 白熠洲
1 病例介绍
患者,女,37岁,2022年7月无诱因出现右肩胛部疼痛,其间出现低热。外院检查,血常规结果:Hb 97 g/L,考虑“骨质疏松”,予碳酸钙口服,疼痛未缓解,并逐渐出现肩部及腰背部疼痛。某次服药后患者出现呕吐,诱发左季肋部剧烈疼痛。2022年8月22日于外院行胸部CT检查,结果提示:左第6肋骨骨折,胸腰椎椎体及胸骨改变,考虑多发性骨髓瘤。对症治疗疼痛后患者未复诊。2022年9月28日患者因疼痛未缓解及半个月内体重下降5 kg,就诊于清华大学附属北京清华长庚医院。血常规结果:Hb 59 g/L。血生化结果:碱性磷酸酶(alkaline phosphatase,ALP)224 U/L,Cr 177 μmol/L,LDH 295 U/L,Ca 3.20 mmol/L。炎症指标PCT 0.162 ng/mL,CRP 9.80 mg/L。以“重度贫血,多发性骨髓瘤待除外”收入血液肿瘤科。入院后查血CA-125 110.3 U/mL,CYFRA21-1 20.29 ng/mL,CEA 13.24 ng/mL,CA15-3 52.5 U/mL。行骨髓穿刺涂片(见图1):骨髓转移性癌。普通外科会诊补充乳腺查体发现左外上象限质硬肿物,大小为5 cm×4 cm,无压痛,左腋下未触及肿大淋巴结,左侧肋弓处隆起性改变。乳腺钼靶示:左乳外上区域分布细小多形钙化灶,乳腺影像报告数据系统(Breast Imaging Reporting and Data System,BI-RADS)4a类。入院后患者呈极度衰弱、神志淡漠、尿量减少等恶液质状态,血液肿瘤科予以输血、补液、降钙、双膦酸盐、营养支持等对症治疗后患者肾功能恢复,一般状态较前改善,转入普通外科。2022年10月9日超声提示患者左乳外上片状低回声2.4 cm×0.8 cm,伴点状钙化,BI-RADS 4a类,左腋下多发肿大淋巴结(皮质明显增厚)。左乳肿物穿刺活检病理:乳腺浸润性癌,非特殊类型,Ⅱ级,6分。免疫组化:ER(90%++)、PR(3%++)、HER2(1+)、Ki-67(30%+)。骨髓穿刺活检病理回报骨髓转移性癌,免疫组化提示可能为乳腺来源。免疫组化染色:AE1+AE3(+)、CK7(-)、CK20(-)、ER(中+)、PR(-)、GATA3(+)、E-Cad(+)、p120(膜+)、CD71(红系+)、MPO(粒系+)、CD42b(巨核系+)、Ki-67(50%+)。特殊染色:网织(+++)、铁染色(-)。全身骨显像(见图2)示:中轴、双侧肩胛骨异常,符合全身广泛骨转移。肺、肝、脑未见转移,诊断为左侧乳腺恶性肿瘤(Luminal B,cT2N1M1)。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分3分。2022年10月13日开始化疗,方案:白蛋白紫杉醇,0.1 g,1次/周,6周后改为0.2 g,1次/2周,同时继续予唑来膦酸输注。骨科协助评估脊柱稳定性后予颈托、腰托持续佩戴。化疗过程中,查体患者左乳肿物明显缩小,化疗5个月时已不可触及。肿瘤标志物持续下降,一般情况明显好转,ECOG评分0分。2023年3月6日行骨髓穿刺活检,仍可见肿瘤细胞。此时停用化疗,改为内分泌治疗,方案为卵巢功能抑制剂+芳香化酶抑制剂+CDK4/6抑制剂(戈舍瑞林3.6 mg+依西美坦25 mg+阿贝西利150 mg)。随访48周,患者血常规、ALP、血钙等指标都恢复至正常范围。肿瘤标志物在内分泌治疗期间稳定在正常范围并继续下降。本研究获清华大学附属北京清华长庚医院伦理委员会批准(编号:23699-6-01)。
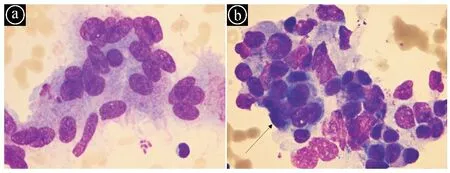
ⓐ可见大小不等的红细胞;ⓑ箭头所指为转移癌细胞,胞体大小不等,成堆分布,胞浆深染,细胞之间相互融合,并可见个别呈散在分布
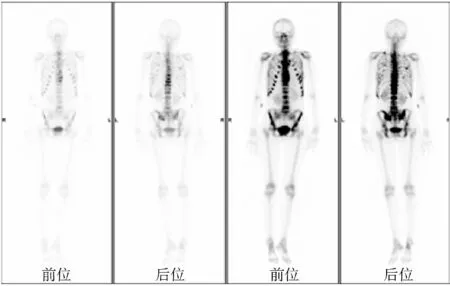
患者中轴、双侧肩胛骨异常,符合全身广泛骨转移
2 讨论
2.1本例患者以骨痛及贫血为主要表现,入院后骨髓穿刺检查排除多发性骨髓瘤,左乳穿刺活检病理提示乳腺浸润性癌。全身骨显像提示患者中轴、双侧肩胛骨异常,符合全身广泛骨转移。骨髓穿刺活检病理回报骨髓转移性癌,免疫组化提示可能为乳腺来源,最终诊断为左侧乳腺恶性肿瘤。确诊后予以紫杉醇化疗,患者左乳肿物明显缩小,肿瘤标志物下降至正常范围,一般情况明显好转。后予以内分泌治疗,治疗过程中患者一般情况较好,肿瘤标志物稳定在正常范围并继续下降,全身骨痛症状消失,ECOG评分已由入院时的3分下降至0分。
2.2乳腺癌是目前全世界女性发病率最高的恶性肿瘤之一[1],乳腺癌患者晚期往往会出现全身转移,但报道骨髓转移伴血细胞下降的文献较少。Rahmat和Ikhwan[2]回顾分析了12 970例乳腺癌患者资料,只有0.17%的患者存在有症状的骨髓转移,以骨痛及贫血为首发表现的乳腺癌骨髓转移则更为罕见。乳腺癌骨转移患者的中位总生存期(overall survival,OS)为4~5年,而骨髓转移患者的中位OS仅为1年[3]。发生骨髓转移的患者如果不能接受化疗,中位OS仅为1个月[4]。因此,乳腺癌骨髓转移后及早诊治十分重要。
2.3骨髓转移患者与骨转移关系密切,却有所不同。骨转移患者早期常有一系列骨相关事件,而骨髓转移患者初期通常无特殊症状或体征[3]。骨髓穿刺活检是诊断乳腺癌骨髓转移的金标准。但对于乳腺癌并不是常规的检查手段[5],并且乳腺癌骨髓转移缺乏特异性临床表现,难以进行早期诊断[3]。一些临床症状提示乳腺癌骨髓转移。文献报道贫血是乳腺癌骨髓转移最常见的症状,40%~60%乳腺癌骨髓转移患者Hb低于120 g/L[6]。研究认为,发热与乳腺癌骨髓转移有关,特别是不明原因的弛张热[7]。同时有研究认为骨髓转移会导致ALP升高[5]。本例患者入院时有贫血情况,且在病程中存在不明原因的低热情况,与既往报道相符。有研究报道正电子发射断层扫描/X射线计算机断层成像(positron emission tomography/computed tomography,PET/CT)可以同时检测骨皮质和髓质的早期改变,诊断骨髓转移的灵敏度高达90%[3]。但由于癌细胞的遗传异质性,乳腺癌原发灶和转移灶的HR和HER2的免疫组织化学特征可能不同,目前只使用PET/CT成像评估乳腺癌患者的骨髓转移是不够的[8]。
2.4乳腺癌合并骨髓转移已属于晚期,中位生存时间短,目前尚未有明确的指南指导用药,以个体化治疗为主。化疗可以有效地延长患者的生存时间[9-10],但由于肿瘤对造血系统的破坏,发生骨髓转移的乳腺癌患者对化疗的耐受程度较差。为此需要根据患者的基本状态、肿瘤分子分型等进行个体化用药。由于化疗本身会抑制患者骨髓造血功能,加重患者贫血情况,推荐使用促红细胞生成素或对症予以输血以保障化疗的有效进行。研究认为,对于存在骨髓功能障碍,血常规异常的患者,小剂量紫杉醇单药,给药1次/周,是一种可适用方案[3]。本例患者治疗初期采用紫杉醇进行治疗,各项指标恢复良好。内分泌治疗具有较好的耐受性,也可以提高患者的OS[5]。对于一些特定类型的乳腺癌如HR(+)/HER2(-)患者,内分泌治疗生存期高于化疗[4]。但内分泌治疗起效慢,不利于危重患者的解救治疗。因此,内分泌治疗通常进行肿瘤的维持治疗。本例患者在解救化疗指标恢复后采用内分泌治疗,取得了满意的治疗效果,全身骨痛症状消失,肿瘤标志物持续下降。有研究报道,使用来曲唑和亮丙瑞林加CDK4/6抑制剂帕博西尼,有显著的临床获益[8]。对于骨髓转移广泛且临床化疗耐受性差的患者,可以采用CDK4/6抑制剂联合内分泌药物治疗[10]。对于基础情况差的HER2阳性的患者,曲妥珠单抗的使用能够有效地控制肿瘤的进展[11]。唑来膦酸联合化疗可降低晚期乳腺癌患者骨髓中播散性肿瘤细胞的比例。由于骨髓转移患者通常会造成骨质破坏,双膦酸盐等抗骨吸收治疗可减少骨骼相关事件,包括疼痛、骨折和高钙血症[12]。本例患者使用了唑来膦酸进行治疗,骨痛症状明显好转。
2.5以骨痛及贫血为首发表现的乳腺癌伴骨髓转移,因其临床表现不典型,若未及时诊断并进行积极治疗,患者生存期短,预后差。临床上如怀疑乳腺癌骨髓转移,应及早完善相关检查,根据患者情况采用个体化治疗方案。
