淫羊藿苷通过NO-cGMP-PKG减轻炎症并改善射血分数保留型心衰大鼠的心室重塑
2024-03-07陈丽珍杨雷许锦文
陈丽珍,杨雷,许锦文
1. 上海中医药大学,上海 201203;2. 浦江县中医院内二科,浙江 浦江 322200
射血分数保留型心衰(HFPEF)已成为心力衰竭的主要形式,随着人口的老龄化以及肥胖、糖尿病和高血压患病率的增加,其患病率正在迅速增长[1]。心室重塑和舒张功能障碍是HFPEF 的标志,其特征是左心室肥大,硬度升高和充盈压增加,微血管内皮炎症也是影响HFPEF 发生发展的关键机制。HFPEF 患者的心功能和生活质量严重受损,而且目前缺乏可以有效降低其发病率或死亡率的治疗方法[2]。淫羊藿苷(ICA)是中药淫羊藿的主要活性成分,具有抗炎、抗氧化、心脏保护等多种药理作用[3]。ICA 通过抑制氧化应激诱导的炎症、细胞凋亡,显著改善异丙肾上腺素诱导Wistar 大鼠的心力衰竭[4]。ICA 通过Apelin/Sirt3 途径预防线粒体功能障碍,从而减弱糖尿病心肌病的发展[5]。ICA 通过调节CD147/MMP-9 通路影响心肌梗死后的心脏重塑[6]。 研究表明, 一氧化氮(NO)- 环磷酸鸟苷(cGMP)-蛋白激酶G(PKG)是心脏功能的重要调节通路,HFPEF 患者的心肌匀浆中cGMP 含量和PKG生物活性显著降低,HFPEF 大鼠中检测到NOcGMP-PKG 途径的缺乏,抑制该信号通路可参与HFPEF 的进展[7-8]。NO-cGMP-PKG 通路下调可能归因于冠状动脉微血管内皮炎症激活和亚硝化/氧化应激引起的心肌NO 生物利用度降低[9]。但ICA 通过调节NO-cGMP-PKG 信号通路对HFPEF 大鼠炎症和心室重塑的影响尚不清楚。因此,本研究探讨ICA 对HFPEF 大鼠炎症和心室重塑的影响及其作用的分子机制,以期为临床治疗HFPEF 提供一定的参考价值。
1 材料与方法
1.1 实验动物SPF 级雄性SD 大鼠购自上海斯莱克实验动物有限公司,生产许可编号:SCXK(沪)2020-0004,8~10 周龄,体质量200~210 g,适应性喂养1 周,饲养温度22 ℃,湿度55%~60%,12 h光暗循环。不禁水食。本研究经动物伦理委员会批准(PZSHTCM210618001)。
1.2 主要试剂与仪器淫羊藿苷(J36861),上海金穗生物科技有限公司;醋酸脱氧皮质酮(DOCA,货号:30856),上海贝万塔生物科技有限公司;亚硝基左旋精氨酸甲酯(L-NAME,货号:BLL-Bytd0133),上海佰利莱生物科技有限公司;HE 染色试剂盒(货号:G1120-100)、活性氧(ROS)试剂盒(货号:CA1410),北京Solarbio 公司;蛋白提取试剂盒(货号:KALANG),上海康朗生物科技有限公司;IL-6、IL-1β(E-EL-R0896c、E-EL-R0012c)、TNF-α(货号:E-EL-R2856c)、cGMP(E-EL-0083c)ELISA 试剂盒,武汉伊莱瑞特生物科技股份有限公司;NO 测定试剂盒(A013-2-1),南京建成;兔源一抗PKG(ab90502)、eNOS(ab300071)、iNOS(ab178945)、sGCα(ab154841)、GAPDH(ab9485)抗体以及辣根过氧化物酶标记的羊抗兔二抗(ab6721),美国Abcam公司;多功能全自动酶标仪(HBS-ScanX),南京德铁实验设备有限公司;光学显微镜(CX31),日本奥林巴斯公司;小动物超声系统(Vevo 3100LT),加拿大FUJIFILM 公司。
1.3 实验方法
1.3.1 动物建模、分组和给药麻醉并固定大鼠后,手术缝合线结扎整个肾动静脉及输尿管,剪去肾脏,给1%盐水饮用、同时皮下注射DOCA(25 mg/kg,4 d/次),自由饮食。4 周后检测大鼠心功能,射血分数(EF)大于50%且左室舒张期充盈速度比值(E/A)降低,则表明HFPEF 大鼠模型构建成功[10]。将造模成功的大鼠随机分为Model 组、ICA 低、中、高剂量组、抑制剂组,随机选取12 只未行手术的大鼠作为control 组,ICA 低、中、高剂量组大鼠灌胃1、5、10 mg/kg 的ICA[4],抑制剂组大鼠灌胃10 mg/kg 的ICA 和0.5g/kg 的一氧化氮合酶(NOS)抑制剂-亚硝基左旋精氨酸甲酯(L-NAME)[11],control 组和Model 组灌胃等量的生理盐水,每天1 次,连续6 周。
1.3.2 大鼠心功能的检测给药结束后,麻醉大鼠,用小动物超声系统检测大鼠左室射血分数(LVEF)、左室缩短分数(LVFS)、左心室前/后壁厚度(LVAM/LVPW)、左心室舒张末期内径/收缩末期内径(LVEDD/LVESD)、二尖瓣舒张早期/舒张晚期血流速度最大峰值(E/A)。
1.3.3 血流动力学检测腹腔注射1%戊巴比妥钠麻醉大鼠,暴露左颈总动脉并插入导管至左心室腔,记录左心室收缩压(LVSP)、左心室舒张末期压力(LVEDP)及左室压力最大上升或下降速率(+dp/dt max、-dp/dt max)。
1.3.4 HE 染色每组处死6 只大鼠,收集心脏,部分心肌组织在多聚甲醛(4%)固定过夜后,蔗糖梯度脱水,石蜡包埋后切片(3 μm)。切片经二甲苯、乙醇脱蜡和水化,随后进行HE 染色,最后在显微镜下观察染色结果。
1.3.5 NO、ROS、cGMP、IL-6、IL-1β、TNF-α水平检测将大鼠心肌组织制成匀浆后,离心后取上清,根据试剂盒检测大鼠心肌组织中NO、ROS、cGMP、IL-6、IL-1β、TNF-α 含量。
1.3.6 免疫荧光染色大鼠心肌组织经脱水、包埋切片、脱蜡、山羊血清封闭、PBS 漂洗后加入CD31一抗抗体,4 ℃避光孵育过夜,加入生物素标记山羊抗兔IgG(H+L)二抗室温下避光孵育1 h,经PBS 洗涤、DAPI 避光复染5 min、封片,荧光显微镜观察并拍摄照片。Image J 软件计算CD31 平均荧光强度。
1.3.7 PKG、eNOS、iNOS、sGCα 蛋白表达检测提取大鼠心肌组织蛋白,定量后进行电泳,转膜后室温封闭2 h,再分别加入PKG(1∶1 000)、eNOS(1∶2 000)、iNOS(1∶2 000)、sGCα(1∶1 000)、GAPDH(1∶1 000)一抗4 ℃孵育过夜,加入二抗(1∶2 000)室温孵育90 min。Image J 软件分析计算蛋白相对表达水平。
1.4 统计学方法实验数据用Graphpad Prism 9.0 软件进行分析。计量资料以(±s)表示。多组间的比较用单因素方差分析,SNK-q检验用于组间的比较。组内比较采用配对样本t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠心功能比较见图1、表1。与control组比较,Model 组大鼠LVEF、LVFS、E/A 降低,LVAM、LVPW、LVEDD、LVESD 升高(P<0.05);与Model 组比较,ICA 低、中、高剂量组大鼠LVEF、 LVFS、 E/A 升 高 , LVAM、 LVPW、LVEDD、LVESD 降低,其中ICA 高剂量组变化更显著(P<0.05);与ICA 高剂量组比较,抑制剂组大鼠LVEF、 LVFS、 E/A 降 低 , LVAM、 LVPW、LVEDD、LVESD 升高(P<0.05)。
表1 各组大鼠心功能比较(±s)
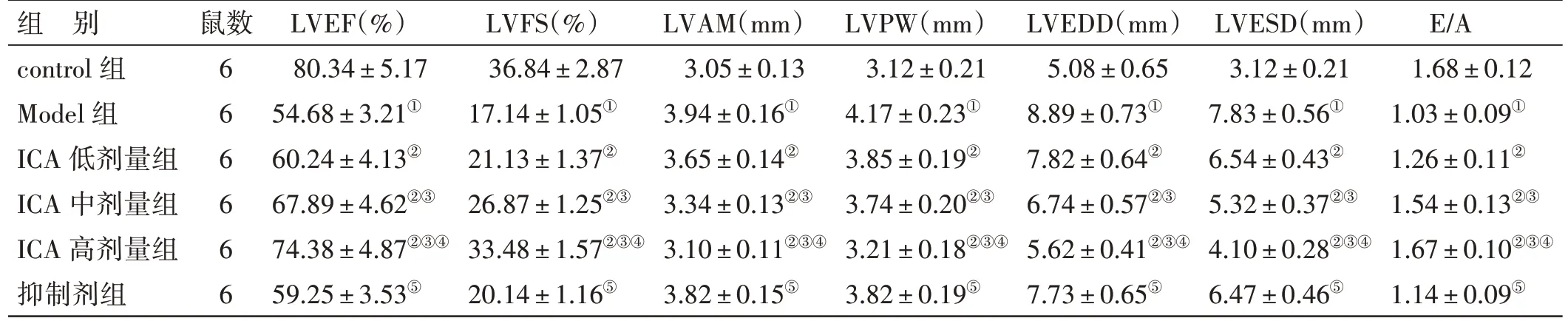
表1 各组大鼠心功能比较(±s)
注:①与control 组比较,P<0.05;②与Model 组比较,P<0.05;③与ICA 低剂量组比较,P<0.05;④与ICA 中剂量组比较,P<0.05;⑤与ICA 高剂量组比较,P<0.05
组 别control 组Model 组ICA 低剂量组ICA 中剂量组ICA 高剂量组抑制剂组鼠数666666 LVEF(%)80.34±5.17 54.68±3.21①60.24±4.13②67.89±4.62②③74.38±4.87②③④59.25±3.53⑤LVFS(%)36.84±2.87 17.14±1.05①21.13±1.37②26.87±1.25②③33.48±1.57②③④20.14±1.16⑤LVAM(mm)3.05±0.13 3.94±0.16①3.65±0.14②3.34±0.13②③3.10±0.11②③④3.82±0.15⑤LVPW(mm)3.12±0.21 4.17±0.23①3.85±0.19②3.74±0.20②③3.21±0.18②③④3.82±0.19⑤LVEDD(mm)5.08±0.65 8.89±0.73①7.82±0.64②6.74±0.57②③5.62±0.41②③④7.73±0.65⑤LVESD(mm)3.12±0.21 7.83±0.56①6.54±0.43②5.32±0.37②③4.10±0.28②③④6.47±0.46⑤E/A 1.68±0.12 1.03±0.09①1.26±0.11②1.54±0.13②③1.67±0.10②③④1.14±0.09⑤
2.2 各组大鼠血流动力学指标比较见表2。与control 组比较,Model 组大鼠LVSP、+dp/dt max、-dp/dt max 降低,LVEDP 升高(P<0.05);与Model组比较,ICA 低、中、高剂量组大鼠LVSP、+dp/dt max、-dp/dt max 升高,LVEDP 降低,其中ICA 高剂量组变化更显著(P<0.05);与ICA 高剂量组比较,抑制剂组大鼠LVSP、+dp/dt max、-dp/dt max 降低,LVEDP 升高(P<0.05)。
表2 各组大鼠血流动力学指标比较(±s)
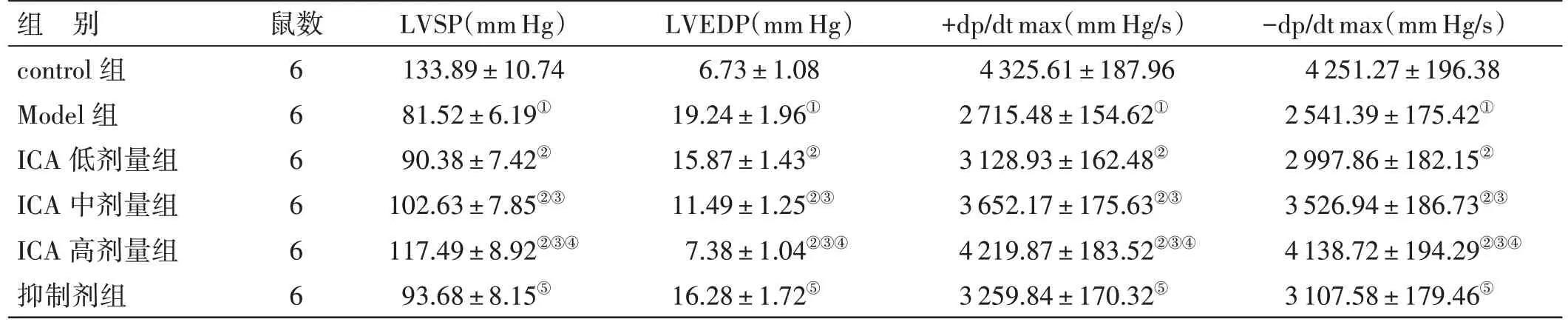
表2 各组大鼠血流动力学指标比较(±s)
注:①与control 组比较,P<0.05;②与Model 组比较,P<0.05;③与ICA 低剂量组比较,P<0.05;④与ICA 中剂量组比较,P<0.05;⑤与ICA 高剂量组比较,P<0.05 1 mm Hg≈0.133 kPa
组 别control 组Model 组ICA 低剂量组ICA 中剂量组ICA 高剂量组抑制剂组鼠数666666 LVSP(mm Hg)133.89±10.74 81.52±6.19①90.38±7.42②102.63±7.85②③117.49±8.92②③④93.68±8.15⑤LVEDP(mm Hg)6.73±1.08 19.24±1.96①15.87±1.43②11.49±1.25②③7.38±1.04②③④16.28±1.72⑤+dp/dt max(mm Hg/s)4 325.61±187.96 2 715.48±154.62①3 128.93±162.48②3 652.17±175.63②③4 219.87±183.52②③④3 259.84±170.32⑤-dp/dt max(mm Hg/s)4 251.27±196.38 2 541.39±175.42①2 997.86±182.15②3 526.94±186.73②③4 138.72±194.29②③④3 107.58±179.46⑤
2.3 各组大鼠心肌组织HE 染色图见图2。control组大鼠心肌组织结构正常,细胞排列紧密有序、细胞核清晰;Model 组大鼠心肌组织结构受损严重,细胞排列松散混乱、充血明显、有炎性细胞浸润现象;ICA 低、中、高剂量组与Model 组比较,大鼠心肌组织结构受损减轻,细胞排列较有序、充血及炎性细胞浸润相对减轻,ICA 高剂量大鼠心肌组织病理改变最为明显;抑制剂组与ICA 高剂量组比较,大鼠心肌组织结构受损加重、细胞排列相对松散、充血及炎性细胞浸润加重。
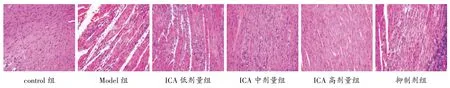
图2 各组大鼠心肌组织HE 染色图(×200)
2.4 各组大鼠心肌组织中NO、cGMP、ROS 水平比较见表3。与control 组比较,Model 组大鼠心肌组织中NO、cGMP 水平降低,ROS 水平升高(P<0.05);与Model 组比较,ICA 低、中、高剂量组大鼠心肌组织中NO、cGMP 水平升高,ROS 水平降低,其中ICA 高剂量组变化更显著(P<0.05);与ICA 高剂量组比较,抑制剂组大鼠心肌组织中NO、cGMP 水平降低,ROS 水平升高(P<0.05)。
表3 各组大鼠心肌组织中NO、cGMP、ROS 水平比较(±s)
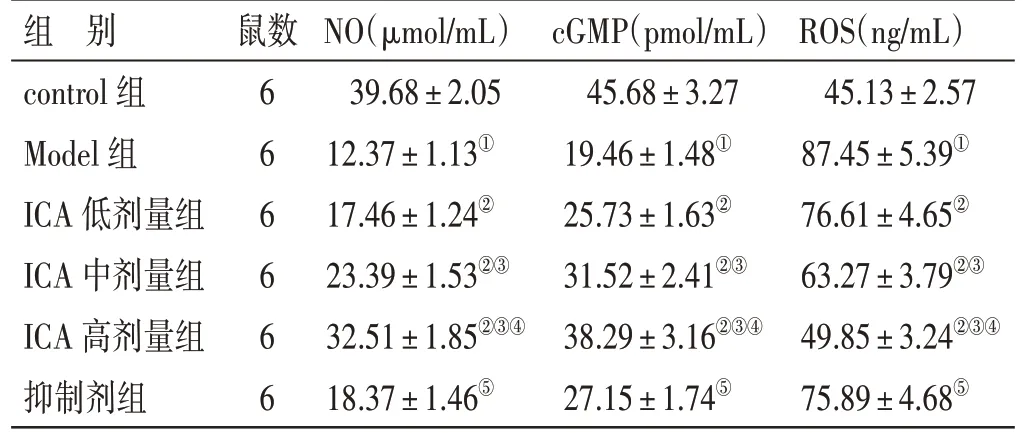
表3 各组大鼠心肌组织中NO、cGMP、ROS 水平比较(±s)
注:①与control 组比较,P<0.05;②与Model 组比较,P<0.05;③与ICA 低剂量组比较,P<0.05;④与ICA 中剂量组比较,P<0.05;⑤与ICA 高剂量组比较,P<0.05
组 别control 组Model 组ICA 低剂量组ICA 中剂量组ICA 高剂量组抑制剂组鼠数666666 NO(μmol/mL)39.68±2.05 12.37±1.13①17.46±1.24②23.39±1.53②③32.51±1.85②③④18.37±1.46⑤cGMP(pmol/mL)45.68±3.27 19.46±1.48①25.73±1.63②31.52±2.41②③38.29±3.16②③④27.15±1.74⑤ROS(ng/mL)45.13±2.57 87.45±5.39①76.61±4.65②63.27±3.79②③49.85±3.24②③④75.89±4.68⑤
2.5 各组大鼠心肌组织中IL-6、IL-1β、TNF-α 水平比较见表4。与control 组比较,Model 组大鼠心肌组织中IL-6、IL-1β、TNF-α 水平升高(P<0.05);与Model 组比较,ICA 低、中、高剂量组大鼠心肌组织中IL-6、IL-1β、TNF-α 水平降低,其中ICA 高剂量组变化更显著(P<0.05);与ICA 高剂量组比较,抑制剂组大鼠心肌组织中IL-6、IL-1β、TNF-α 水平升高(P<0.05)。
表4 各组大鼠心肌组织中IL-6、IL-1β、TNF-α 水平比较(±s)
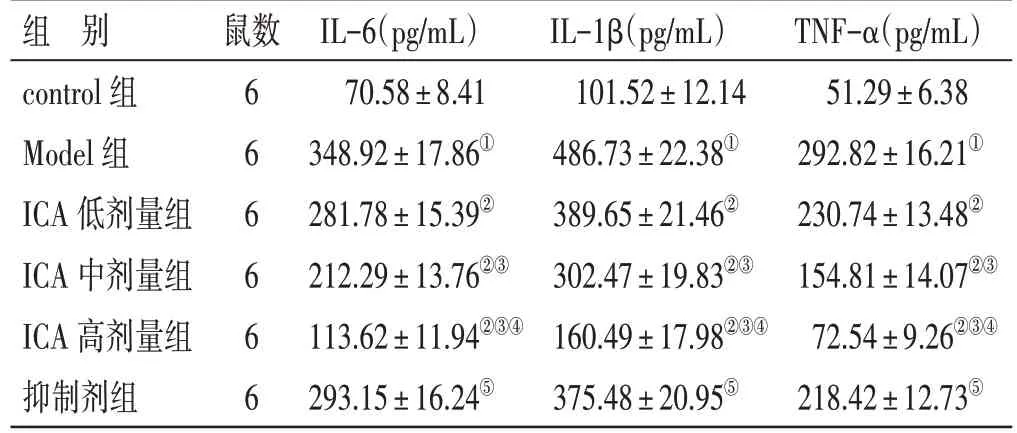
表4 各组大鼠心肌组织中IL-6、IL-1β、TNF-α 水平比较(±s)
注:①与control 组比较,P<0.05;②与Model 组比较,P<0.05;③与ICA 低剂量组比较,P<0.05;④与ICA 中剂量组比较,P<0.05;⑤与ICA 高剂量组比较,P<0.05
组 别control 组Model 组ICA 低剂量组ICA 中剂量组ICA 高剂量组抑制剂组鼠数666666 IL-6(pg/mL)70.58±8.41 348.92±17.86①281.78±15.39②212.29±13.76②③113.62±11.94②③④293.15±16.24⑤IL-1β(pg/mL)101.52±12.14 486.73±22.38①389.65±21.46②302.47±19.83②③160.49±17.98②③④375.48±20.95⑤TNF-α(pg/mL)51.29±6.38 292.82±16.21①230.74±13.48②154.81±14.07②③72.54±9.26②③④218.42±12.73⑤
2.6 各组大鼠CD31 表达比较见图3、表5。与control 组比较,Model 组大鼠心肌组织中CD31 表达水平降低(P<0.05);与Model 组比较,ICA 低、中、高剂量组大鼠心肌组织中CD31 表达水平升高,其中ICA 高剂量组变化更显著(P<0.05);与ICA 高剂量组比较,抑制剂组大鼠心肌组织中CD31 表达水平降低(P<0.05)。
表5 各组大鼠CD31 表达比较(±s)
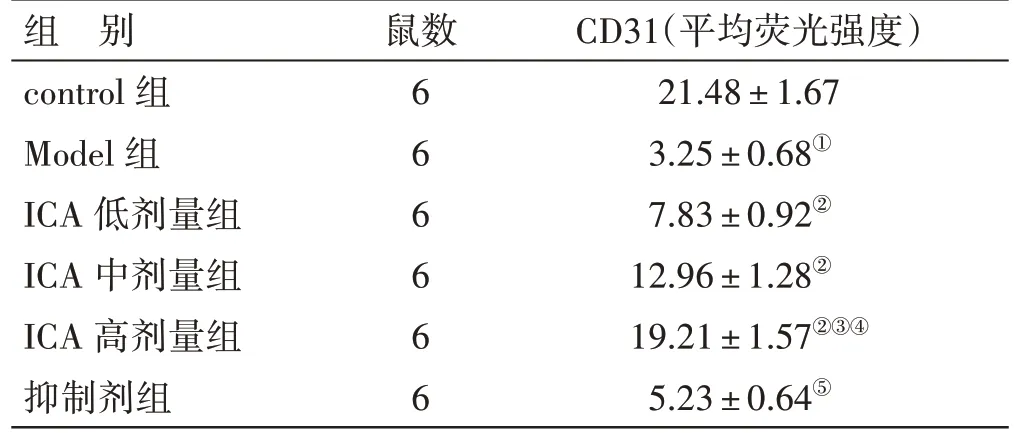
表5 各组大鼠CD31 表达比较(±s)
注:①与control 组比较,P<0.05;②与Model 组比较,P<0.05;③与ICA 低剂量组比较,P<0.05;④与ICA 中剂量组比较,P<0.05;⑤与ICA 高剂量组比较,P<0.05
组 别control 组Model 组ICA 低剂量组ICA 中剂量组ICA 高剂量组抑制剂组鼠数666666 CD31(平均荧光强度)21.48±1.67 3.25±0.68①7.83±0.92②12.96±1.28②19.21±1.57②③④5.23±0.64⑤
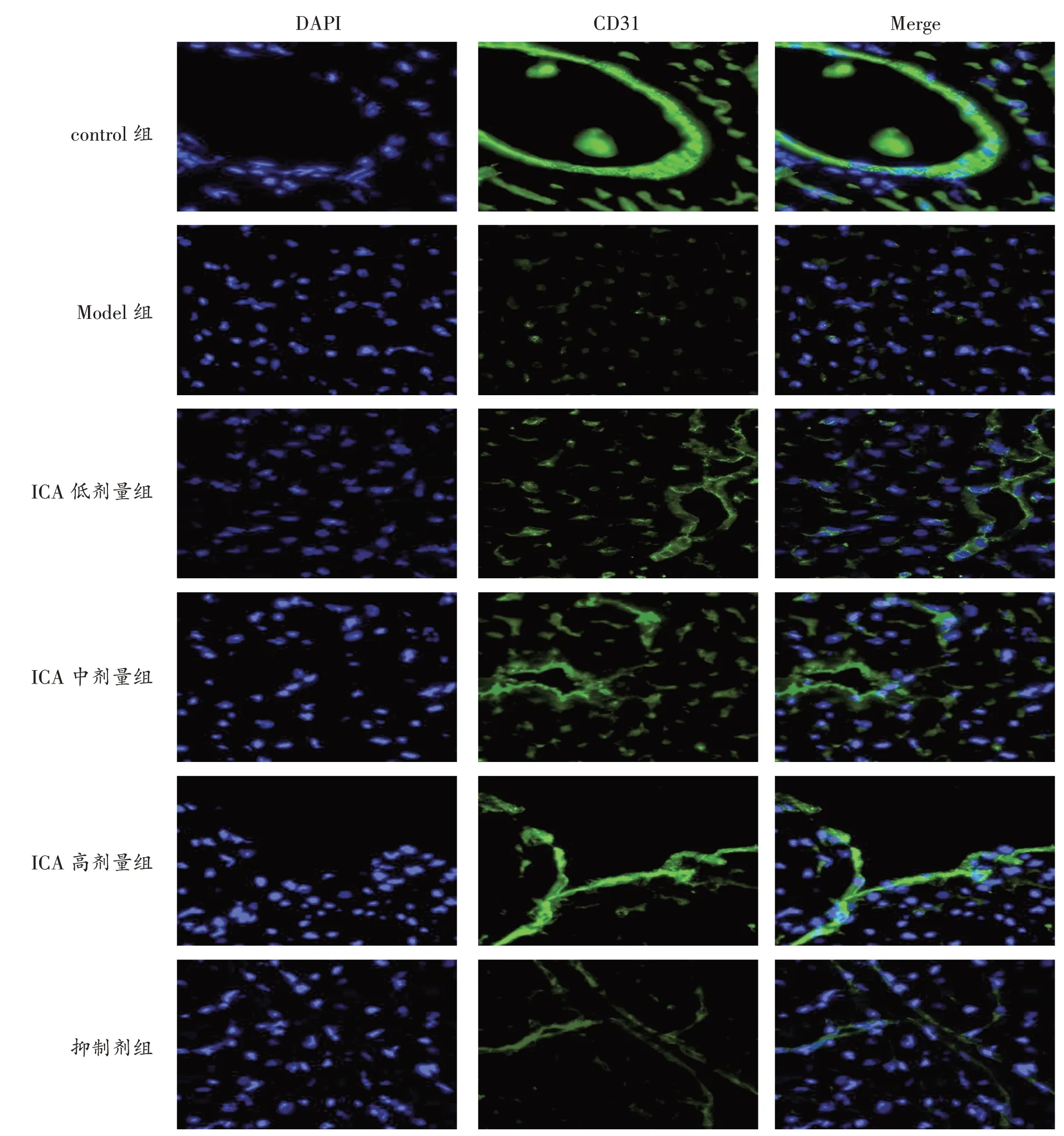
图3 各组大鼠免疫荧光检测CD31 的表达
2.7 各组大鼠心肌组织中PKG、eNOS、iNOS、sGCα 蛋白表达比较见图4、表6。与control 组比较,Model 组大鼠心肌组织中PKG、eNOS、sGCα 蛋白表达水平降低,iNOS 蛋白表达水平升高(P<0.05);与Model 组比较,ICA 低、中、高剂量组大鼠心肌组织中PKG、eNOS、sGCα 蛋白表达水平升高,iNOS 蛋白表达水平降低,其中ICA 高剂量组变化更显著(P<0.05);与ICA 高剂量组比较,抑制剂组大鼠心肌组织中PKG、eNOS、sGCα 蛋白表达水平降低,iNOS 蛋白表达水平升高(P<0.05)。
表6 各组大鼠心肌组织中PKG、eNOS、iNOS、sGCα 蛋白表达比较(±s)
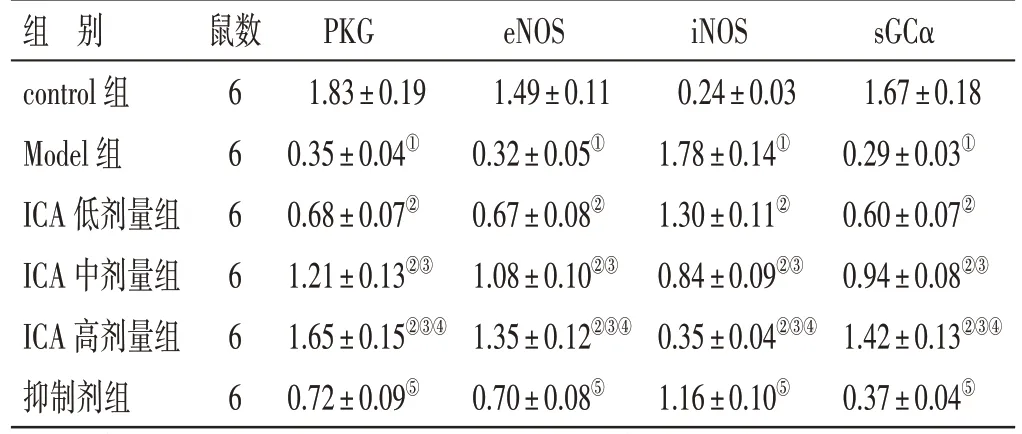
表6 各组大鼠心肌组织中PKG、eNOS、iNOS、sGCα 蛋白表达比较(±s)
注:①与control 组比较,P<0.05;②与Model 组比较,P<0.05;③与ICA 低剂量组比较,P<0.05;④与ICA 中剂量组比较,P<0.05;⑤与ICA 高剂量组比较,P<0.05
组 别control 组Model 组ICA 低剂量组ICA 中剂量组ICA 高剂量组抑制剂组鼠数666666 PKG 1.83±0.19 0.35±0.04①0.68±0.07②1.21±0.13②③1.65±0.15②③④0.72±0.09⑤eNOS 1.49±0.11 0.32±0.05①0.67±0.08②1.08±0.10②③1.35±0.12②③④0.70±0.08⑤iNOS 0.24±0.03 1.78±0.14①1.30±0.11②0.84±0.09②③0.35±0.04②③④1.16±0.10⑤sGCα 1.67±0.18 0.29±0.03①0.60±0.07②0.94±0.08②③1.42±0.13②③④0.37±0.04⑤
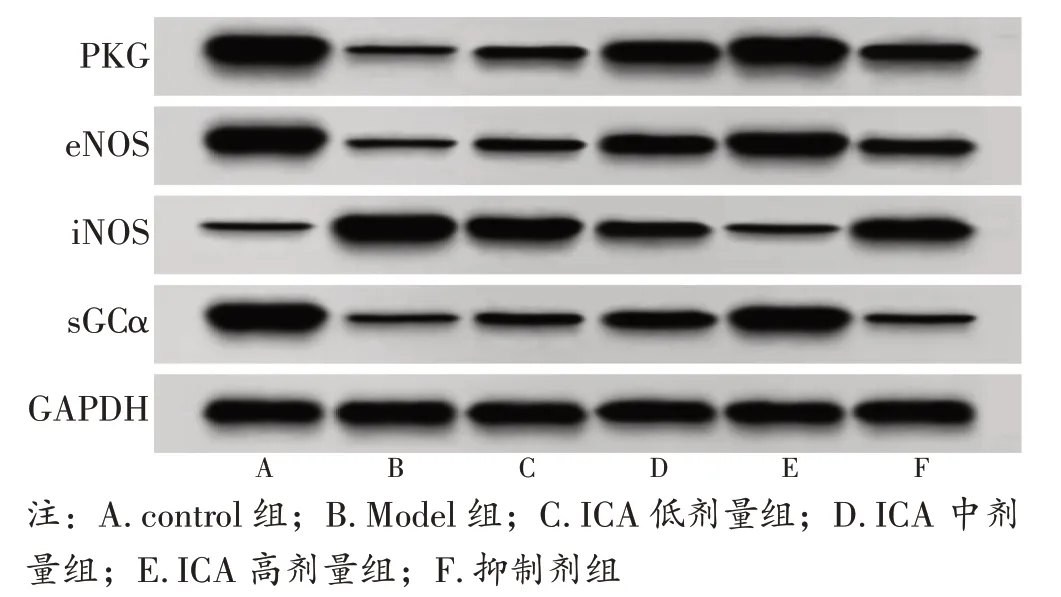
图4 Western blot 检测PKG、eNOS、iNOS、sGCα 蛋白表达
3 讨论
HFPEF 的特征是严重的左心室收缩和舒张僵硬、左心室充盈压升高、动脉顺应性降低、左心房高压、肺静脉瘀血和微血管功能障碍等[12]。内皮炎症、心室重塑与HFPEF 的发展密切相关,但潜在机制尚不清楚。
心室重塑是影响HFPEF 患者心脏功能和预后的重要病理生理机制。本研究采用皮下注射DOCA 建立HFPEF 大鼠模型并对其研究发现,Model 组大鼠LVAM、LVPW、LVEDD、LVESD、LVEDP 升高,LVEF、LVFS、E/A、LVSP、+dp/dt max、-dp/dt max降低,Model 组大鼠出现左心室肥厚、心室增大、心室舒张功能障碍,提示,HFPEF 大鼠模型构建成功。近年来,安全有效的中药成分逐渐进入人们的视野,是治疗HFPEF 的一个方向。ICA 具有良好的心脏保护作用。ICA 通过激活sirtuin-1/FOXO1 信号来保护心肌细胞免受缺血/再灌注诱导的氧化应激损伤[13]。研究发现,不同浓度的ICA 以剂量依赖性方式抑制大鼠的心脏重塑[6]。Song YH 等[14]研究发现,ICA通过调节Bcl-2/Bax 轴和基质金属蛋白酶(MMP)-2、MMP-9 的活性并减少心肌凋亡,显著改善异丙肾上腺素诱导的充血性心力衰竭大鼠心功能障碍和心肌重塑。鹿角方能改善慢性心力衰竭患者的心脏功能,而ICA 是鹿角方的主要活性成分[15]。本研究发现,ICA 能降低LVAM、LVPW、LVEDD、LVESD、LVEDP,升高LVEF、LVFS、E/A、LVSP、+dp/dtmax、-dp/dt max,ICA 可显著改善HFPEF 大鼠的心脏功能及心室重塑。
微血管内皮炎症可能是HFPEF 的关键分子机制。促炎细胞因子(IL-6、IL-1β、TNF-α)已被证明可以刺激微血管内皮细胞中ROS 的产生。ROS 的过量产生导致NO 生物利用度降低,从而降低邻近心肌细胞中cGMP 以及PKG 的浓度[16]。NO 可由eNOS 催化L-精氨酸生成,通过血管外扩散到血管平滑肌细胞中,可与其受体结合,促进sGC-cGMP-PKG 通路的活性,引起血管平滑肌松弛和血管舒张。抑制NO-cGMP-PKG 通路可能会增加舒张期的被动张力、心肌肥大和僵硬,导致舒张功能障碍,因此,NO-cGMP-PKG 通路介导微血管内皮炎症在HFPEF的治疗中具有重要价值[17]。研究表明,达格列净(钠-葡萄糖共转运蛋白2 抑制剂)可以通过抑制主动脉交感神经张力和调节NO-cGMP-PKG 通路来降低炎症反应,并逆转HFPEF 期间的左心室重塑[18]。在心肌中,激活的NO-cGMP-PKG 通路通常具有抗肥大、抗纤维化和血管生成作用,从而抑制心脏重塑。iNOS 是内皮功能障碍和血管炎症的关键调节因子,CD31 是血管内皮细胞分化的标志物,HFPEF 小鼠心肌组织中iNOS 上调表达,CD31 下调表达[19]。本研究发现,在HFPEF 大鼠心肌组织中,IL-6、IL-1β、TNF-α、iNOS 炎性因子与氧化应激产物ROS 水平显著升高,NO、cGMP 水平、CD31 及PKG、eNOS、sGCα 蛋白表达水平显著降低,ICA 可降低IL-6、IL-1β、TNF-α、iNOS 炎症因子水平,升高NO、cGMP 水平、CD31、PKG、eNOS、sGCα 表达,改善微血管内皮炎症。L-NAME 作为NOS 的抑制剂,会引起内皮功能障碍及炎症反应[20]。在本研究中,L-NAME 抑制NO-cGMP-PKG 通路激活的同时,显著逆转ICA 对炎症反应的抑制作用,减轻对心脏功能及心室重塑的改善作用。提示,ICA 可能通过激活NO-cGMP-PKG 通路,减轻炎症反应、改善心室重塑。
综上所述,ICA 可能通过激活NO-cGMP-PKG通路,减轻炎症反应、改善心室重塑。本研究为治疗HFPEF 提供了理论和药物参考。然而本研究尚存在不足之处,仅验证NO-cGMP-PKG 信号通路,未对其他靶点、途径进行验证,后续研究将会进一步明确ICA 在HFPEF 中的作用机理。
