杉木凋落物对魔芋的生长及其生理生化影响研究
2024-03-06朱临渊曹受金颜惠芳彭翠英廖德志梁军生杨鹏华龚雄夫王旭军
朱临渊,曹受金,颜惠芳,彭翠英,廖德志,梁军生,杨鹏华,龚雄夫,王旭军
(1.中南林业科技大学,湖南 长沙 410004; 2.湖南省林业科学院,湖南 长沙 410004; 3.新化县湘鑫农业综合开发有限公司,湖南 新化 417699; 4.新化县林业局,湖南 新化 417699)
魔芋(Amorphophalluskonjac),别称磨芋、花魔芋等,为天南星科(Araceae)魔芋属(Amorphophallus)多年生草本植物,常生于疏林下、林缘或溪谷两旁湿润地等[1]。魔芋含有丰富的碳水化合物,热量低,蛋白质含量高于马铃薯和甘薯,微量元素丰富,还含有维生素A、维生素B等[2],特别是其葡甘聚糖含量丰富。葡甘聚糖是魔芋的主要成分,在可食性膜和各种食品添加剂方面应用广泛[3-4],对人体有促进减肥、通便等作用[5],可改善糖尿病患者的碳水化合物代谢[6],降低甲亢患者血清甲状腺激素水平[7],防止结肠癌风险形成[8],还有调节脂质代谢等功能。同时,魔芋具喜温暖湿润、忌高温干旱、耐荫蔽等习性[9],为湖南省适于林下种植的重要作物之一。
杉木(Cunninghamialanceolata)为湖南省的重要用材树种,有生长快、产量高、材质好、用途广等特点,在湖南林业生产中占重要地位[10]。凋落物是连接杉木林和土壤的重要“纽带”,杉木凋落物在维持杉木人工林土壤肥力等方面起着重要作用[11]。
研究表明,林木凋落物产生的化感物质能影响林下种子萌发及幼苗生长。李梦琪等[12]发现低浓度的杉木凋落物和木荷(Schimasuperba)凋落物对杉木幼苗萌发和成长起到一定的促进作用,晋梦然等[13]发现格氏栲(Castanopsiskawakamii)天然林凋落物低质量浓度浸提液对杉木种子萌发总体呈促进或轻微的抑制作用。沈文涛等[14]发现连香树(Cercidiphyllumjaponicum)凋落物浸提液在高浓度下对连香树种子萌发表现出抑制作用。因此凋落物是林下植物生长的重要环境因子[15]。但关于魔芋与杉木凋落物之间的相互作用目前则未见报道。因此,本研究分析了不同浓度杉木凋落物浸提液对魔芋叶柄长度、叶柄直径、叶盘直径等形态性状、叶、根及块茎鲜(干)质量、块茎葡甘聚糖含量以及叶片酶活性和光合特性等指标的影响,以期为魔芋杉木林下高效栽培提供理论依据。
1 试验地概况
试验地设在长沙市雨花区湖南省林业科学院杜家冲试验林场,地理位置为112°59′E,28°05′N,为中亚热带季风性湿润气候区,年均气温达17.2℃,且光照充足,年均日照达1 496~1 850 h。同时,研究区雨量丰沛,年均降水量达1 400~1 900 mm,无霜期为264 d。此外,研究区海拔较低,为110 m,土壤为砂岩红壤,深达60 cm以上,肥力中等,pH为6.2。
2 材料与方法
2.1 试验材料
魔芋:2022年4月,以无病斑、无裂痕、形状整齐、大小一致、叶芽短而粗壮、球茎质量约150 g 的魔芋块茎作种芋种植于高28 cm、直径18 cm的桶状容器中。
杉木浸提液:将杉木林下原状枯落物和半分解枯落物洗净、烘干、粉碎,过1 mm筛后按料液比1∶5加入蒸馏水,于室温条件下震荡48 h,然后过滤所得液体即为200 g·L-1的母液。
2.2 试验设计
本试验设置5个杉木浸提液浓度梯度,分别为0(蒸馏水处理,对照)、 25 、 50、 100和200 g·L-1,每个处理10钵,完全随机区组设计,3次重复。
从2022年7月上旬开始每2 d浇灌1次浸提液,每钵每次浇灌50 mL。施加1个月杉木凋落物浸提液后,2022年8月上旬开始取不同浓度处理的魔芋叶片用做酶活性试验,每隔7 d取1次,共5次。施加2个月杉木凋落物浸提液后,将魔芋整株取出,将地上和地下部分分开,测定其生长指标;地下部分测定完后将魔芋块茎切碎、烘干、磨粉后用作魔芋葡甘聚糖试验。
2.3 指标调查与方法
2.3.1 生长指标的测定
测量指标为叶柄长度、叶柄直径、叶盘直径、叶柄鲜(干)重、根鲜(干)重及块茎鲜(干)重。每个浓度处理下的魔芋选择5株,用钢卷尺测定叶柄长度(地面到叶柄分叉处的长度)和叶盘直径(叶片张开角度最大的距离,精确到0.1 cm),用游标卡尺测定叶柄直径(叶柄基部紧贴地面直径,精确到0.01 cm),用电子天平称量其叶柄鲜(干)重、根鲜(干)重及块茎鲜(干)重(精确到0.01 g)。
2.3.2 葡甘聚糖含量测定
首先,将魔芋块茎切片、干燥、粉碎;然后,按3,5-二硝基水杨酸显色法[16]测定葡甘聚糖的含量。
2.3.3 叶片酶活性的分析[17]
丙二醛(MDA)含量测定采用硫代巴比妥酸法测定,过氧化物歧化酶 (POD)活力测定采用愈创木酚法测定,超氧化物歧化酶(SOD)活力采用抑制氮蓝四唑的光还原作用测定。每隔7 d测定1次,共测定5次。
2.3.4 光合特性的测定
光响应曲线和二氧化碳(CO2)响应曲线的测定参照王孟等[18]的方法。具体设置如下:PAR梯度设置为1 400、1 200、1 000、800、600、400、200、100、60、40、20、0 μmol·m-2·s-1;CO2浓度梯度设置为400、300、200、100、50、20、400、600、800、1000、1 200、1 400、1 600、1 800、2 000 μmol·mol-1。
2.4 数据统计与分析
所有数据利用Microsoft Office Excel软件进行整理,并利用IBM SPSS statistics 24.0软件进行方差分析和多重比较。
光补偿点(LCP)、光饱和点(LSP)、最大光合速率(Pmax)和暗呼吸(Rd)采用叶子飘等[19-20]的双曲线修正模型计算。表观量子利用效率(AQY)用光补偿点(LCP)附近线性回归斜率表示。羧化效率(CE)用二氧化碳补偿点(Г)附近线性回归斜率表示。
3 结果与分析
3.1 杉木凋落物浸提液对魔芋地上部分生长的影响
由表1可知,不同浓度杉木浸提液处理对魔芋地上部分形态性状及其生物量均存在显著影响。随着浸提液浓度逐渐提高,叶柄长度、叶柄直径逐渐减小(对照除外)。浸提液浓度为25 g·L-1时其叶柄长度、叶柄直径均为最大值,稍高于对照组;当浸提液浓度达200 g·L-1时,其叶柄长度、叶柄直径均为最小值,且与对照相比达到显著性差异。而就叶盘直径来说,当浸提液浓度为25 g·L-1时,叶盘直径反而增大,此后则随着浸提液浓度的逐渐提高而持续减小,直至200 g·L-1时达到最小值。
由表1可知,当浸提液浓度为25 g·L-1时,叶柄鲜重和叶柄干重与对照组相比无显著性差异。此后,随着浸提液浓度的逐渐升高,叶柄鲜重、叶柄干重却逐渐减小;当浸提液浓度达到200 g·L-1时,叶柄鲜重、叶柄干重达到最小值且与对照组相比存在显著性差异。

表1 不同浓度杉木凋落物浸提液对魔芋地上部分生长的影响Tab.1 Effects of different concentrations of Cunninghamia lanceolata litter extracts on the aboveground growth of Amorphophallus konjac浸提液浓度/(g·L-1)叶柄长度/cm叶柄直径/mm叶盘直径/cm叶柄鲜重/g叶柄干重/g056.80±8.25 a20.29±1.66 a55.40±4.18 ab162.74±46.82 a16.66±7.82 ab2557.90±3.56 a20.45±1.29 a62.86±4.11 a167.23±20.91 a16.99±1.88 a5055.00±8.16 ab18.78±5.26 ab54.94±7.62 ab149.11±50.79 ab13.56±4.38 ab10045.06±4.17 bc18.47±4.56 ab53.18±5.05 b119.32±27.56 ab12.70±2.44 ab20043.90±7.42 c15.44±1.45 b52.92±6.10 b113.51±26.12 b10.60±2.91 b 注:同一列中不同小写字母表示在0.05水平存在显著差异。下同。
3.2 杉木凋落物浸提液对魔芋地下部分生长的影响
由表2可知,在不同浓度的杉木浸提液处理下,魔芋根的鲜重和干重均没有显著性差异,说明杉木浸提液对根的质量影响不大。而对于魔芋块茎而言,在浓度低于50 g·L-1时,随着浸提液浓度的逐渐升高,块茎的鲜重和干重也逐渐升高,当浓度达到50 g·L-1时达到最大值;而当浓度超过50 g·L-1时,随着浸提液浓度的逐渐升高,块茎的鲜重和干重却逐渐减小,在浓度为200 g·L-1时达到最小值。

表2 不同浓度杉木凋落物浸提液处理对魔芋地下部分生长的影响Tab.2 Effects of different concentrations of Cunninghamia lanceolata litter extracts on the growth of underground part of Amorphophallus konjac浸提液浓度/(g·L-1)根鲜重/g根干重/g块茎鲜重/g块茎干重/g019.35±9.11 a2.15±1.44 a118.12±16.21 ab16.74±3.15 ab2519.01±12.83 a1.64±0.44 a119.13±10.31 ab17.09±1.77 ab5024.23±19.21 a2.62±1.75 a138.04±31.49 a20.02±2.83 a10021.15±2.53 a3.52±1.42 a125.05±23.98 ab18.25±4.03 ab20022.50±9.26 a3.38±1.36 a105.42±22.31 b15.47±2.47 b
3.3 杉木凋落物浸提液对魔芋葡甘聚糖含量的影响
由图1可以看出,在50 g·L-1浓度下,魔芋葡甘聚糖含量显著高于其他组,其他组分之间无明显差异,且200 g·L-1略低于对照组,100 g·L-1高于对照组。说明一定浓度的杉木浸提液可提高魔芋葡甘聚糖的含量,且当浓度在50 g·L-1附近时,提高效果最好。

图1 不同浓度杉木凋落物浸提液对魔芋葡甘聚糖含量的影响Fig.1 Effects of different concentrations of Cunninghamia lanceolata litter extracts on glucomannan content of Amorphophallus konjac
从图1还可以看出,在浓度高于50 g·L-1时,随着杉木浸提液浓度的升高,葡甘聚糖含量却减少,当浓度达到200 g·L-1时达到最小值,且与对照相比无显著差异。当浓度下降到25 g·L-1时,葡甘聚糖含量与对照组无明显差异,且数值略低于对照组,说明当杉木浸提液浓度过低时,则对葡甘聚糖含量没有显著影响。
3.4 杉木凋落物浸提液对魔芋叶片酶活性的影响
3.4.1 杉木凋落物浸提液对魔芋叶片SOD酶活性的影响
由图2可知,魔芋叶片的SOD酶活性总体呈随时间延长而下降的趋势。其中,200 g·L-1浓度的杉木凋落物浸提液处理下的SOD酶活性下降最快,而在其他浓度杉木凋落物浸提液处理下的SOD酶活性下降则较为平缓,其中,0 g·L-1浓度杉木凋落物浸提液处理的SOD酶活性下降趋势最为平缓。由于SOD 基因的启动子是组成型启动子,SOD酶活性受叶片自身衰老程度影响,说明施加杉木凋落物浸提液会使叶片加速衰老,且施加高浓度200 g·L-1的杉木凋落物浸提液会大大提高叶片的衰老速度。

图2 不同浓度杉木凋落物浸提液对魔芋叶片SOD酶活性变化的影响Fig.2 Effects of different concentrations of Cunninghamia lanceolata litter extracts on SOD activity changes in Amorphophallus konjac leaves
3.4.2 杉木凋落物浸提液对魔芋叶片POD酶活性的影响
由图3可知,魔芋叶片POD活性总体呈随时间延长先上升后下降的趋势。其中200 、100 g·L-1浓度杉木凋落物浸提液处理下的POD初始酶活性较高,且在第14天就达到峰值,从第14天开始POD酶活性开始下降并在第28天到达最低点;而50、25、0 g·L-1浓度杉木凋落物浸提液处理下的魔芋叶片POD酶活性初始较低,在第21天达到活性峰值并且开始下降,在第28天达到最低点。POD酶为诱导酶,受SOD酶影响对活性氧和自由基分解后产生的过氧化氢进行诱导。在魔芋生长过程中叶片中的活性氧和自由基增多,SOD酶分解产生过氧化氢也越多,诱导魔芋叶片的POD酶活性上升;而当叶片开始衰老时,SOD酶活性下降,分解产生过氧化氢减少,此时POD酶活性也下降;所以POD酶活性变化总体呈现上升达到峰值后下降的趋势。而200、100 g·L-1浓度杉木凋落物浸提液处理下的POD活性初始高于其他浓度且先达到峰值,说明较高浓度的杉木凋落物浸提液能使魔芋叶片中活性氧和自由基增加,使其POD酶活性相对提前达到峰值,也说明较高浓度杉木凋落物浸提液能促使叶片提前衰老。
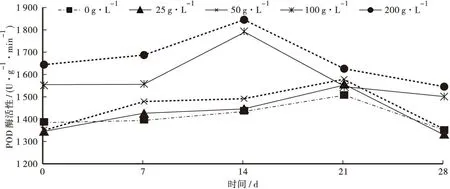
图3 不同浓度杉木凋落物浸提液对魔芋叶片POD酶活性变化的影响Fig.3 Effects of different concentrations of Cunninghamia lanceolata litter extracts on POD activity changes in Amorphophallus konjac leaves
3.4.3 杉木凋落物浸提液对魔芋叶片MDA含量的影响
由图4可知,魔芋叶片的MDA含量总体呈随时间推移而上升的趋势。其中25、50 g·L-1浓度杉木凋落物浸提液处理下的MDA含量和空白对照初始差异不大,而200、100 g·L-1浓度杉木凋落物浸提液处理下的MDA含量始终高于其他浓度,200 g·L-1略高于100 g·L-1。在7~14 d,50 g·L-1浓度处理下的MDA含量开始显著增加,在14 d时显著高于25 g·L-1和空白对照,此时25 g·L-1浓度处理下的MDA含量和空白对照处理差异仍然不大,而在14~21 d时25 g·L-1浓度处理下的MDA含量开始显著增加,在21 d时高于空白对照,空白对照则在21~28 d时MDA含量才开始显著增加。综上可知,越高浓度杉木凋落物浸提液处理,叶片MDA含量越高且MDA含量显著上升的时间也越早。
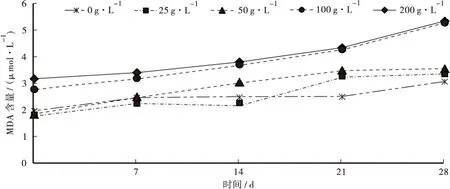
图4 不同浓度杉木凋落物浸提液对魔芋叶片MDA含量变化的影响Fig.4 Effects of different concentrations of Cunninghamia lanceolata litter extracts on MDA content in Amorphophallus konjac leaves
3.5 杉木凋落物浸提液对魔芋光合特性的影响
3.5.1 杉木凋落物浸提液对魔芋光响应的影响
由表3和图5可知,不同浓度杉木凋落物浸提液处理下的魔芋对光强有着不同的响应特征,不同处理下的光饱和点(LSP)无显著差异。最大净光合速率(Pmax)、光补偿点(LCP)、光饱和点(LSP)先随杉木凋落物浸提液浓度的升高而增大,在浓度达到50 g·L-1时达到最大值,然后减小。呼吸速率(RD)和表观量子效率(AQY)也先随杉木凋落物浸提液浓度的升高而增大,在浓度达到100 g·L-1时达到最大值,然后减小。光补偿点(LCP)和光饱和点(LSP)反映植物对外界光环境的需求,是植物叶片在弱光和强光下的适应状态[21],表观量子效率(AQY)则反映植物对弱光的利用能力[22],光饱和点(LSP)、光补偿点(LCP)、表观量子效率(AQY)均先随杉木凋落物浸提液浓度的升高而增大,然后再减小,说明低浓度的杉木凋落物浸提液可以提高魔芋在低光强下的光照需求以及增强对弱光利用的能力,而当浓度超过100 g·L-1后,则会减小魔芋在低光强下的光照需求以及减弱对弱光的利用能力。

图5 不同浓度杉木凋落物浸提液处理下魔芋光响应曲线Fig.5 Light response curves of Amorphophallus konjac under different concentrations of Cunninghamia lanceolata litter extract

表3 不同浓度杉木凋落物浸提液处理下魔芋光响应和二氧化碳响应Tab.3 Light and carbon dioxide indicators response of Amorphophallus konjac to different concentrations of Cun-ninghamia lanceolata litter extract浓度PmaxRDLCPLSPAQYCEГ011.11±0.66 ab1.70±0.26 ab20.83±1.33 a817.81±99.24 a0.090 3±0.002 4 ab0.013 0±0.010 0 a78.89±2.16 a2511.28±0.59 ab1.80±0.65 a17.50±1.06 b845.40±28.24 a0.065 6±0.002 7 c0.012 9±0.020 0 a76.21±1.61 a5011.70±0.91 a1.86±0.18 a21.95±1.22 a885.47±46.56 a0.093 8±0.005 5 a0.013 4±0.000 8 a59.69±14.17 b1009.56±1.12b c1.87±0.16 a20.51±0.62 a836.85±18.90 a0.104 2±0.012 8 a0.012 2±0.000 7 ab69.83±5.63 ab2009.00±1.24 c1.09±0.17 b15.62±2.41 b831.43±27.14 a0.076 3±0.075 0 bc0.010 4±0.001 4 b75.94±3.24 a 注: 表中浓度单位是g·L-1;Pmax、RD、LCP、LSP、CE、Г单位均为μmol·m-2 ·s-1;AQY单位为mol·mol-1。
3.5.2 杉木凋落物浸提液对魔芋二氧化碳浓度响应的影响
由表3和图6可知,不同浓度杉木凋落物浸提液处理下的魔芋对二氧化碳浓度有着不同的响应特征。

图6 不同浓度杉木凋落物浸提液处理下魔芋二氧化碳响应曲线Fig.6 Carbon dioxide response curves of Amorphophallus konjac under different concentrations of Cunninghamia lanceolata litter extract
羧化效率(CE)先随着浓度的升高而增大,当浓度达到50 g·L-1时达到最大值,然后随浓度的升高而减小。二氧化碳补偿点(Г)则是先随杉木凋落物浸提液的浓度升高而减小,在50 g·L-1达到最小值,然后随浓度升高而增大。羧化效率(CE)反映植物对二氧化碳的利用能力,二氧化碳补偿点(Г)反映了植物对外界二氧化碳的需求,这说明低浓度的杉木凋落物浸提液可提高二氧化碳的利用能力,降低对二氧化碳的需求;而当浓度超过100 g·L-1后,减弱对弱光和二氧化碳的利用能力,提高对二氧化碳的需求。
3.5.3 杉木凋落物浸提液对魔芋水分利用效率的影响
水分利用效率(Water use efficiency,WUE)可用叶片净光合速率和蒸腾速率的比值来表示。植物叶片水分利用效率的值越大,其适应能力越强。
由图7可以看出,不同浓度处理下魔芋叶片的水分利用效率变化趋势大致相同,在光照强度低于200 μmol·m-2·s-1时,WUE随光照强度增强而快速上升;当光照强度超过200 μmol·m-2·s-1时,WUE随光照强度升高变化平稳,最后缓慢减小;且在光照强度超过200 μmol·m-2·s-1后,25 g·L-1浓度的WUE值最大且高于空白对照,其他浓度则低于空白对照且随浓度升高WUE逐渐降低,在浓度达到200 g·L-1时WUE达到最小值。说明浓度超过25 g·L-1的杉木浸提液会降低魔芋的水分利用效率,这可能是因为高浓度的杉木浸提液会对魔芋产生不良影响,使魔芋适应能力减弱,其水分利用效率值也随着减小。

图7 不同浓度杉木凋落物浸提液处理下魔芋WUE随光照强度的变化Fig.7 WUE changes of Amorphophallus konjac under different concentrations of Cunninghamia lanceolata litter extract treatment with light intensities
4 结论与讨论
杉木凋落物分解时会产生大量次生代谢物质[23],会对魔芋起化感作用[24],从而对魔芋的生长影响显著。杉木凋落物浸提液对魔芋地上部分的生长影响表现为在25 g·L-1时具有促进作用。而在浓度高于25 g·L-1时反而产生抑制作用,各项指标随着浸提液浓度升高而减小,这说明杉木凋落物浸提液对魔芋地上部分生长的影响具有高浓度抑制、低浓度促进的效应,这与庄正等[25]的研究一致,也说明化感物质对植物的生长具有双重效应,既有有利的影响,也会产生不利因素[26]。
就杉木凋落物浸提液对魔芋地下部分的影响而言,浸提液对魔芋根的生长没有显著影响,但对魔芋块茎鲜重及干重的影响则与地上部分相似。随着浸提液浓度的升高,表现为先促进后抑制,在浓度为25、50 g·L-1时起促进作用,但高于50 g·L-1时,各项指标随着浸提液浓度升高而减小。
杉木凋落物浸提液对魔芋葡甘聚糖含量的影响则与其对魔芋地下部分生长的影响相同。在浓度为25、50 g·L-1时,魔芋葡甘聚糖含量高于空白对照组,但当浓度高于50 g·L-1时,随着浸提液浓度升高,魔芋葡甘聚糖含量开始减少。
而杉木凋落物浸提液对魔芋叶片酶活性的影响则表现为随着浸提液浓度升高,POD酶活性也越高,但其达到峰值开始减小的时间也越早,SOD酶活性下降越快,MDA含量积累越早。这说明杉木凋落物浸提液含有能让魔芋叶片加速衰老的物质。
不同浓度杉木凋落物浸提液处理下的魔芋水分利用效率随光照强度变化趋势大致相同。在光照强度低于200 μmol·m-2·s-1时,WUE随光照强度增强而快速上升;当光照强度超过200 μmol·m-2·s-1时,WUE随光照强度变化趋于平缓。另外,浓度超过25 g·L-1的杉木浸提液会对魔芋产生不良影响,使魔芋适应能力减弱,其WUE也随着减小。低浓度的杉木凋落物浸提液可以提高魔芋在低光强下的光照需求且增强对弱光和二氧化碳的利用能力,降低对二氧化碳的需求;而当杉木凋落物浸提液的浓度超过100 g·L-1后,则会减小魔芋在低光强下的光照需求,且减弱对弱光和二氧化碳的利用能力,提高对二氧化碳的需求。
通过以上研究,发现在杉木凋落物浸提液浓度提高的过程中,浸提液对魔芋的影响总会由促进作用转化为抑制作用,一般表现为低浓度促进高浓度抑制,这可能是因为浸提液中含有的酚酸类化感物质对魔芋有一定的影响。在较低含量下会刺激魔芋进一步生长,从而使魔芋的生长及品质有所提升;而当它们的含量过高时,超过了魔芋的调节能力则会对魔芋产生毒害作用,抑制魔芋生长,降低魔芋品质。所以在实际种植过程中要控制好杉木凋落物的量,避免对魔芋产生不利影响,而关于这些化感物质的具体成分及其产生不利影响时的具体含量则有待进一步研究。
