CD4+T细胞亚型及其相关炎性因子在NE-FE-COPD患者中的表达及意义*
2024-03-06杨春晓余维巍
杨春晓,叶 婷,余维巍△
(华中科技大学同济医学院附属同济医院:1.老年医学科;2.临床营养科,武汉430030)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以肺部气流受限为主要表现的慢性不可逆呼吸系统疾病[1]。频繁急性加重(frequent exacerbator,FE)型是COPD中最常见的表型之一,患者生活质量较差,社会经济负担重[2]。按主要致炎细胞不同,可将其分为中性粒细胞优势型频繁急性加重型(NE-FE-COPD)和嗜酸性粒细胞优势型频繁急性加重型(Eos-FE-COPD)[3-4]。Eos-FE-COPD患者激素治疗效果较好[5-6]。NE-FE-COPD患者诱导痰及支气管肺泡灌洗液(bronchoalvoelarlavagefluid,BALF)的中性粒细胞所占比例明显增加,气道及全身炎性因子表达升高,对激素治疗不敏感且患者临床治疗效果较差[7-8],急需进一步了解其发病机制以寻求新的治疗手段。
CD4+T细胞是参与COPD发生、发展的主要免疫细胞之一[9]。连续刺激的T细胞归巢受体及共刺激分子CD28表达降低,从而形成CD4+CD28nullT细胞,是一种代表细胞免疫功能老化的表型。CD4+CD28nullT细胞受刺激后重复增殖,生成大量炎性因子如白细胞介素(interleukin,IL)-1β、γ-干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),伴随细胞毒性分子穿孔素和颗粒酶B的蛋白表达升高,形成COPD炎症微环境[9]。本研究旨在通过研究CD4+T细胞亚型及相关炎性因子在不同表型COPD患者中的表达,探讨其作用机制。
1 资料与方法
1.1 一般资料
选取2019年3月至2021年3月于本院接受治疗的COPD患者为研究对象,收集受试者的详细临床病史,采用标准肺功能检测方法对其进行综合肺功能测试。根据慢性阻塞性肺疾病全球倡议(global initiative for chronic obstructive lung disease,GOLD)2021的诊断标准,按病史将COPD患者分为FE-COPD组(n=28)和非频繁急性加重型组(IE-COPD组,n=11)。FE-COPD组为每年至少要经历2次或以上急性加重,需补充抗生素和/或全身性类固醇治疗或住院治疗,且每次急性加重在前次疾病治疗稳定后至少4周再出现;未达到上述要求患者纳入IE-COPD组。依据诱导痰嗜酸性粒细胞、中性粒细胞的比例,以及IL-1β、IL-4、IL-5、TNF-α水平,将FE型再分为嗜酸性粒细胞优势组(Eos-FE-COPD组,n=13)与中性粒细胞优势组(NE-FE-COPD组,n=15)[7-8],鉴于IE型患者病情稳定,GOLD多年来治疗建议没有变化,故本文不再做细胞亚型分组。COPD纳入标准:(1)40~80岁;(2)吸烟史>10包/年;(3)第1秒用力呼气容积占预测值百分比(FEV1/pred%)和用力肺活量(FVC)的比值≤70%;(4)入组前至少4周无急性发作。排除标准:(1)其他呼吸系统疾病,如发作性气胸、肺栓塞、哮喘、肺纤维化及中心型肺癌等;(2)其他慢性疾病,如心功能不全、类风湿性关节炎、慢性结肠炎等;(3)既往3个月内中风、短暂性脑缺血发作、急性冠状动脉综合征等;(4)哺乳期、妊娠期或计划妊娠;(5)过去12个月内有肺切除手术史,或其他可能影响肺功能检查结果的手术史;(6)未治愈的恶性肿瘤及酗酒、药物成瘾;(7)有精神病史、智力问题等不能配合本研究的相关检查;(8)不能纠正的出血倾向、多发肺大疱、一般状况极差不能耐受支气管镜检查。对照组(CTRL组,n=9)为肺功能正常及吸烟史>10包/年者。本研究获得医院伦理委员会批准(2019PS342K),患者及家属签署知情同意书。各组受试者临床基线资料见表1。
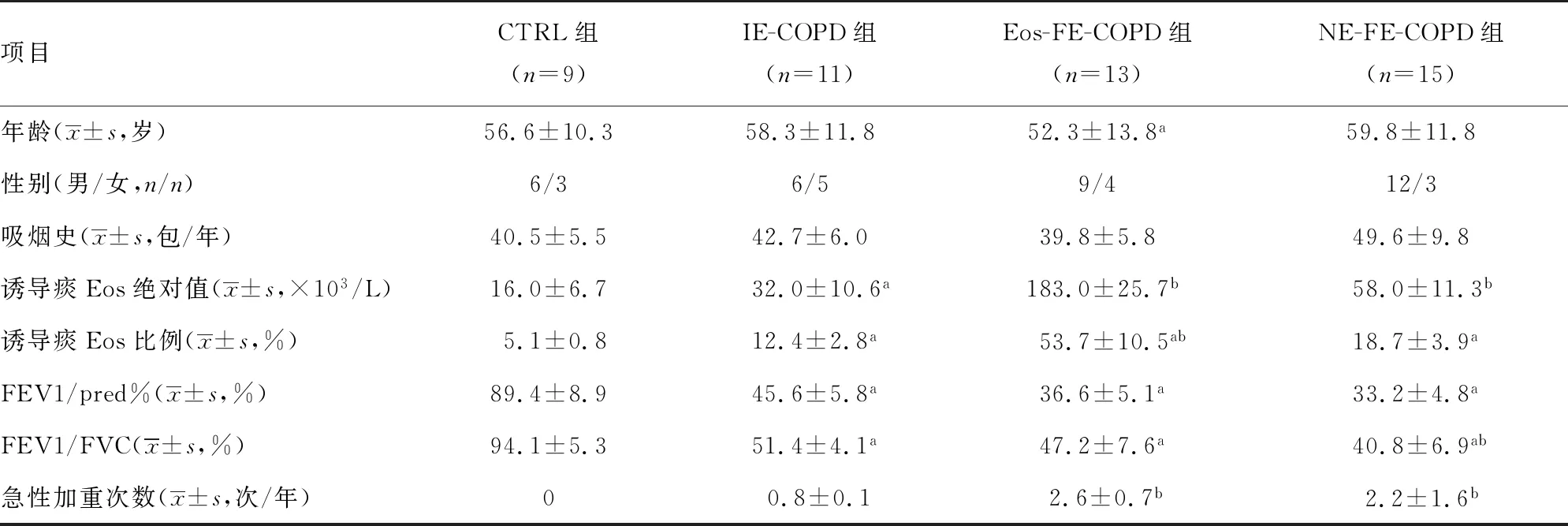
表1 各组受试者的临床基线资料比较
1.2 方法
1.2.1标本采集
入组24 h内用100 mL生理盐水对所有受试者行支气管镜肺泡灌洗术,负压回收量>40%定义为回收成功,Ficoll密度梯度离心及贴壁法原代分离BALF的单核细胞。
1.2.2流式细胞术检测CD4+T细胞亚群表达
应用流式细胞仪(美国BD公司,FACSCantoTMⅡ)检测患者BALF标本CD4+CD28+T细胞、CD4+CD28nullT细胞占比,分析CD4+T细胞亚群比例和不同表型COPD的相关性。实验方法和步骤:(1)细胞悬液采用荧光素异硫氰酸酯(FITC)标记的抗CD4和/或电子偶合染料(ECD)标记的抗CD28染色30 min;(2)细胞清洗后取单细胞悬液(1~2)×105个细胞于10 mL PBS中,置于流式细胞仪,分别对CD4+CD28nullT细胞及总CD4+T细胞的数量进行检测。CD4+CD28nullT细胞占比=CD4+CD28nullT细胞数/总CD4+T细胞数×100%。
1.2.3ELISA检测炎性因子水平
采用ELISA检测BALF中IL-1β、IL-2、IL-6、IL-8和TNF-α水平,试剂盒购自武汉云克隆科技有限公司,操作步骤按照说明书执行。
1.2.4细胞共培养
向荧光示踪分子CFSE所标记的人气道上皮细胞(hAECs)分别添加CD4+CD28nullT细胞和CD4+CD28+T细胞,分为CD4+CD28+T细胞+hAECs组(Control组)和CD4+CD28nullT细胞+hAECs组(co-culture组),共培养72 h后采样。
1.2.5免疫荧光染色
CD4+CD28nullT细胞和CD4+CD28+T细胞对上皮细胞刺激72 h,甲醇-丙酮混合液(50∶50)将上皮细胞固定,0.3%(体积分数)Triton X-100通透,5%(质量分数)脱脂奶粉密封。部分细胞用Alexa Fluor 488 标记anti-occludin抗体(1∶100,美国Invitrogen公司)直接染色,部分细胞用anti-ZO-1抗体(1∶200,美国Invitrogen公司)孵育过夜后,加入Alexa 488标记的二抗。DAPI复染封片后在激光共聚焦显微镜(日本Olympus公司,IX81)下进行观察。
1.2.6Western blot检测ZO-1、occludin蛋白表达水平
提取细胞,添加蛋白裂解液及蛋白酶抑制剂使细胞完全裂解,放入冰上静置30 min析出组织或细胞碎片,12 000 r/min 4 ℃离心30 min,取上清液,BCA法定量蛋白,将含β-巯基乙醇缓冲液以1∶3的量加入蛋白上清液内,在100 ℃水浴锅内加热变性5 min。制备10%十二烷基硫酸钠-聚丙烯酰胺分离胶和浓缩胶,添加6 μL蛋白样品和蛋白marker电泳分离蛋白条带。当电泳完成时,在300 mA恒流中进行转模,在常温下将脱脂牛奶密封2 h,TBST洗膜3次,每次5 min。加入稀释后的一抗ZO-1(1∶1 000)、occludin-1(1∶1 000)、GAPDH(1∶1 000),于4 ℃摇床孵育过夜。TBST溶液洗涤3次,每次5 min,放入HRP标记山羊抗兔二抗(1∶5 000)常温振荡1 h后,再将TBST溶液洗涤3次,每次5 min。最后将ECL发光液均匀滴加到凝胶成像仪上,曝光拍照。利用ImageJ软件实现蛋白的灰度扫描及相对定量分析,每个样品试验重复3次。
1.2.7RT-qPCR检测ZO-1、occludin mRNA表达水平
使用TRIzol提取剂(美国Invitrogen公司)提取细胞并分离总RNA。使用相同数量的RNA和Roche第一链cDNA合成试剂盒(美国Roche公司)进行cDNA合成;采用Bio-Rad CFX96 荧光定量PCR仪,SYBR Green PCR Master Mix进行RT-qPCR检测;管家基因GAPDH归一化mRNA的相对水平。引物序列:ZO-1正向引物为5′-AGC GAA AAC CCG AAA CTG ATG-3′,反向引物为5′-TGA TAC TGA GTT GCC TTC ACC CT-3′;occludin正向引物为5′-ATA ATG GGA GTG AAC CCG ACG-3′,反向引物为5′-CCA CGA TAA TCA TGA ACC CCA-3′;GAPDH正向引物为5′-TCA ACG ACC ACT TTG TCA AGC TCA-3′,反向引物为5′-GCT GGT GGT CCA GGG GTC TTA CT-3′。
1.3 统计学处理
2 结 果
2.1 各组CD4+CD28nullT细胞占比情况
与CTRL组比较,IE-COPD组CD4+CD28nullT细胞占比明显升高(P<0.05);Eos-FE-COPD组、NE-FE-COPD组CD4+CD28nullT细胞占比较IE-COPD组明显升高(P<0.05);NE-FE-COPD组CD4+CD28nullT细胞占比较Eos-FE-COPD组明显升高(P<0.05),见图1。

a:P<0.05,与CTRL组比较;b:P<0.05,与IE-COPD组比较;c:P<0.05,与Eos-FE-COPD组比较。
2.2 各组炎性因子水平比较
与CTRL组、IE-COPD组比较,Eos-FE-COPD组、NE-FE-COPD组IL-1β水平明显升高(P<0.05);NE-FE-COPD组IL-1β水平高于Eos-FE-COPD组(P<0.05)。与CTRL组比较,Eos-FE-COPD组IL-2水平升高,IE-COPD组、Eos-FE-COPD组、NE-FE-COPD组IL-6水平升高,NE-FE-COPD组IL-8水平升高,Eos-FE-COPD组、NE-FE-COPD组TNF-α水平升高,差异有统计学意义(P<0.05),见表2。
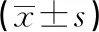
表2 不同表型COPD的炎性因子水平比较
2.3 CD4+CD28nullT细胞占比及炎性因子水平与肺功能、急性加重频率的相关性分析
CD4+CD28nullT细胞占比、IL-1β水平与肺功能呈负相关(P<0.05),与急性加重频率呈正相关(P<0.05);IL-2、IL-6、IL-8、TNF-α水平与肺功能和急性加重频率无相关性(P>0.05),见表3、4。
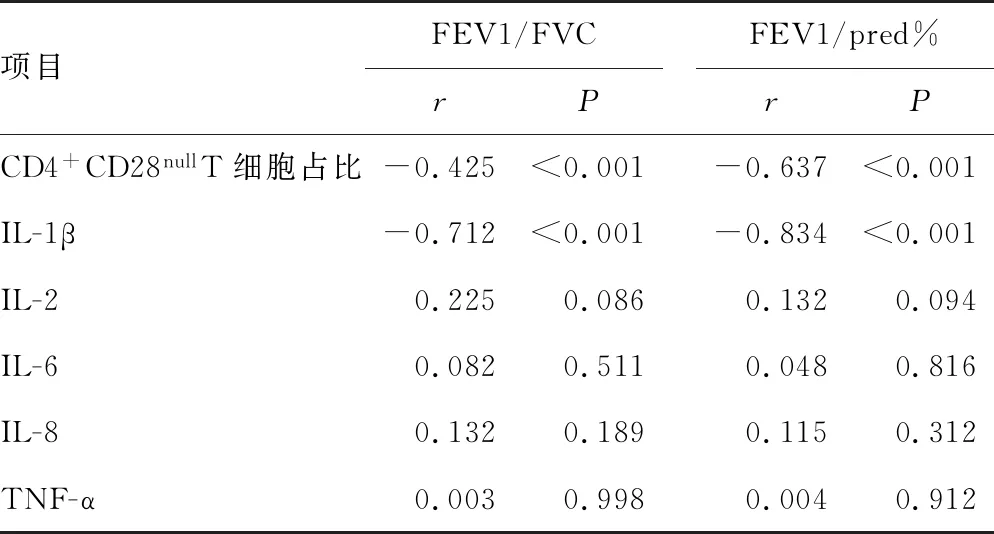
表3 各指标与肺功能的相关性分析
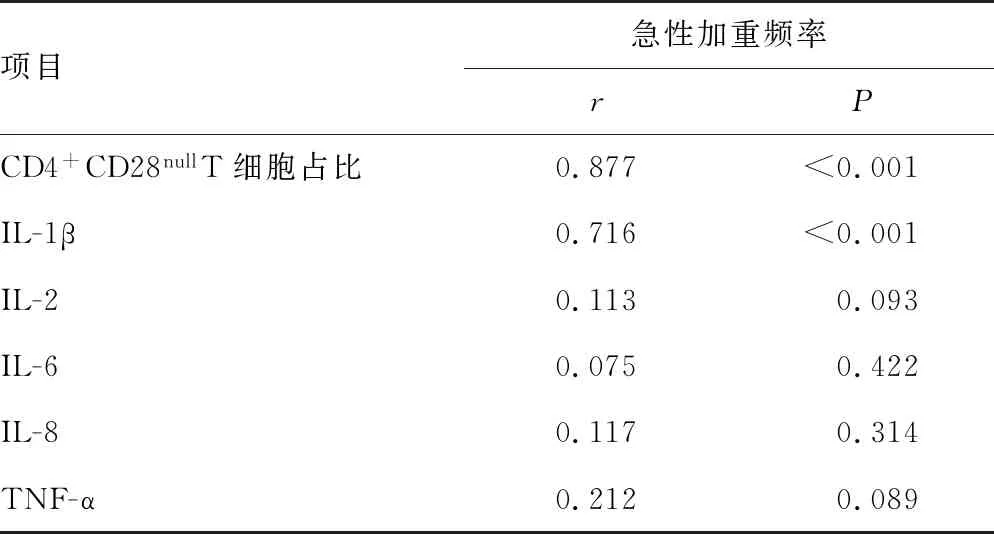
表4 各指标与COPD急性加重频率的相关性分析
2.4 CD4+CD28nullT细胞对hAECs的影响
与Control组比较,co-culture组hAECs紧密连接受损,ZO-1和occludin mRNA及蛋白表达水平降低,差异有统计学意义(P<0.05),见图2。
3 讨 论
COPD是一种异质性疾病[10],最常见的表型有慢性支气管炎、肺气肿、FE及哮喘-COPD重叠综合征等[11]。有研究显示,与IE-COPD比较,FE-COPD患者体重指数、血清蛋白水平偏低,圣乔治呼吸问卷评分偏高,气流受限严重,残气量/肺总通气量比值和肺气肿指数偏高[12],患者生活质量差,社会经济负担重,因此FE在COPD表型中值得特别关注[2]。对于不同表型COPD发病机制的认识不足,是导致目前治疗手段仍匮乏的根本原因。
炎症细胞及炎性因子“交互作用”一直是COPD研究的重点。以往研究发现:NE-FE-COPD患者血清、肺组织、痰及BALF中IL-1α、IL-1β mRNA及蛋白表达水平高于健康人[13-15]。IL-1β水平的升高与FE-COPD患者NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体激活,以及中性粒细胞的活性密切相关[16]。IL-1β水平的高低有助于鉴别COPD表型,IL-1β与COPD急性加重频率、中性粒细胞和C反应蛋白(CRP)呈正相关[17],提示IL-1β可以预测COPD患者的系统炎症水平,与后续的频发急性加重相关。气道分泌物中的中性粒细胞增多和IL-1β水平升高是NE-FE-COPD患者的标志性特征[18]。本研究也发现COPD患者BALF中IL-1β水平升高,且NE-FE-COPD组中IL-1β水平高于Eos-FE-COPD组和IE-COPD组,进一步验证了IL-1β与NE-FE-COPD相关。尽管大量临床及动物研究证实IL-1β在COPD中的重要作用,但目前并未有基于IL-1β的临床治疗方法,但基于IL-1β的药物研发并未停止,最具代表性的临床药物研究是人源单克隆IL-1R抗体MEDI8968在COPD中的Ⅱ期临床试验[19]。该试验组织了324例受试者参与双盲安慰剂对照,研究结果显示:MEDI8968暂不能减少中重度非特异性COPD患者急性加重的频率和改善患者肺功能。但是以上临床试验剔除规模不充分这一因素后进一步分析表明:(1)COPD作为一种异质性疾病,其病理过程异常复杂,有必要按照不同表型分组并制订有针对性的研究方案。MEDI8968能明显降低中性粒细胞、CRP和纤维蛋白原水平,并能帮助改善FE患者的肺功能,主要表现在血常规中性粒细胞增高的患者中,故中性粒细胞基线水平较高者服用IL-1R抗体MEDI8968可使患者受益。MEDI8968初始试验中没有将COPD患者按照血常规中的细胞类型进行分组研究,这可能是IL-1R抗体无效的一个原因。(2)MEDI8968对IL-1β、IL-1α有联合阻断作用,而后者对COPD亦有一定影响,采用以IL-1β或者IL-1α为靶标的特异性拮抗剂进行辅助治疗或许更能理清IL-1β、IL-1α在COPD中的不同作用机制。(3)临床治疗时不能判断MEDI8968是否在肺组织内达到了适宜的血药浓度也会成为限制临床疗效的一个关键因素。因此有必要对IL-1β在不同表型COPD中的作用机制做进一步深入研究,以寻找更适宜的NE-FE-COPD生物学标志物并开发相应的靶向治疗方法,从而达到精准医疗的目的。
本研究发现与CTRL组、IE-COPD组、Eos-FE-COPD组比较,NE-FE-COPD组BALF中CD4+CD28nullT细胞占比较高。同时,将CD4+CD28nullT细胞和hAECs共培养72 h后,hAECs紧密连接受到严重损伤,说明CD4+CD28nullT细胞可能通过引起气道上皮细胞的损伤而参与NE-FE-COPD病理生理过程。CD4+CD28nullT细胞是否通过促进hAECs中IL-1β水平而影响上皮细胞紧密连接尚需要进一步研究。
综上所述,NE-FE-COPD患者BALF中CD4+CD28nullT细胞占比较高,CD4+CD28nullT细胞可能通过促进气道上皮细胞的损伤导致NE-FE-COPD病理进展加快。
