氧化铈/镍-碳纳米管复合氧还原电催化剂的制备与性能研究
2024-03-05王生洋张耀祖王欣茹周伟明孙驰张彩
王生洋,张耀祖,王欣茹,周伟明,孙驰,张彩
(徐州工程学院,江苏徐州 221018)
燃料电池是一种能够将燃料分子的内能直接转变成电能的能源转换装置,因为没有燃烧过程,副产物只有水,且能量转换效率高,环境污染小,是一种清洁的能源技术[1]。然而,燃料电池阴极的氧还原反应动力学缓滞,比阳极氢氧化反应约慢6 个数量级以上,因此需要高效的催化剂降低反应能垒,提高反应速率[2]。贵金属铂基催化剂是氧还原反应最常用的基准催化剂,其催化氧还原反应的超电势接近于零,是目前应用和研究最为广泛的催化剂之一[3]。然而,铂基催化剂价格昂贵,且容易被电解液中的一氧化碳、甲醇等小分子毒化,从而失去活性,并且贵金属地球储量有限且价格昂贵,因此,目前的研究方向主要为开发高性能与低成本的非贵金属材料来代替商业Pt/C,用于氧还原反应,同时降低催化剂的成本,提高催化剂的活性[4]。根据目前的文献报道,有大量的工作对过渡金属/碳基复合材料作为氧还原的催化剂进行研究,并且目前已经取得一定的进步[5-7]。例如,2009年,Wu等[8-11]报道了采用钴、铁和聚苯胺得到的高性能非贵金属催化剂,其催化活性可与商业Pt/C 媲美。此后,过渡金属与碳的复合材料作为氧还原的电催化剂科学家开展了大量的研究工作。目前有不少介绍关于过渡金属与碳的复合材料作为氧还原电催化剂的评述文章[12-14],例如,Gu 等[15]评述了过渡金属-氮-碳催化剂的研究进展,Xia等[5]评述了非铂氧还原催化剂的合成、催化性能与关键因素。
另外,金属载体的相互作用可以抑制金属颗粒的团聚[16]。因此,本文首先将过渡金属镍负载于氧化铈载体上,防止镍颗粒的团聚,得到了氧化铈/镍复合纳米材料,然后通过催化甲烷分解反应得到了碳纳米管骨架网络,从而将氧化铈/镍纳米颗粒分散开来,并且改变了金属镍的电子结构,最后得到了较为优异的氧还原电催化剂。
1 实验部分
1.1 氧化铈/镍的制备
首先将六水合硝酸镍(II)15 mmol、六水合硝酸铈(II)15 mmol 溶解于60 mL 乙醇溶液中,并在溶液中加入40 mmol 的乙酸、4 mL 的Tween 20,24 mmol 的浓硝酸。将混合物于室温下剧烈搅拌2 h,然后在60℃的鼓风干燥箱中陈化48 h。将陈化后形成的凝胶置于管式炉中,500℃下煅烧4 h,得到Ni-Ce粉末样品。
1.2 氧化铈/镍-碳纳米管复合材料的制备
采用固定床反应器进行碳纳米管的催化分解。取50 mg Ni-Ce颗粒,置于反应器石英管中部,在反应器升温之前,先通30 min高纯氩气,排出管内空气。然后在氩气氛下升温至550℃,将氩气换成体积分数为5%甲烷和氩气的混合气,进行催化甲烷分解,反应时间1.5 h。将得到的样品记为Ni-Ce-C。
1.3 催化剂结构表征
采用扫描电子显微镜(SEM,JEOL JSM-6700F)和透射电子显微镜(TEM,JEOL JEM-2100F)对样品的微观形貌分析,采用X 射线衍射仪(XRD,Bruker D8tools,CuKα)对物相结构进行分析,采用X 射线光电子能谱(XPS,ESCALAB-250)对催化剂表面结构进行分析。
1.4 电催化性能表征
电化学测试采用常规三电极体系。工作电极采用美国Pine 的旋转圆盘电极系统,电极内芯为玻碳,内径为5 mm。辅助电极为铂片,参比电极采用饱和甘汞电极。将5 mg样品溶于970 μL乙醇与30 μL的Nafion溶液中,超声波处理30 min,得到均匀的催化剂悬浮液,并将悬浮液滴于电极表面形成膜电极。电解液为氮气或氧气饱和的0.1 M的KOH溶液。
2 结果与讨论
样品Ni-Ce的晶体结构首先用XRD进行分析,如图1(a)下面谱线所示,圆点标记的衍射峰从左至右依次对应 于 氧 化 铈(CeO2)的(111)(200)(220)(311)(222)(400)(331)(420)峰,说明Ni-Ce样品中Ce以CeO2形式存在。另外,在44.3°附近出现了一个金属镍(111)衍射峰,在衍射谱图中也没有出现镍的氧化物的衍射峰,说明镍在Ni-Ce 样品中是以零价金属态的形势存在的。Ni-Ce的形貌用透射电子显微图像进行表征,如图1(b)所示,金属镍和氧化铈在Ni-Ce中以纳米颗粒的形式存在,颗粒尺寸约在10 nm左右。
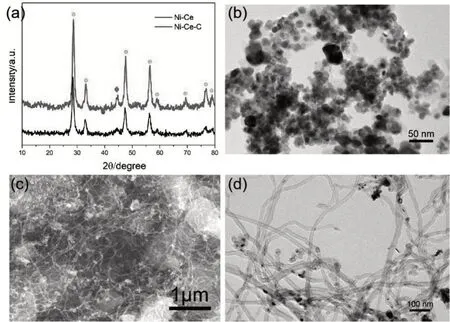
图1 (a)Ni-Ce与Ni-Ce-C的XRD图谱(圆点标记CeO2对应衍射峰,菱形标记金属Ni对应衍射峰);(b)Ni-Ce的投射电子显微图像;(c)Ni-Ce-C的扫描电子显微图像;(d)Ni-Ce-C的投射电子显微图像Fig.1(a)XRD patterns of Ni-Ce and Ni-Ce-C(The circles marked the diffraction peak of CeO2,and the diamond marked the diffraction peak of Ni);(b)TEM image of Ni-Ce;(c)SEM image of Ni-Ce-C;(d)TEM image of Ni-Ce-C
接着,分析甲烷气相反应后的产物Ni-Ce-C。如图1(a)中上面谱线所示,Ni-Ce-C 的衍射峰与Ni-Ce 的衍射峰基本一致,仍然主要是氧化铈和金属镍的衍射峰,另外在26°附近,Ni-Ce-C 的凸起较Ni-Ce更为明显,这是由于甲烷分解后产物碳的影响,只是由于氧化铈和金属镍的衍射峰较强,从而被掩盖了。
图1(b)为Ni-Ce-C 样品的扫描电子显微图像。从图中可以看出,碳在Ni-Ce-C 中以碳纤维状存在,并且这些碳纤维将金属镍和氧化铈纳米颗粒分散开来,起到了支撑纳米颗粒骨架的作用。为进一步确定碳纳米纤维的结构,再进行投射电子显微表征。如图1(d)所示,Ni-Ce-C 中的碳纤维是呈空心的管状,直径约为5~10 nm,也就是Ni-Ce-C中的碳是以碳纳米管状结构存在,并且部分镍颗粒进入碳纳米管内部,起到催化碳纳米管生长的效果。
图2 为Ni-Ce 与Ni-Ce-C 中Ni 2p 的xps 谱图。在Ni-Ce 的谱图中,位于约853 eV(Ni 2p3/2)和约870 eV(Ni 2p1/2)的谱峰对应于零价的金属Ni0,而其他位置的谱峰都对应于二价Ni2+以及它的卫星峰。从图2可以看出,在Ni-Ce-C的Ni 2p3/2的峰分裂,说明零价Ni0与氧化镍的界限变得清晰,主要是镍与氧化铈的分离,使一部分的镍摆脱了氧化铈载体作用的束缚。从XRD谱图中也可以看出,Ni-Ce-C 中金属镍的峰也较Ni-Ce中金属镍的峰更明显。这种镍与载体氧化铈的分离很可能会影响其电化学活性。

图2 Ni-Ce与Ni-Ce-C的XPS Ni 2p 图谱Fig.2 XPS Ni 2p spectra of Ni-Ce and Ni-Ce-C
我们进一步将Ni-Ce 与Ni-Ce-C 作为氧还原反应的催化剂进行了电化学测试,结果如图3 所示。从图3(a)和3(b)中可以看出,两者在氮气饱和的样品中均没有出现还原峰,而在氧气饱和的溶液中都出现了两个明显的氧还原电流峰。这说明两种催化剂催化的氧还原反应均为典型的2+2电子转移过程,只是Ni-Ce-C的氧还原峰更为明显,并且峰电位约在-0.17 V和-0.51 V左右,比Ni-Ce 中的氧还原峰(约在-0.20 V 和-0.53 V)超前。另外从图3(c)和3(d)中的氧还原极化曲线也可以看出,Ni-Ce-C 催化氧还原反应的开启电位要比Ni-Ce超前,另外在每一个转速下的极限电流密度Ni-Ce-C也大于Ni-Ce。这些充分说明Ni-Ce-C 催化氧还原反应的活性较Ni-Ce 有了较大的提高。这很可能是由于碳纳米管网络的形成,起到了支架的作用,将纳米颗粒分散开来,从而有利于其与溶液的接触,进而促进催化活性的提高。另外,部分金属镍电子结构的改变也可能是改善其电催化活性的一个重要因素。

图3 (a)Ni-Ce与(b)Ni-Ce-C分别在氮气饱和与氧气饱和的KOH溶液中的循环伏安曲线;(c)Ni-Ce与(d)Ni-Ce-C分别在不同电极转速下的极化曲线Fig.3 Cyclic voltammetry curves of(a)Ni-Ce and(b)Ni-Ce-C in N2-saturated and O2-saturated KOH solution;Polarization curves of(c)Ni-Ce and(d)Ni-Ce-C at different electrode rotating speed
3 结论
本文通过溶胶凝胶法和气相催化甲烷分解反应成功制备了氧化铈/镍-碳纳米管复合材料。氧化铈/镍纳米颗粒的尺寸约为10 nm,碳纳米管的直径约为5~10 nm。另外,与Ni-Ce 相比较,Ni-Ce-C 的XPS Ni 2p3/2的峰分裂明显,说明其电子结构发生了变化。电化学实验结果表明,在碳纳米管形成后,Ni-Ce-C 的氧还原催化活性有了明显的提高,其循环伏安的峰电位约在-0.17 V和-0.51 V左右,极化曲线的开启电位约在-0.05 V(vs.SCE)左右。碳纳米管的支架作用有利于催化剂与溶液的接触,以及金属镍电子结构的改变都可能对Ni-Ce-C电催化氧还原活性的改善起到促进作用。这为今后通过自催化得到的过渡金属/碳纳米管复合催化剂在氧还原反应中的应用奠定了研究基础。
