Ni-Ti-LDHs的合成、表征及其对乙硫醇的吸附性能
2024-03-05韩家林朱继超赵辉建赵士翔赵晓彤胡丽芳
韩家林,朱继超,赵辉建,赵士翔,赵晓彤,孙 慧,胡丽芳
(安徽理工大学 化学工程学院,安徽淮南 232001)
天然气是一种清洁低碳、经济实惠的化石能源,是实现能源低碳转型的现实选择。然而天然气中含有硫化物如乙硫醇等,燃烧会产生含硫废气,如何处理污染废气成为了重点研究的课题。乙硫醇类物质大多来自于天然气炼制、石化等生产行业中。当乙硫醇在空气中的质量浓度高于0.7 μg/mL 时,人体就会产生剧烈不适感。当人体大量吸入乙硫醇时,会产生呼吸困难、腹泻、下咽部不适等症状。由于乙硫醇有上述危害,其在天然气中的脱除与防治已成为当务之急[1]。现有的乙硫醇脱除技术主要有活性炭改性、分子筛脱除等。
层状双金属氢氧化物(LDH)是一种具有层状结构的物质,在吸附、环保等领域具有广泛应用[2]。本文主要通过合成Ni-Ti-LDH,对其进行分析与表征,并通过实验研究了Ni-Ti-LDH类水滑石对乙硫醇的吸附性能。
1 实验部分
1.1 试剂与材料
钛酸四正丁酯、三乙醇胺、硝酸镍、氢氧化钠、无水乙醇,均为分析纯,国药集团化学试剂有限公司;去离子水,实验室自制;氮气,纯度99.9%,安徽淮化气体厂。
1.2 样品的制备方法
将15 mL 无水乙醇加入含有2.780 g 钛酸正丁酯(Ti(OC4H9)4)的三口烧瓶中于60℃下充分混合;60℃恒温下向三口烧瓶中加入7.230 g 三乙醇胺(N(C2H4OH)3),继续搅拌直至混合均匀;待混合均匀后继续加入11.866 g硝酸镍(Ni(NO3)2·6H2O)和100 mL去离子水,配成混合水溶液;向溶液中缓慢滴加0.25 M 的NaOH 溶液,直到溶液pH 值在8~9 之间;在氮气保护下,升温至100℃,冷凝回流48 h。将所得的绿色溶液抽滤、洗涤至溶液呈中性后,于80℃干燥24 h,得到绿色粉末Ni-Ti-LDHs。
1.3 样品表征方法
使用X 射线衍射仪表征样品晶形结构,测试条件:Cu 靶,Kα 射线,波长0.154 06 nm,Ni 滤波片,管压36 kV,管流30 mA。使用扫描电子显微镜表征样品的表面形貌。使用傅立叶变换红外光谱仪表征样品结构特征,测试条件:KBr压片,分辨率:4 cm-1,扫描范围:4 000~400 cm-1。使用微机差热天平分析样品的热稳定性,测试条件:扫描速度:10℃/min,N2气氛。
1.4 吸附性能实验
通过脱除甲烷气体中的乙硫醇来评价吸附剂的脱硫性能。采用固定床吸附装置进行吸附实验,石英管反应器内径4 mm,填充样品后床层高度6 mm,样品用量为Ni-Ti-LDH 0.12 g。采用气相色谱仪和火焰光度检测器(FPD)对出口气体组分进行检测,记录吸附乙硫醇后的穿透吸附曲线。
吸附前,样品在120℃下以60 mL·min-1的氮气流量预处理1 h,对于吸附过程,含500 mL·m-3乙硫醇的甲烷气体流量为15 mL·min-1(空速为12 000 h-1),在25℃下进行吸附,当出口气体中能检测到乙硫醇时,认为吸附剂床层被穿透,对应的吸附容量为穿透吸附硫容。
2 结果与分析
2.1 XRD
Ni-Ti-LDHs 的XRD 图谱如图1 所示,图1 显示出水滑石三个特征衍射峰,表明合成的多晶体结构比较完好。由于反应发生的温度较低,导致样品的结晶度也较低,图中的曲线在约15℃和25°时的特征衍射峰不明显,但产品仍显示出完整的层状结构。图谱中的衍射峰在8.42°处,由布拉格公式得到产品的层间距为1.05 nm,表明产品是Ni-Ti-LDHs。经计算Ni-Ti-LDHs 的理论层间距为0.83 nm[3-4],这个值比实际值要低,这与三乙醇胺的中心氮原子的强电负性有关。
2.2 SEM
通过扫描电子显微镜(SEM)可以观察到Ni-Ti-LDHs 的SEM 图片(图2),在SEM 图片中,可以清晰地看到,这种材料的结构是由多层相互叠加堆积形成的层状结构,制备的纳米材料具有均匀的尺寸,与XRD 结果分析的结构一致。这种层状结构是通过多层相互叠加堆积形成的,这一结构也可以有效提升材料的热稳定性和化学稳定性。

图2 Ni-Ti-LDHs的SEM图Fig.2 SEM diagram of Ni-Ti-LDHs
2.3 FT-IR
通过傅里叶变换红外光谱仪(FT-IR)检测Ni-Ti-LDHs 的骨架特征,结果示于图3。3 420 cm-1处为Ni-Ti-LDHs的层板羟基和层间水的伸缩振动峰,而1 640 cm-1是对应的层间水分子和层板羟基缔合弯曲振动峰[5],这表明该样品中含有较多的水分子和羟基。2 970 cm-1是亚甲基中C-H键对应的对称伸缩振动峰[6];1 380 cm-1为硝酸根对应的伸缩振动峰[7],607 cm-1和436 cm-1分别为Ti-OH 键、Ni-OH 键的伸缩振动峰[8],1 210 cm-1、1 050 cm-1和881 cm-1分别对应于C-N的对称伸缩振动峰,C-O 的伸缩振动峰和-OH 的面外弯曲振动峰[9-11],由此可见样品中残留有三乙醇胺,结论与XRD图谱一致。1 330 cm-1、1 105 cm-1和930 cm-1分别为C-N 的对称伸缩振动峰,C-O 的伸缩振动峰和-OH的面外弯曲振动峰,表明了三乙醇胺的存在,由此可以证实,该层板与三乙醇胺的结合并非由物理吸附作用导致,而是由于三乙醇胺的中心氮原子电负性相对较强,导致其与带正电的层板相结合造成的,这与之前的XDR 图谱结构分析结果相吻合;同样的,612 cm-1和540 cm-1分别为Ti-OH,Ni-OH的伸缩振动峰。

图3 Ni-Ti-LDHs的红外图谱Fig.3 Infrared spectrum of Ni-Ti-LDHs
2.4 TG-DTA
对样品进行热重-差热分析(TG-DTA),结果如图4 所示,样品的重量损失分两个阶段发生。在第一阶段,在200℃以下(第一个*位置处)发生了明显的重量损失,即水分从样品通过物理吸附表面去除;在200℃,物理吸附的除湿几乎完成,下一个阶段开始。在第二阶段,显著的失重发生在200℃~440℃(第二个*位置处),样品经历了层间结合水的去除、层板上羟基的缩合以及无法洗掉的三乙醇胺的去除。在440℃之后,曲线基本稳定,样品没有失重,表明层压板上羟基的缩合和层间水分子的去除几乎已经完成,只剩下少量过剩的三乙醇胺。在焙烧条件下,所有的双金属氢氧化物都已转化为氧化物。图中的DTA 线显示,样品分别在95℃和325℃表现出明显的热吸收逆转峰。
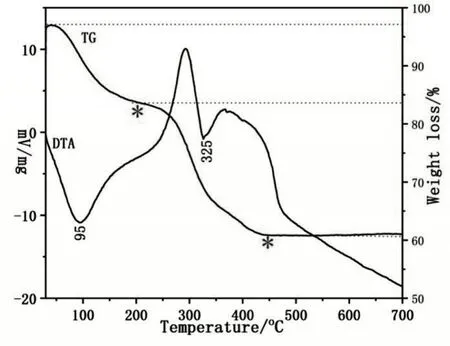
图4 Ni-Ti-LDHs的TG-DTA图谱Fig.4 TG-DTA diagram of Ni-Ti-LDHs
2.5 吸附性能
Ni-Ti-LDH 对乙硫醇有较好的吸附能力,如图5所示,当质量为0.12 g,空速为12 000 h-1时,Ni-Ti-LDH的乙硫醇吸附穿透时间为114 min,其穿透吸附量为19.74 mg/g。

图5 Ni-Ti-LDHs吸附乙硫醇的穿透曲线Fig.5 Adsorption penetration curve of Ni-Ti-LDHs for ethyl mercaptan
3 结论
本实验采用共沉淀法成功合成了层间阴离子为硝酸根的Ni-Ti-LDHs,并对样品进行了XRD、SEM、FTIR、TG-DTA 测试与表征,随即进行了甲烷气体中乙硫醇吸附脱除实验,结果表明,合成的Ni-Ti-LDHs对乙硫醇有较好的吸附能力。
