犬源抗氧化益生菌的筛选及功效评定
2024-03-05余泽旭章思奕任大喜师福山
陈 楠 余泽旭 季 暄 章思奕 任大喜 师福山
(浙江大学动物科学学院,杭州 310058)
宠物在人们的生活中扮演着越来越重要的角色。根据美国Packaged Facts的分析,2012年到2022年,美国养宠家庭中,拥有1只老年犬(年龄在7岁及以上)的养狗家庭占比从41.60%上升到了53.50%[1]。随着宠物医疗的发展,宠物犬的寿命将会更长,宠物衰老相关产业一定会是宠物行业的发展趋势之一。衰老是生物体生命进程中必须经历的环节,它表现为随着年龄的增长,机体的细胞、组织和器官等功能逐渐下降,大脑认知和记忆功能下降[2]。衰老过程中,许多慢性疾病也会随之而来,例如产科疾病、肝肾疾病、心脏疾病等[3],不仅给宠物犬带来生理上的痛苦,也给宠物犬主人带来情感上的折磨与经济上的压力。因此,为了预防衰老相关疾病,维持宠物犬的健康衰老,找到有效的抗衰老干预措施是十分必要的[4]。
氧化衰老是衰老的一个重要机制,是指由氧化应激引起的细胞衰老。生物体内,活性氧簇(ROS)的产生和内源抗氧化剂对ROS的清除是动态平衡的。但当机体中的ROS增多,内源抗氧化剂不足以清除时,ROS积累就会导致氧化应激。若氧化应激持续存在,会引发DNA损伤、蛋白质错误折叠、线粒体突变和细胞损伤,最终导致细胞衰老[5]。此时就需要添加外源性抗氧化剂来帮助机体清除ROS,抵御氧化损伤。Han等[6]、Paulino等[7]研究发现益生菌在体内外具有良好的抗氧化功能,有作为外源性抗氧化剂抵抗氧化衰老的潜能。
目前犬用益生菌制剂在迅速发展,但主要集中在细菌性腹泻治疗[8-9]、炎症性肠病(IBD)治疗[10]、急性肠病治疗[11]、提高生长性能[12]等方面,且这些益生菌多来源于人、猪、羊,犬来源的较少,用犬源益生菌进行犬抗氧化的研究更是鲜见,相关的益生菌仅在国外的少数公司有开发利用。因此,开发我国自主知识产权的宠物抗氧化益生菌对提升我国宠物的营养与健康等具有重要意义。
鉴于此,本试验拟筛选出1株或几株犬源抗氧化益生菌,通过体外抗氧化试验评定其抗氧化功效,以期可为犬抗氧化益生菌产品的开发提供储备菌株。
1 材料与方法
1.1 样品来源
健康犬粪便采自浙江大学教学动物医院,样品采集选用肛拭子的方式,具体操作如下:在无菌1.5 mL EP管中提前加入1 mL无菌生理盐水,无菌棉签用生理盐水湿润后取肛拭子,然后把棉签插入EP管浸泡在生理盐水中,剪去木制部分。
1.2 抑菌指示菌株
大肠杆菌O157∶H7(EscherichiacoliO157∶H7)ATCC25922和鼠伤寒沙门氏菌(Salmonellatyphimurium)ATCC13311购于美国典型培养物保藏中心,单核细胞增生李斯特氏菌(Listeriamonocytogenes)CMCC54007和金黄色葡萄球菌(Staphylococcusaureus)CMCC26003购于中国医学细菌保藏管理中心。
1.3 主要试验试剂
MRS肉汤(货号:M8540-250 g),北京索莱宝科技有限公司;LB肉汤(货号:M0230),杭州微生物试剂有限公司;牛胆盐(货号:B875069-5 g),上海麦克林生化科技股份有限公司;人工胃液(USP,无菌;货号:R22155),上海源叶生物科技有限公司。
1.4 主要仪器设备
FiveGoTMpH计,上海雷磁仪器厂;TGL-16M低温高速离心机,上海卢湘仪离心机仪器有限公司;DPX-9002B-1恒温恒湿培养箱,上海福玛试验设备有限公司;SW-CJ-2F超净工作台,苏州净化设备有限公司。
1.5 菌株的分离纯化
取100 μL 1.1中浸泡肛拭子的生理盐水,不进行稀释,涂布于MRS平板,37 ℃培养48 h后挑取形态大小明显不同的单菌落于新MRS平板上划线培养,连续划线培养3代得到纯化菌株。
1.6 细菌16S rDNA分子生物学鉴定
将培养好的菌液送至华大基因进行16S rDNA测序,测序结果在NCBI中进行同源性比对。
1.7 体外抗氧化试验
1.7.1 样品制备
待测菌株在MRS固体培养基上划线分离,37 ℃培养48 h。用接种环挑取单菌落接种于灭菌MRS液体培养基中,37 ℃静置培养24 h,得到培养液。1)发酵上清液的制备:将培养液用蒸馏水调整至菌体浓度为109CFU/mL,4 ℃、8 000 r/min离心15 min,收集上清液即为发酵上清液。2)菌悬液(IC)的制备:用0.02 mol/L磷酸盐缓冲液(PBS,pH=7.4)将离心后的菌体沉淀重悬洗涤,4 ℃、8 000 r/min离心15 min,重复3次。将洗涤干净的菌体重悬于PBS中,并调整菌体浓度为109CFU/mL,即得到菌悬液。3)无菌体破碎物(CFE)的制备:取上述菌悬液进行超声破碎(在冰上进行),破碎后离心取上清,即得到无菌体破碎物。超声破碎参数为:变幅杆Ф6、超声开1 s关2 s、功率200 W;15 min。
1.7.2 2,2-二苯基-1-苦基肼(DPPH)自由基清除试验
参照Pourramezan等[13]的方法,测定犬源益生菌3种样品液(菌悬液、无菌体破碎物、发酵上清液)的DPPH自由基清除能力。将1 mL样品液与1 mL 0.20 mmol/L的DPPH无水乙醇溶液,振荡混合1 min后,在室温下避光反应30 min,离心取上清液于517 nm处测吸光度,以95%乙醇代替DPPH做对照,PBS代替样品液做空白(样品液为发酵上清液时,用MRS液体培养基代替样品液做空白)。
DPPH自由基清除率(%)=[1-(Ai-Aj)/Ac]×100。
式中:Ai为样品液+DPPH吸光度;Aj为样品液+95%乙醇吸光度;Ac为PBS或MRS+DPPH吸光度。
1.7.3 羟自由基清除试验
羟自由基清除率(%)=[(As-Ap)/
(Ab-Ap)]×100。
1.7.4 还原能力试验
参照Chen等[15]的方法,测定犬源益生菌3种样品液(菌悬液、无菌体破碎物、发酵上清液)的还原能力。将0.5 mL样品液、0.5 mL铁氰化钾(质量分数为1%)和0.5 mL PBS(pH=6.6)混合后50 ℃水浴20 min,反应后冷却并加入0.5 mL三氯乙酸(TAC,质量分数为10%)沉淀蛋白,离心后取1 mL上清液与1 mL三氯化铁(FeCl3,质量分数为0.1%)反应5 min,于700 nm处测吸光度为As;用PBS代替样品液做空白对照(样品液为发酵上清液时,用MRS液体培养基代替样品液做空白对照),测吸光度为Ab。
还原能力(%)=[(As-Ab)/Ab]×100。
1.8 益生特性试验
1.8.1 生长曲线
将待测菌株连续活化3代液体扩增培养后,离心,弃上清。用无菌PBS重悬菌体,并调整菌体浓度至600 nm处吸光度为0.55。按1∶9的比例将菌液接种到无菌液体MRS培养基中,37 ℃静置培养,每2 h测1次发酵混合物的600 nm处的吸光度。以未接种菌液的无菌液体MRS培养基作为对照。
1.8.2 胆盐耐受性
将待测菌株连续活化3代液体扩增培养后,按1∶9的比例将菌液接种到牛胆盐质量浓度为0.20%的PBS中,混匀后于37 ℃培养箱中培养,分别在培养0和4 h时取菌液进行平板计数。菌株的胆盐耐受性计算公式为:
胆盐耐受性(%)=(N4/N0)×100。
式中:N4为4 h时活菌数(CFU/mL);N0为0 h时活菌数(CFU/mL)。
1.8.3 酸耐受性
将待测菌株连续活化3代液体扩增培养后,按1∶9的比例将菌液接种到pH=2的PBS中,混匀后于37 ℃培养箱中培养,分别在0和4 h时取菌液进行平板计数。菌株的酸耐受性计算公式为:
酸耐受性(%)=(N4/N0)×100。
式中:N4为4 h时活菌数(CFU/mL);N0为0 h时活菌数(CFU/mL)。
1.8.4 人工胃液耐受性
将待测菌株连续活化3代液体扩增培养后,按1∶9的比例将菌液接种到人工胃液中,混匀后于37 ℃培养箱中培养,分别在0和3 h时取菌液进行平板计数。菌株的人工胃液耐受性计算公式为:
人工胃液耐受性(%)=(N3/N0)×100。
式中:N3为3 h时活菌数(CFU/mL);N0为0 h时活菌数(CFU/mL)。
1.8.5 抑菌特性
采用牛津杯法对待测菌株发酵上清液的抑菌特性进行测定。将4株抑菌指示菌株浓度调整至109CFU/mL后,分别按1%的接种量接种到LB固体培养基(55 ℃)中,混匀后,倒入事先放好无菌牛津杯[直径为(8.00±0.01) mm]的培养皿中。待培养基凝固后,将牛津杯拔出,每孔中加入200 μL的待测菌株发酵上清液,37 ℃培养36 h后用游标卡尺测量抑菌圈直径(包含牛津杯直径)。
1.8.6 抗生素敏感性
采用纸片扩散法对待测菌株的抗生素敏感性进行测定。将100 μL待测菌株的菌悬液(菌体浓度调整至109CFU/mL)涂布于MRS固体培养基上,并用无菌镊子将药敏纸片置于培养基表面,轻压药敏片使其贴牢,37 ℃培养36 h后测量药敏片的抑菌圈直径。
1.9 数据统计与分析
每个试验均设置3次重复,试验数据均以平均值±标准差形式表示。试验数据由SPSS 23.0分析软件进行单因素方差分析和LSD多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 菌株的分离
本试验从浙江省杭州市浙江大学教学动物医院13只健康犬只中采集到13份肛拭子样本,犬只信息见表1。从这13份肛拭子样本中共分离出19株菌,这些菌株的菌落在MRS平板上普遍呈乳白色或为黄色,菌落表面光滑,革兰氏染色为阳性,多为杆菌和球菌。分离菌株ZJUIDS-D016和ZJUIDS-D034的菌落形态图及革兰氏染色图见图1。
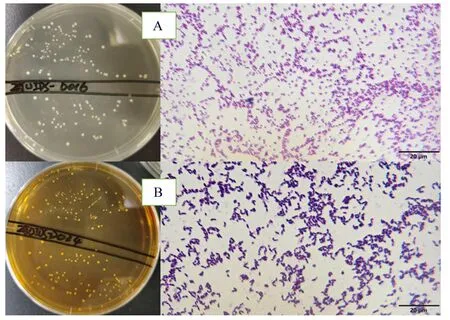
图1 分离菌株ZJUIDS-D016(A)和ZJUIDS-D034(B)的菌落形态图及革兰氏染色图

表1 提供肛拭子的犬只信息
2.2 体外抗氧化试验结果
2.2.1 菌株DPPH自由基清除率
对19株分离菌株的发酵上清液、菌悬液以及无菌体破碎物进行了体外抗氧化试验。如表2所示,19株分离菌株的发酵上清液、菌悬液、无菌体破碎物均有一定的DPPH自由基清除能力,其中发酵上清液的DPPH自由基清除率在(24.01±3.79)%~(117.98±3.16)%,菌悬液的DPPH自由基清除率在(1.15±1.10)%~(56.65±6.07)%,无菌体破碎物的DPPH自由基清除率在(4.92±2.74)%~(32.35±5.28)%。

表2 犬源益生菌DPPH自由基清除率
2.2.2 菌株羟自由基清除率
如表3所示,19株分离菌株中有3株菌株不具备羟自由基清除能力;有12株菌株的发酵上清液能够清除羟自由基,羟自由基清除率在(4.41±0.52)%~(32.32±12.99)%;有9株菌株的菌悬液能够清除羟自由基,羟自由基清除率在(0.79±0.34)%~(38.94±2.02)%;有9株菌株的无菌体破碎物能够清除羟自由基,羟自由基清除率在(4.75±1.76)%~(34.27±4.78)%。
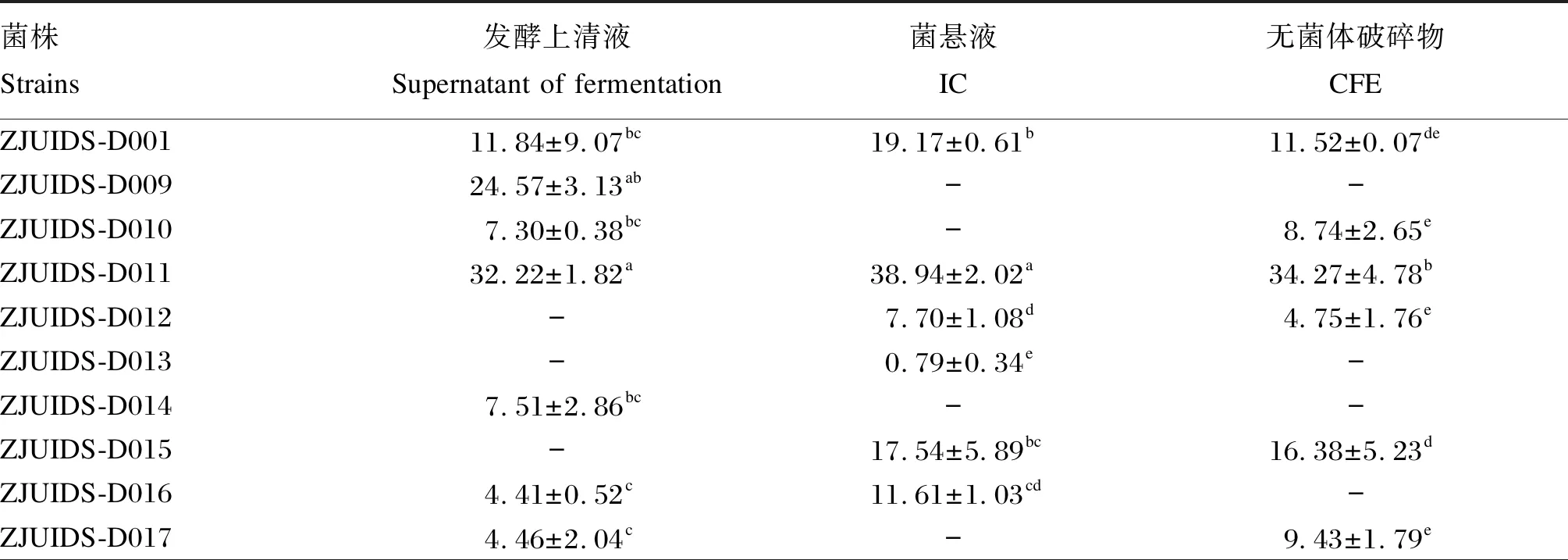
表3 犬源益生菌羟自由基清除率
2.2.3 菌株还原能力
如表4所示,19株分离菌株的菌悬液均具有还原能力,还原能力在(3.90±0.83)%~(173.77±1.31)%;16株菌株的无菌体破碎物具有还原能力,还原能力在(1.92±0.65)%~(151.30±12.79)%;仅7株菌株的发酵上清液具备还原能力,还原能力在(1.18±0.19)%~(315.13±24.99)%。

表4 犬源益生菌还原能力
综合DPPH自由基清除率、羟自由基清除率和还原能力3项体外抗氧化能力指标的测定结果,菌株ZJUIDS-D016、ZJUIDS-D034的抗氧化能力较为突出,这2株菌株发酵上清液的DPPH自由基清除率分别为86.21%、89.47%,发酵上清液的羟自由基清除率分别为4.41%、32.32%,菌悬液的还原能力分别为109.30%、36.54%,故选取这2株菌进行后续的研究。
2.3 菌株鉴定结果
将上述选定的菌株ZJUIDS-D016、ZJUIDS-D034的16S测序结果上传到Blast进行比对,并利用MEGA中的N-J算法Bootstrap 500次构建进化树。由图2可知,菌株ZJUIDS-D016与粪肠球菌(Enterococcusfaecalis)ATCC19433的同源性为100%,菌株ZJUIDS-D034与融合魏斯氏菌(Weissellaconfusa)JCM1093的同源性为100%,故这2株菌分别为粪肠球菌和融合魏斯氏菌,将其分别命名为粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034。
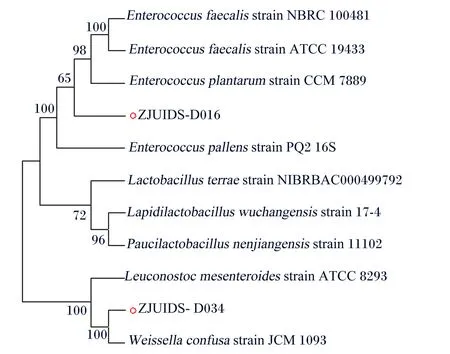
Enterococcus faecalis:粪肠球菌;Enterococcu pallens:淡黄肠球菌;Weissella confusa:融合魏斯氏菌。
2.4 生长曲线
由图3可知,融合魏斯氏菌ZJUIDS-D034生长较快,2~6 h为其对数生长期,8 h后进入平台期,之后生长缓慢;粪肠球菌ZJUIDS-D016生长较慢,2~10 h为其对数生长期,14 h后进入平台期,之后生长缓慢。

图3 菌株ZJUIDS-D016和ZJUIDS-D034的生长曲线
2.5 胆盐耐受性、酸耐受性和人工胃液耐受性
根据表5可以看出,菌株ZJUIDS-D016和ZJUIDS-D034在0.20%牛胆盐条件下培养4 h的存活率分别为86.36%、69.63%,在pH=2条件下培养4 h的存活率分别为 96.95%、92.42%;在人工胃液中培养3 h的存活率分别为55.78%、57.80%。

表5 菌株ZJUIDS-D016和ZJUIDS-D034的胆盐耐受性、酸耐受性和人工胃液耐受性
2.6 抑菌特性
图4为菌株ZJUIDS-D016、ZJUIDS-D034对大肠杆菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、鼠伤寒沙门氏菌的抑菌效果图。根据表6可以看出,菌株ZJUIDS-D016和ZJUIDS-D034对4种肠道常见致病菌均有较好的抑制作用。

(1)、(2)、(3)、(4)分别为菌株ZJUIDS-D016、ZJUIDS-D034对大肠杆菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、鼠伤寒沙门氏菌的抑菌效果图,其中A为ZJUIDS-D016作用孔,B为ZJUIDS-D034作用孔,C为MRS空白对照孔。

表6 菌株ZJUIDS-D016和ZJUIDS-D034对4种肠道常见致病菌的抑菌圈直径
2.7 抗生素敏感性
抗生素敏感性试验结果依据临床和实验室标准协会(CLSI)标准进行判定,判定标准如表7所示。
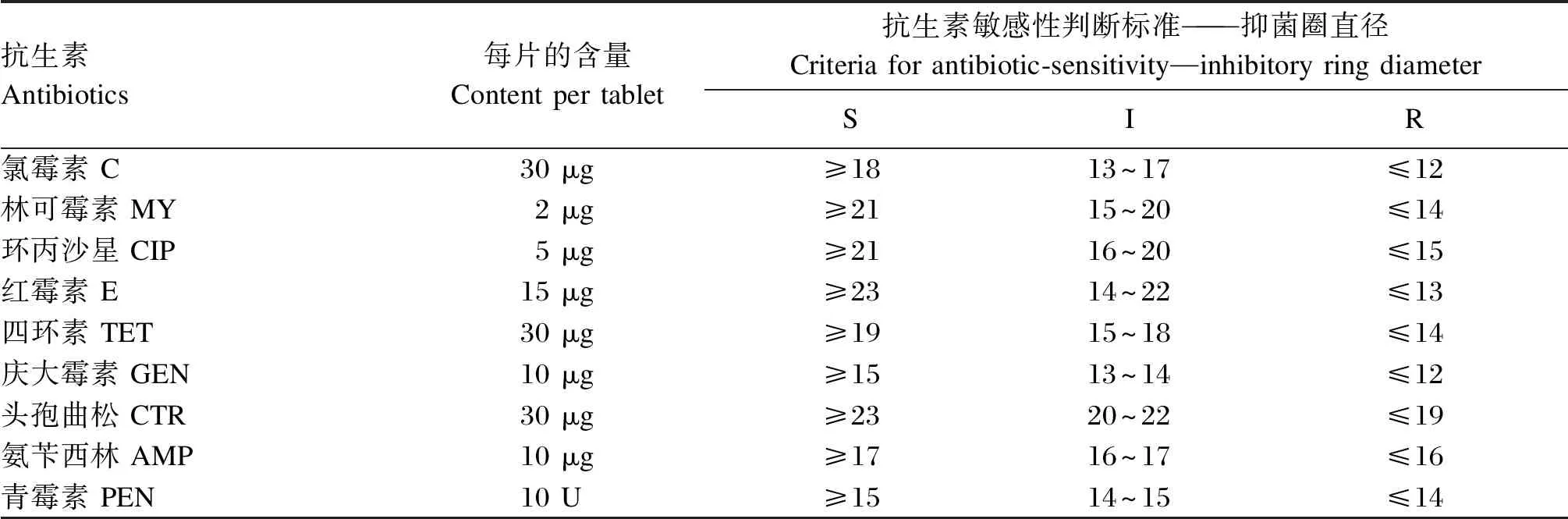
表7 不同抗生素敏感性判定标准
表8为菌株ZJUIDS-D016和ZJUIDS-D034的抗生素敏感性试验结果,可以看出菌株ZJUIDS-D016、ZJUIDS-D034均对5种抗生素(氯霉素、红霉素、四环素、氨苄西林、青霉素)无耐药性。

表8 ZJUIDS-D016和ZJUIDS-D034的抗生素敏感性抑菌圈直径
3 讨 论
益生菌是指适当摄入能对机体产生有益影响的活的微生物[16]。益生菌的益生特性必须符合宿主肠道菌群的特点[17]。Kumar等[18]的研究发现,在益生菌对犬的有益影响上,犬源益生菌优于乳制品来源的益生菌。所以本研究选择从犬粪便中筛选益生菌,以期在犬上更好的发挥菌株的益生功效。
ROS产生与消除的长期不平衡会导致机体氧化应激[5]。有研究表明益生菌能提高机体的抗氧化能力,例如,益生菌可以使痴呆患者的总抗氧化水平提高的同时降低丙二醛(MDA)含量[19];活益生菌和死益生菌都具有抗氧化能力,可用于对抗不同疾病[20]。也有研究发现益生菌对老年犬的益处更为明显[21],说明益生菌具有抗衰老的潜力。对DPPH自由基、羟自由基的清除能力、还原能力都是评判益生菌抗氧化能力的常用指标[22]。本研究通过测定这3个指标筛选出具有抗氧化衰老潜力的菌株,再对潜力菌株的胆盐耐受性、酸耐受性、人工胃液耐受性、抑菌特性、抗生素敏感性等益生特性进行测定,最后筛选出2株具有较好体外抗氧化活性和益生特性的菌株,这2株菌株分别为粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034。
粪肠球菌是应用的较多的乳酸菌,在畜牧方面得到了广泛的应用[23]。有研究显示,饲粮中添加5×108CFU/kg的粪肠球菌可以显著提高肉仔鸡的总抗氧化能力[24]。魏斯氏菌是一种新兴的乳酸菌,虽然还未被列入饲料添加剂目录,但已有研究表明其具备益生潜力,包括肠道定植能力,耐受低pH、高胆盐能力,降低胆固醇和甘油三酯含量能力以及高产胞外多糖等[25]。益生菌安全性评价的一个重要指标是毒力基因的携带情况。Quattrini等[26]对27株食窦魏斯氏菌和7株融合魏斯氏菌的基因组进行了比较基因组分析,发现在魏斯氏菌的基因组中存在一些假定的毒力基因,但这些毒力基因也存在于其他乳酸菌中,欧洲食品安全局(EFSA)认为这些菌株是安全的。上述结果说明魏斯氏菌的使用具有一定的安全性。
本研究中,粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034发酵上清液的DPPH自由基清除率分别为86.21%、89.47%,与王佳慧等[4]的研究一致,其从人肠道中筛选出的乳酸菌DPPH自由基清除率在17.12%~86.53%。一般认为DPPH自由基清除率超过30%的益生菌即具有高抗氧化活性[27],本试验分离的2株犬源益生菌的DPPH自由基清除率均高于30%,说明均具有高抗氧化活性。粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034菌悬液的还原能力分别为109.3%、36.54%。黄玉军等[28]从人肠道中筛出的乳酸菌菌悬液的还原能力为1.36%~1.60%,本研究结果与此差距较大,这可能与菌株的来源有关。黄煜等[29]从腌制菜中筛选出的乳酸菌菌悬液还原能力为10.00%~23.30%;而吴石金等[30]从发酵食品中筛选出的乳酸菌菌悬液还原能力为76.00%~114.00%。粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034发酵上清液的羟自由基清除率分别为4.41%、32.32%,略低于黄玉军等[28]从人肠道中筛出的乳酸菌发酵上清液的羟自由基清除率52.75%~64.80%,这可能与菌株的发酵条件有关。Zhao等[31]研究表明,乳酸菌产生的胞外多糖如葡聚糖,具有良好的自由基清除活性,5 mg/mL葡聚糖的DPPH自由基清除率为45.2%,4 mg/mL葡聚糖的羟自由基清除率为86.5%。而胞外多糖的产生多少与发酵条件有关[32],后续试验可以对2株菌的最佳发酵条件进行探讨研究,以发挥其最大的抗氧化功效。
粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034在pH=2条件下培养4 h时的存活率分别为96.95%、92.42%;在0.20%牛胆盐条件下培养4 h时的存活率分别为86.36%、69.63%。上述结果优于魏雪[9]筛到的犬粪源乳酸菌,其得到的4株犬粪源乳酸菌在pH=2条件下培养2 h时存活率在80%以上,本试验的2株菌在同等条件下培养4 h时仍有90%以上的存活率;其得到的4株犬粪源乳酸菌在0.10%胆盐条件下培养2 h存活率在70%以上,本试验的2株菌在0.20%胆盐条件下培养4 h仍有70%的存活率,说明这2株菌具有较好的抗逆性。粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034在人工胃液中培养3 h时的存活率分别为55.78%、57.80%,略低于张家宝等[33]筛到的鸡源乳杆菌,其所分离的鸡源乳杆菌在人工胃液中培养3 h时的存活率为65.92%。有研究表明益生菌发挥益生功能的机制之一就是抑制肠道病原菌[34]。粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034的发酵上清液对4种常见的肠道致病菌(大肠杆菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、鼠伤寒沙门氏菌)均有抑菌作用,可以看出这2株菌除了抗氧化潜力外,还具有一定抗细菌性肠道疾病的潜力,例如由大肠杆菌引起的腹泻等;同时这2株菌对5种抗生素(氯霉素、红霉素、四环素、氨苄西林、青霉素)无耐药性,对宠物犬健康较为安全。
4 结 论
本试验筛选到的2株犬源益生菌——粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034,这2株菌来自犬粪便,具备高抗氧化活性;同时,这2株菌具备较高的胆盐耐受性和酸耐受性,抗逆能力较强;对常见的肠道病原菌有抑制作用,符合常见益生菌的特性;对多种抗生素敏感。上述结果表明犬源粪肠球菌ZJUIDS-D016和融合魏斯氏菌ZJUIDS-D034可以作为开发犬抗氧化益生菌产品的储备菌株。
