夏威夷果青皮发酵菌株的筛选及其对发酵后饲用价值的改善作用
2024-03-05黄海波王永亮李步豪张成功唐雄卓谭碧娥印遇龙
黄海波 王永亮 李步豪 张成功 唐雄卓,2 谭碧娥,2 印遇龙,2,3 张 琛,2* 蒋 谦,2*
(1.湖南农业大学动物科学技术学院,动物营养基因组与种质创新研究中心,长沙 410128;2.云南循环农业产业研究院,普洱 665000;3.中国科学院亚热带农业生态研究所,长沙 410125)
夏威夷果即澳洲坚果,属山龙眼科澳洲坚果属[1],是南亚热带常绿乔木的果实。因其果仁营养丰富、口感香脆,深受消费者青睐,具有较高的经济价值,在我国西南地区广泛种植。根据农业农村部农垦局的统计,到2020年,我国夏威夷果种植面积达到266 133 hm2,占全球种植面积的60.9%,单位面积产量为1 185.00 kg/hm2[2]。夏威夷果青皮(macadamia green peel,MGP)是果壳外部的绿色表皮,是夏威夷果加工过程中的农业副产物,占鲜果重量的1/2,结合夏威夷果种植面积与产量推算,MGP的年产量可达15.8万t,作为农业垃圾的MGP产量巨大。
研究表明,MGP中含有(18.36±0.32) mg/g的酚类物质和4.70~9.96 mg/g的黄酮[3-4],以及熊果苷、豆腐果苷、对羟基甲醇等多种活性物质[5-6],具有较强的1,1-二苯基-2-三硝基苯肼(DPPH)和2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)自由基清除能力以及抗氧化能力[7],其总抗氧化能力约为Trolox(水溶性维生素E)的1.7倍[4]。此外,MGP中含有5.04%~9.21%的粗蛋白质、0.9%~3.7%的可溶性糖[8],可作为一种潜在抗氧化型非常规饲料资源,缓解我国人畜争粮的尴尬处境。然而,MGP中含有单宁(1.06%~2.16%)、蜀黍苷(1.34~5.74 mg/g)等抗营养成分和大量纤维素[8-9],严重限制了其在养殖生产中的应用,使得大量的MGP被视为农业废弃物被直接丢弃或者露天堆肥,这不仅造成了环境污染,更造成了资源的浪费。
近年来,乳酸菌发酵技术由于在处理非常规饲料资源方面具有独特优势,受到饲料行业研究人员的高度关注。Roger等[10]研究发现,利用植物乳杆菌(Lactobacillusplantarum)A6和发酵乳杆菌(Lactobacillusfermentum)N33发酵,可使玉米糊中的单宁含量分别减少98.8%和97.9%。马静静等[11]研究发现,经复合乳酸菌SFC-2发酵处理,木薯渣中氰化物含量最多可减少49.68%。Odey等[12]研究发现,微生物发酵显著降低了木薯中氰化物含量,并赋予产品独特的香气。但目前关于乳酸菌发酵MGP的研究鲜有报道。研究表明,MGP中的单宁具有广谱抑菌性,对乳酸菌、枯草芽孢杆菌等发酵菌种具有抑制作用,且对革兰氏阳性菌的抑制作用强于革兰氏阴性菌[13],适用于发酵MGP的乳酸菌更无报道。因此,本试验旨在选育适于MGP发酵的乳酸菌,并对其生物特性及其对MGP的发酵品质进行研究,以期为非常规饲料原料的生物发酵提供菌种资源。
1 材料与方法
1.1 样品采集和菌株分离
采集新鲜的MGP(采自我国云南省澜沧县,22°33′N、99°55′E)。将样品粉碎至约20 mm2,将10 g样品与90 mL无菌生理盐水(8.50 g/L NaCl)混合,37 ℃培养48 h,充分振荡并吸取悬浮液,采用稀释涂布法,涂布于MRS固体培养基上,在37 ℃厌氧条件下培养1~3 d。待菌落长出后,挑取单菌落进行分离纯化。
1.2 菌株的鉴定
根据Kozaki等[14]的方法对纯化的菌株进行形态学和生理生化鉴定,并用杜氏小管进行产气试验;参照Nayak等[15]的方法对菌株溶血特性进行分析。使用试剂盒(通用型,北京擎科生物科技有限公司)提取供试菌株的16S rRNA。16S rRNA通用扩增引物为:27F(5′-AGA GTT TGA TCC TGG CTC AG-3′)和1492R(5′-GGT TAC CTT GTT ACG ACT T-3′)[16]。由武汉擎科生物科技股份有限公司进行16S rRNA测序鉴定,将测序结果在GenBank数据库中进行BLAST分析,采用MEGA 7.0软件构建系统发育树。
1.3 菌株生长及抑菌特性的测定
参照张琛等[17]的研究方法测定供试菌株的生长曲线和产酸曲线;以大肠杆菌(Escherichiacoli,E.coli)K88、沙门氏菌(Salmonellaenteritidis,S.enteritidis)ATCC14028和金黄色葡萄球菌(Staphylococcusaureus,S.aureus)ATCC25923为病原指示菌(由湖南农业大学动物医学院惠赠),采用K-B法检测供试菌株对指示菌的抑菌特性。取稳定期各菌液,并调节浓度至1×108CFU/mL,用无菌拭子蘸取指示菌涂布于LB固体培养基中,将20 μL的供试菌株菌液接种到附着在LB琼脂平板上的空白药敏纸(直径6 mm)上,37 ℃培养24 h后测量抑菌圈直径。
1.4 纤维素酶和发酵菌剂添加量的确定
根据纤维素酶使用说明,分别向MGP中添加0.15%、0.30%、0.60%、0.90%、1.20%的纤维素酶(购自北京挑战生物技术有限公司,活性≥2×104U/g),充分混合后用真空包装机抽真空,静置于(30±2) ℃,并以未添加纤维素酶的MGP为对照。24 h后取样,利用还原糖含量检测试剂盒[亚科因(武汉)生物技术有限公司]检测不同剂量纤维素酶处理下还原糖含量,以还原糖含量最高组所对应的剂量为纤维素酶最佳添加量。
在最佳纤维素酶添加量的基础上,开展发酵菌剂最佳接种量试验。取稳定期菌液,调整菌液浓度为1×108CFU/mL,分别向MGP中接种1%、2%、3%、4%、5%的供试菌剂,充分混合后用真空包装机抽真空,静置于(30±2) ℃,并以未接种的MGP为对照,发酵72 h后取样[18],根据蒋媛媛等[19]的方法,采用Sartorius PB-10型pH计测定各组pH,以pH最低组对应的剂量为最佳接种量。
1.5 发酵试验设计
以供试菌株(1×108CFU/mL)为发酵菌剂,以纤维素酶(活性≥2×104U/g)为发酵酶制剂。收集MGP,粉碎至1 cm2以下,调整水分含量为60%,添加0.90%的发酵酶制剂和4%的发酵菌剂,充分混合后装入厌氧发酵袋,密封真空,在(30±2) ℃下发酵7 d;并以发酵前为原始样品,保存于-20 ℃,待测。
1.6 营养成分分析
采用冷冻干燥法对发酵前后样品进行干燥处理,根据AOAC(2000)[20]的方法测定样品干物质(DM)、粗灰分(Ash)和粗蛋白质(CP)含量,根据Van Soest等[21]的方法测定样品中粗纤维(CF)、酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量。参照GB/T 6436—2018的方法测定样品中钙含量[22]。参照GB/T 6437—2018的方法测定样品中磷含量[23]。样品总能(GE)采用全自动量热仪(SDAC6000全自动量热仪,湖南三德科技股份有限公司)测定。利用乳酸(lactic acid,LA)试剂盒(北京盒子生工科技有限公司)检测样品中LA含量,参考Zhao等[24]的方法采用气相色谱法测定样品中乙酸(acetic acid,AA)、丙酸(propionic acid,PA)和丁酸(butyric acid,BA)含量。
1.7 感官质量和饲料价值的评价
采用磷钼酸-钨酸钠比色法[25]测定单宁含量。采用异烟酸-吡唑酮分光光度法[26]测定氰化物浓度。按照Liu等[27]的评分方法对发酵饲料进行评估。
根据Rohweder等[28]的方法,计算MGP发酵前后的相对饲料价值(relative feed value,RFV)。
1.8 数据处理及统计分析
使用SPSS 17.0软件进行单因素方差分析和Duncan氏法多重比较。试验数据用Origin 2021软件作图分析。结果以平均值±标准差(mean±SD)表示,P<0.05为差异显著。
2 结 果
2.1 发酵菌株的筛选、鉴定
本研究成功分离获得1株可适应MGP环境的同源菌株,命名为ZC529。由图1可见,菌株ZC529在MRS培养基上生长良好,菌落呈乳白色,凸起圆形,边缘整齐,直径为(2.0±0.1) mm。革兰氏染色阳性,短杆菌。根据16S rRNA序列构建菌株ZC529的系统进化树,菌株ZC529与发酵乳杆菌菌株MGB41-4(HM058137.1)趋同于一个分支,亲缘关系最为密切。结合形态学观察,最终鉴定菌株ZC529为发酵黏液乳杆菌(Limosilactobacillusfermentum)。
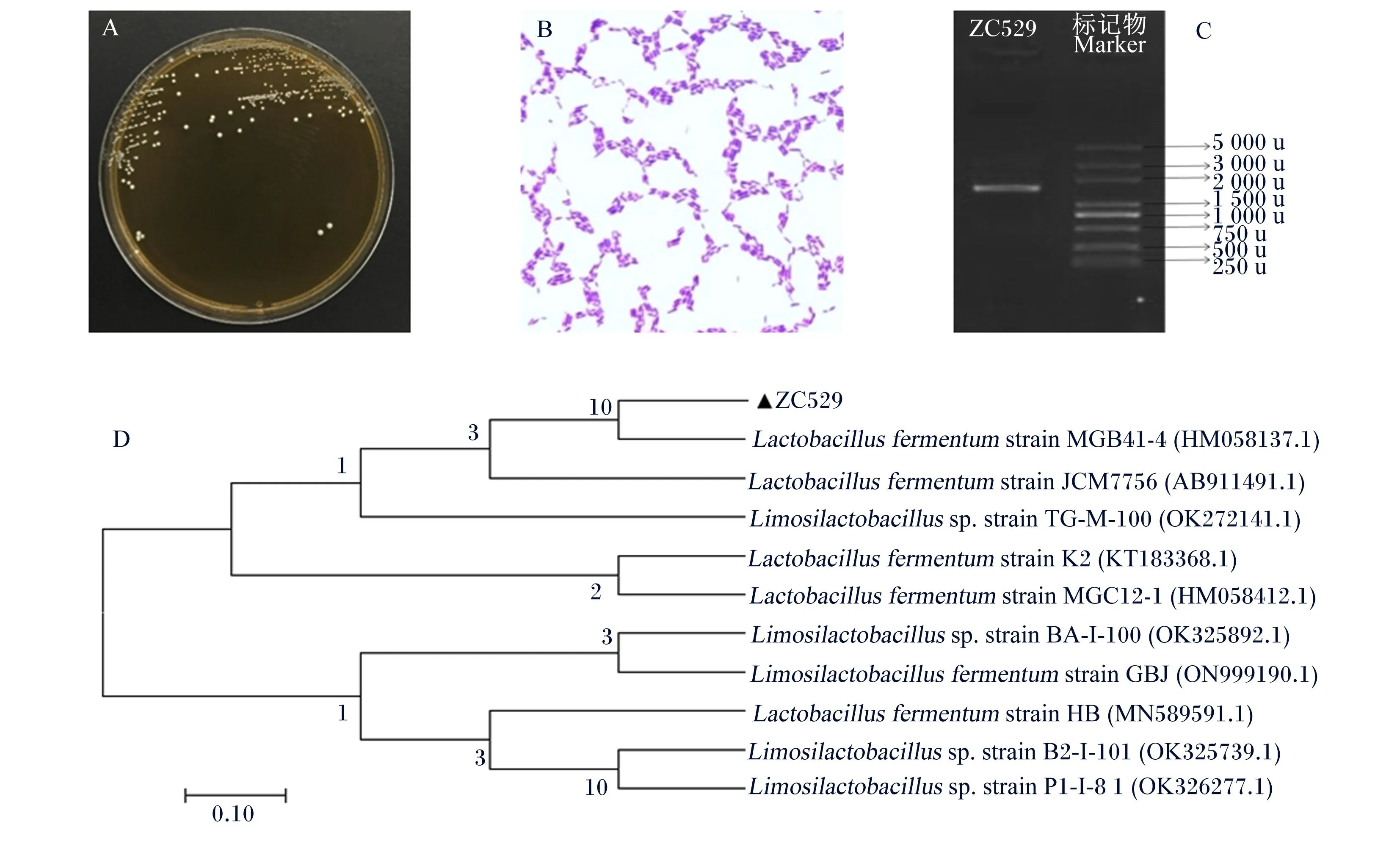
Lactobacillus fermentum strain:发酵乳杆菌菌株;Limosilactobacillus sp. strain:罗伊氏乳杆菌菌株。
菌株ZC529生理生化鉴定结果见表1,该菌无触媒反应,葡萄糖产气,无溶血反应,可以利用麦芽糖、甘露醇、蔗糖、棉子糖等常规碳源,但不可利用纤维二糖、山梨醇和七叶苷,结合镜鉴及生理生化特征,初步鉴定菌株ZC529为杆状乳酸菌。
2.2 菌株ZC529的生长特性、抑菌特性及药物敏感性
菌株ZC529的生长、pH曲线和抑菌效果如图2所示。发酵液的吸光度(OD)值在2 h内明显变化,菌株ZC529处于延滞期;2~10 h内呈对数增长,菌株ZC529处于对数期;10 h后趋于稳定,菌株ZC529进入稳定期。发酵液的pH随OD值的增加而降低,在稳定期趋于稳定,并达到最低值约4.0。对E.coli、S.aureus和S.enteritidis均表现出抑制作用,供试菌对指示致病菌的抑制作用由强到弱依次为E.coli>S.aureus>S.enteritidis,其中菌株ZC529对E.colli的抑制作用最强,抑菌圈直径显著大于S.aureus和S.enteritidis(P<0.05)。菌株ZC529对不同抗生素的耐药性结果见表2,菌株对10种抗生素均敏感,说明该菌具有较高的可控性和安全性。
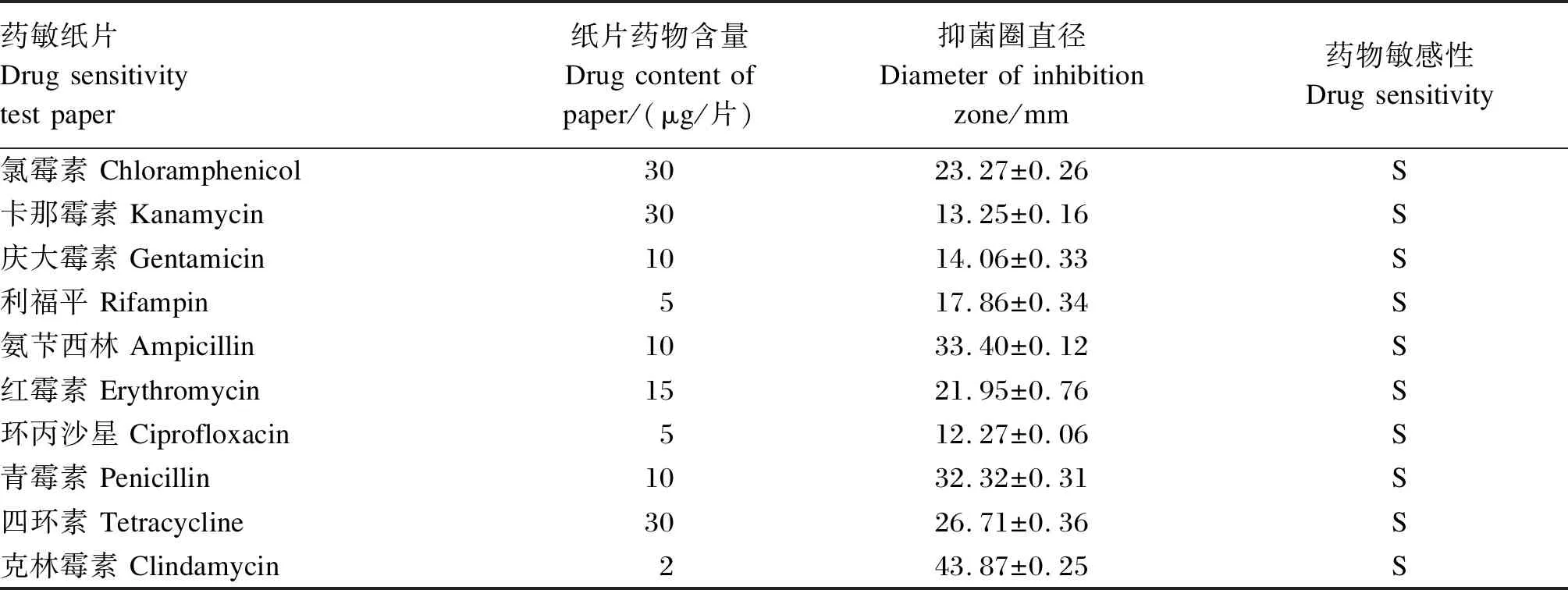
表2 菌株ZC529对不同抗生素的耐药性结果

A:生长和pH曲线 growth and pH curves;B:抑菌圈直径 diameter of inhibition zone;C:金黄色葡萄球菌 S. aureus;D:大肠杆菌 E. coli;E:沙门氏菌 S. enteritidis。
2.3 MGP中还原糖含量和pH的变化
不同剂量纤维素酶对MGP中还原糖含量的影响如图3-A所示,MGP中还原糖含量随纤维素酶添加量的增加,呈先增加后减少的趋势,当纤维素酶添加量为0.90%时还原糖含量最高,显著高于其他添加量(P<0.05)。发酵菌剂接种量对MGP中pH的影响如图3-B所示,MGP中pH随着接种量的增加而逐渐降低并趋于稳定,接种量为4%时pH显著低于接种量为0、1%、2%和3%时(P<0.05)。综上所述,确定纤维素酶添加量为0.9%,发酵菌剂接种量为4%。

图3 MGP中还原糖含量和pH的变化
2.4 菌株ZC529对MGP营养成分和发酵品质的影响
MGP发酵前后的营养成分和发酵品质如表3所示。与发酵前相比,发酵后MGP中Ash和CP含量显著升高(P<0.05),NDF和ADF含量均显著降低(P<0.05);此外,发酵后MGP中LA、AA和PA含量显著提高(P<0.05),未检测出BA。

表3 MGP发酵前后的营养成分和发酵品质(干物质基础)
2.5 MGP中抗营养因子和饲用价值的变化
发酵前后MGP中抗营养因子和饲用价值的变化如图4所示。经菌株ZC529发酵后,MGP中单宁和氰化物含量均显著低于发酵前(P<0.05),分别降低了83.78%和73.63%;并且发酵后MGP的RFV从88.85提高到了108.34,感官评分从4.31提高到了8.43,均差异显著(P<0.05)。
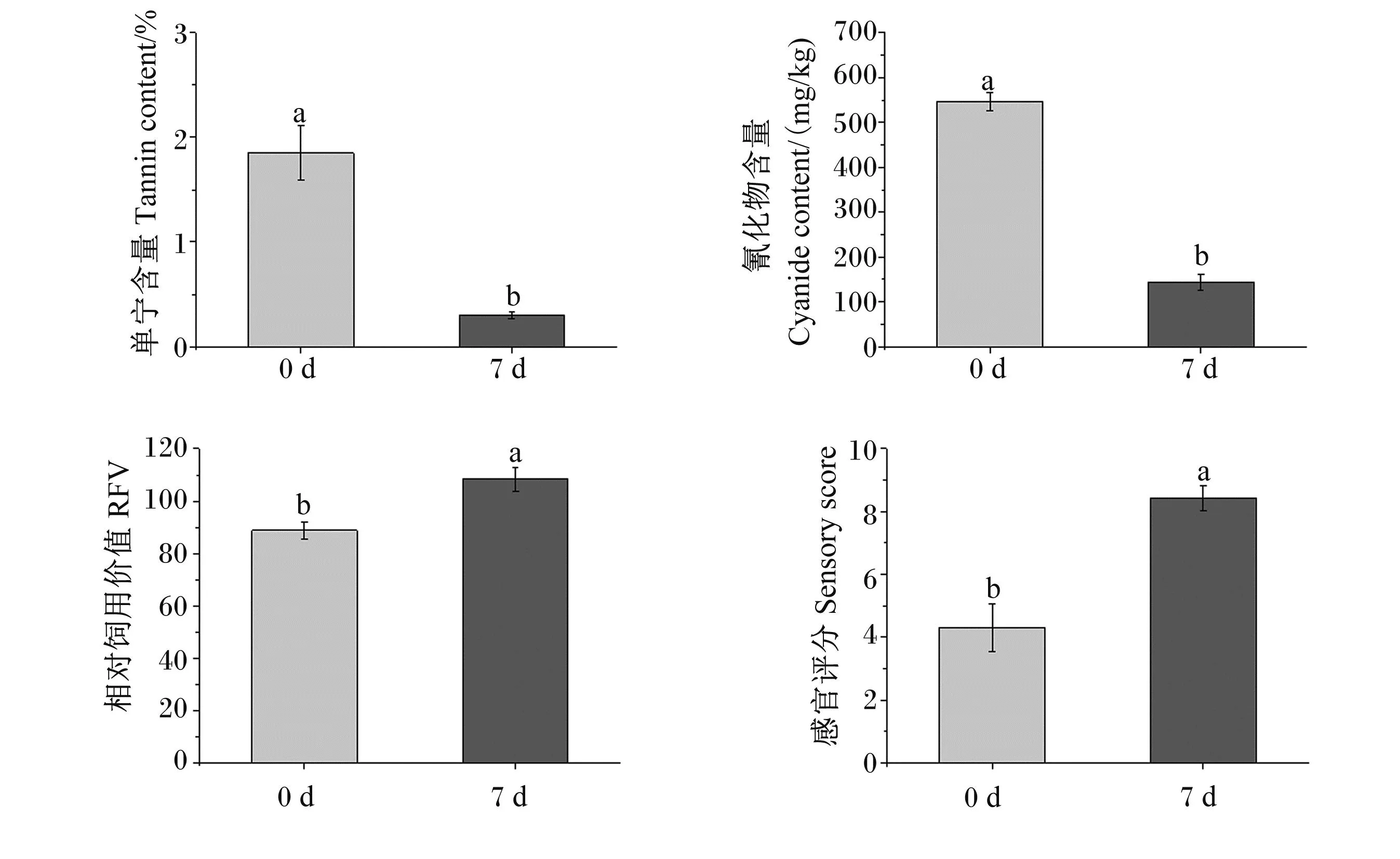
图4 MGP中抗营养因子和饲用价值的变化
3 讨 论
利用微生物发酵来开发利用植物非常规饲料是解决农业废弃物的重要方向[29],其中乳酸菌应用最为广泛[30]。植物附生的天然乳酸菌具有较强的特异性,对同源植物的适应性强,对发酵品质的促进效果显著[31]。舒刚钦等[32]研究表明,构树来源的乳酸菌更耐受构树单宁环境。陈开琼等[33]研究表明,枸杞叶源的乳酸菌相较同种商品菌株,对枸杞叶发酵营养品质的改善作用更强。为此本研究以新鲜MGP为原材料,从中筛选适于发酵MGP的同源乳酸菌。所获菌株ZC529,经鉴定为发酵黏液乳杆菌,发酵黏液乳杆菌即发酵乳杆菌,具有改善食品风味、增加营养、抑制致病菌、防腐、提高机体免疫、促进肠道健康等益生作用[34-35]。美国及欧洲食品和药物管理局均将其评估为食品用微生物菌种,我国已将其列为《可用于食品的菌种名单》[35]。本试验所获得的菌株ZC529,对E.coli、S.aureus和S.enteritidis均有抑制作用,此外,菌株ZC529生长迅速可在10 h内达到稳定期并将发酵体系pH降至4左右,且无溶血反应,对供试的10类抗生素均敏感,表明该菌株具有良好的发酵特性和较高的生物安全性,可满足饲料发酵及饲用安全的相关需求,可用作为MGP发酵的微生物菌剂。
还原糖作为微生物的直接能量来源,是乳酸菌快速增殖的先决条件,提高发酵底物的可溶性糖含量是保证发酵成功的条件[36]。本研究发现,MGP中还原糖含量较低,难以支持菌株ZC529在短时间内大量增殖。研究表明,适当使用纤维素酶制剂能有效提高发酵底物中还原糖含量,促进豆皮、藜麦秸秆等高纤维类非常规饲料原料的发酵[36-37]。在本研究中,经单因素试验确定,添加0.90%的纤维素酶可显著提高MGP中还原糖含量,为乳酸菌在发酵初期快速繁殖提供充足底物。本试验采用菌株ZC529与纤维素酶协同发酵,纤维素酶的添加使MGP中的纤维素酶解为还原糖,为菌株ZC529的快速增殖提供大量的碳源,而菌株ZC529的迅速增殖的同时分泌大量有机酸,使发酵体系pH迅速降低,进而抑制了纤维素酶活性,纤维素分解受到抑制;同时,CF中除含有纤维素外,还含有半纤维素、木质素等成分[38],难以被纤维素酶分解利用。菌株ZC529为异型发酵乳酸菌,受菌株自身新陈代谢影响,MGP中的营养被菌株ZC529消耗,使得发酵后MGP中DM含量降低,因此发酵后的MGP中CF含量相对发酵前略有升高,但无显著差异。
植物性非常规饲料原料往往具有CF含量高、抗营养因子或有毒物质种类多、适口性差、营养价值低等特点[29-30]。MGP中纤维素含量较高,同时还有较高的单宁和氰化物含量,是限制MGP在畜牧生产应用的关键因素。Li等[39]指出,菌酶协同处理是发酵和酶解的有机结合,通过该方法对饲料原料进行加工处理,可达到更好的饲用效果。微生物和酶组合可以对基质中的大分子物质和抗营养因子进行更充分的发酵和降解[40]。在本研究中,结合MGP原料物料特性,采用菌酶协同一次发酵工艺,通过添加纤维素酶与菌株ZC529协同作用完成对MGP的发酵与酶解。发酵菌株ZC529与夏威夷果同源,可耐受MGP的单宁和氰化物环境,在MGP环境中迅速增殖,有效改善MGP中的常规营养成分,显著增加了发酵MGP中的LA、AA和PA等有机酸含量,提高了MGP的发酵品质和饲用价值。且发酵黏液乳杆菌产生的单宁酶可降解MGP中的缩合单宁[41],乳酸菌发酵在发酵过程中分泌的氰化物水合酶可将生氰糖苷分解为二氧化碳(CO2)、氨和甲酸,并为其生长繁殖提供碳源[42-43],使发酵基质中氰化物和单宁等抗营养因子的含量显著降低,改善了MGP的适口性和营养品质。
4 结 论
本试验从MGP中分离获得1株发酵黏液乳杆菌ZC529,该菌株无溶血反应,并对10种抗生素敏感,安全性高,同时对E.coli、S.aureus和S.enteritidis均有抑制作用。在纤维素酶协同作用下,经菌株ZC529发酵,可将MGP中单宁和氰化物含量分别降低83.78%和73.63%,并可降低NDF、ADF含量,提高饲用价值,改善MGP的营养品质和发酵品质。
