蒲公英水提物对热应激条件下奶牛产奶性能、血清生化指标、乳中体细胞数及粪便微生物多样性的影响
2024-03-05李赵嘉杨文娇李名雪陈志颖王秀萍毛立娟
李赵嘉 孟 然* 杨文娇 冯 薇 李名雪 陈志颖 王秀萍* 毛立娟 陈 娜
(1.河北省农林科学院滨海农业研究所,唐山市蒲公英工程技术研发中心,唐山市植物耐盐研究重点实验室,河北省盐碱地绿化技术创新中心,曹妃甸 063200;2.唐山拓普生物科技有限公司,河北酵母技术创新中心,开平 063000;3.河北桃晟堂农业科技开发有限公司,涉县 056400;4.中科康源(唐山)生物技术有限公司,迁安 064400)
夏季高温高湿的养殖环境极易诱发奶牛产生热应激,爆发乳房炎,导致其抗氧化能力下降、免疫力低下、肠道菌群紊乱,并使牛乳中体细胞数(somatic cell count,SCC)急剧增加,降低牛乳品质,且极易变质,直接或间接造成奶牛产奶性能下降,给奶农造成巨大的经济损失[1]。目前,抗生素的使用作为防治奶牛乳房炎的主要手段,尽管取得了较好的防治效果,但由于养殖户过快地追求经济效益而造成抗生素被滥用,使其对人、动物、生态环境的危害日益凸显。同时,自2020年7月1日起,我国全面禁止抗生素在饲料端的添加,为保障我国畜牧业持续健康发展,寻找安全、绿色的饲料添加剂尤为重要[2]。蒲公英(TaraxacummongolicumHand.-Mazz.)及其提取物因具有良好的抗菌、消炎功效,且安全、绿色、无残留,能有效抑制奶牛乳房炎病原菌,可缓解炎症反应、增强生产性能、提升免疫力等,成为奶牛健康养殖的热点研究课题。
蒲公英又名黄花地丁,菊科多年生草本植物[3],是较为传统且常用的中草药,已入选国家卫健委颁布的“药食同源”植物目录。据《本草纲目》记载,蒲公英有清热解毒、消肿散结之功效,且富含胡萝卜素类、维生素、蛋白质、矿物质等多种营养成分,具有抗应激、促生长的作用;除此之外,蒲公英还富含酚酸类、黄酮类等多种活性成分,具有广谱的抗菌消炎作用,更有“药草皇后”和“天然抗生素”的美誉,尤其对金黄色葡萄球菌表现出较强的抑制作用[4-5]。研究表明,天然化合物酚酸类物质不能由人和动物自身合成,必须通过食物获得[6],该类物质具有抗氧化、抗炎、抑菌等多种生物活性,常被用于传统药物成分或作为膳食补充剂应用在现代营养品中[7]。据报道,蒲公英提取物中总酚酸类化合物含量高达120.5 mg/g[8],可通过调节蛋白激酶作用于细胞核内转录因子核因子-κB(NF-κB),调节炎症反应过程中的肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、诱导型一氧化氮合成酶(iNOS)、环氧化酶-2(COX-2)等和细胞黏附分子,从而抑制炎症的发生[9];同时,酚酸类化合物具有较强的抗氧化能力,可通过直接清除机体内活性氧自由基,抑制脂质过氧化,以及与变价金属离子螯合等途径发挥抗氧化作用[7]。因此,蒲公英及其提取物被广泛地应用在畜禽健康养殖中。
研究发现,蒲公英提取物可以显著降低1~28日龄仔猪的腹泻率,显著提高营养物质表观消化率,提高机体免疫功能,改变仔猪粪便微生物组成[10]。Samolińska等[11]证实,蒲公英根粉对74~137日龄育肥猪的增重具有促进作用。张鹏举等[12]研究表明,患乳房炎奶牛饲喂公英翘芦散(蒲公英、连翘、王不留行等)1 d后,乳液中SCC极显著降低;饲喂7 d后,患病乳区由75个减少至28个,治愈率达62.67%。另有研究指出,公英散对奶牛乳房炎临床治疗效果良好,总治愈率高达93.33%,不产生抗奶,且无弃奶期[13]。Li等[14]研究指出,饲粮中添加蒲公英可增加奶牛瘤胃中厚壁菌门(Firmicutes)相对丰度,并调节瘤胃的代谢,进而促进食物在瘤胃中被充分发酵和吸收。饲粮中添加0.5%的蒲公英提取物即可缓解奶牛的氧化应激反应,并使其泌乳性能得到改善[15];当蒲公英添加水平达到6.0%时,放牧肉牛血清球蛋白含量升高,极大程度改善了其血液代谢能力和集体免疫力[16]。但针对热应激所导致的奶牛产奶性能、抗氧化能力及免疫机能降低等问题,目前关于蒲公英水提物(dandelion water extract,DWE)对其影响的研究鲜有报道。因此,本试验旨在探讨饲粮中添加蒲公英水提物对热应激条件下奶牛产奶性能、血清抗氧化和免疫指标、SCC及粪便微生物多样性的影响,旨在为蒲公英水提物作为奶牛饲料添加剂提供理论参考。
1 材料与方法
1.1 试验材料
蒲公英水提物:采用自主研发的提取方法(专利号:202010339629.4)对自主选育的优质、高产蒲公英新品种“滨蒲1号”(省登记号:20181421)进行提取,经喷雾干燥后得蒲公英水提物。提取工艺条件:蒲公英∶水=1∶15,提取温度92 ℃,提取压力0.07 MPa,提取时间4.6 h。
蒲公英水提物的活性成分含量采用液相色谱-质谱联用(LC-MS)法定性、定量分析。蒲公英水提物中主要活性成分含量见表1,蒲公英总离子流(TIC)图见图1、图2。

图1 蒲公英总离子流图(正离子模式)
图2 蒲公英总离子流图(负离子模式)

表1 蒲公英水提物中主要活性成分含量
1.2 试验设计
试验选用120头泌乳日龄、体重、胎次、产奶量均相近的产奶期荷斯坦奶牛,采用完全随机试验设计原则分为3组,每组5个重复,每个重复8头牛。对照组(DZ组)饲喂基础饲粮,试验组分别在基础饲粮中添加50(DWE50组)和70 g/(头·d)(DWE70组)的蒲公英水提物(根据课题组前期预试验结果确定)。各组试验牛体况见表2。试验牛自由采食和饮水,试验时间为2023年7月1—31日,预试期3 d,正试期28 d。

表2 各组试验牛体况
1.3 试验饲粮
参照NRC(2001)奶牛饲养标准配制,以全混合日粮(TMR)形式饲喂,基础饲粮组成及营养水平见表3。
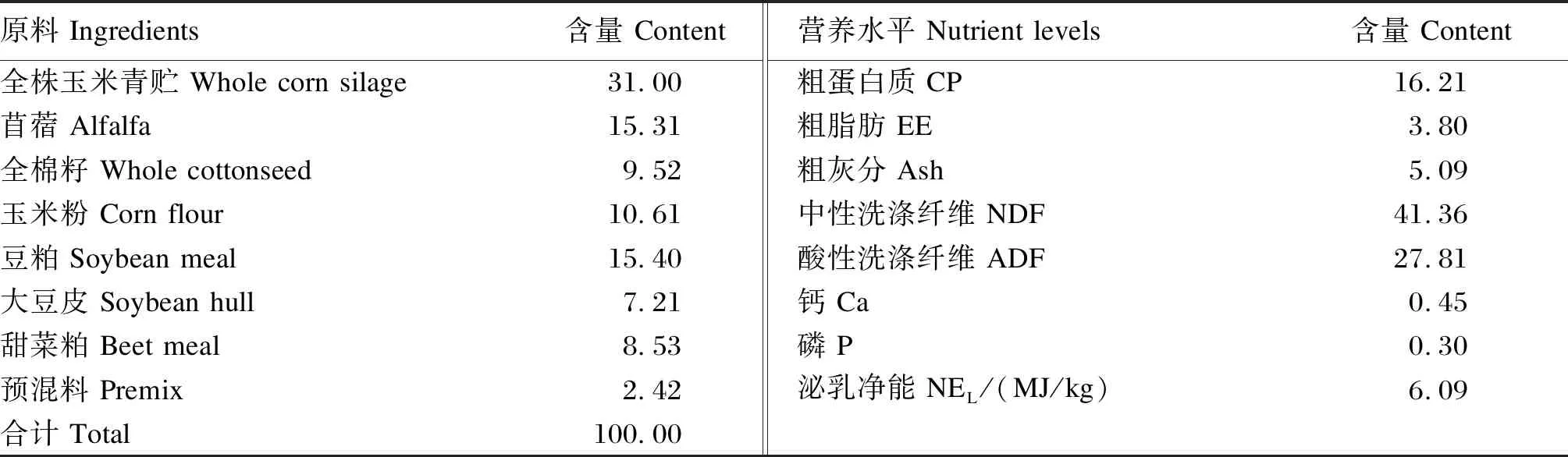
表3 基础饲粮组成及营养水平(干物质基础)
1.4 饲养管理
牛群进舍前7 d,对牛舍进行全面消毒。试验牛采用散栏饲养(带卧床),各组饲养管理条件一致。TMR车每天投料3次(06:00、14:00、22:00),自由采食,控制每天饲喂量,保持3%~5%剩料量。自由饮水,水槽每2 d清洗、消毒1次,保证水质清洁、健康、充足。粪便每天打扫2次,牛舍每周消毒2~3次,保持牛舍通风、清洁、干燥、卫生。每天04:00、12:00和20:00机械挤奶3次。
1.5 样品采集及指标测定
1.5.1 牛舍温湿度监测
正试期内,在试验牛舍两边及中间离地1.5 m处各悬挂1个温湿度计,分别记录每天08:00、14:00、20:00的温度及相对湿度,计算牛舍内每天环境的温湿度指数(THI)。计算公式为:
THI=td-(0.55-0.55×RH)×(td-58);td=T×9/5+32。
式中:td为华氏温度(℉),td=摄氏温度(℃)×1.8+32;RH为相对湿度(%)。
THI<68表示未受热应激;68≤THI<72表示热应激临界度;72≤THI<80表示轻度至中度热应激;80≤THI<90表示中度至严重热应激,THI≥90表示严重热应激。
1.5.2 饲粮营养成分测定
饲粮营养成分测定均参考国家标准或行业标准测定,具体如下。
干物质(DM):GB/T 6435—2014;粗蛋白质(CP):GB/T 6432—2018;粗脂肪(EE):GB/T 6433—2006;粗灰分(Ash):GB/T 6438—2007;中性洗涤纤维(NDF):GB/T 20806—2006;酸性洗涤纤维(ADF):NY/T 1459—2007;钙(Ca):GB/T 6436—2018;磷(P):GB/T 6437—2018。
1.5.3 产奶量及乳成分测定
产奶量测定:通过自动挤奶设备记录每头牛每日总产奶量。
乳成分测定:正试期内,第1、7、14、21、28天用无菌采样瓶在挤奶的早、中、晚时间段分别采集各组生鲜牛乳100 mL,将采样瓶密封并标识,立即送至无菌室,在无菌超净操作台分别将每组对应的奶样混合、摇匀。用无菌移液器移取奶样,测定乳脂率、乳蛋白率,并做好记录。采用全自动乳成分分析仪(HM-SAP,山东恒美电子科技有限公司)进行测定。
SCC测定:正试期内,第1、4、7、10、13、16、19、22、25、28天进行采样,采样操作同乳成分测定采样操作。采用流动细胞荧光计数仪(Countess Ⅱ FL,美国Thermo Fisher公司)进行SCC计数,并做好记录。
1.5.4 血清抗氧化和免疫指标测定
正试期内,于第1天和第28天晨饲3~4 h后,各组随机抽取奶牛血样15个:采用真空抗凝采血管于牛尾静脉处采血5 mL,将所采集血液样品在冰水混合模式中(0 ℃)静置30 min后于冷冻离心机中1 006.2×g离心10 min,分离得血清,并于-80 ℃超低温冰箱中保存。用于测定血清抗氧化和免疫指标。
抗氧化指标:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性及总抗氧化能力(T-AOC)、丙二醛(MDA)含量。
免疫指标:总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)含量。
以上指标均采用试剂盒进行测定,试剂盒由北京索莱宝科技有限公司提供。
1.5.5 粪便微生物多样性测定
正试期内,于第28天晨饲前,每组选取6头试验牛,带无菌手套刮取直肠末端粪样约20 g,装于无菌冻存管中,液氮速冻后于-80 ℃冰箱保存。利用16S rRNA基因测序技术测定粪便微生物多样性,以各试验组奶牛粪便总DNA为模版,对细菌16S rRNA基因V3~V4区进行PCR扩增,通过Illumina NovaSeq 6000测序平台进行微生物多样性检测,分析群落生物在门水平和属水平的组成及相对丰度。测定工作由百迈客生物科技有限公司完成。
1.6 统计与分析
原始数据经Excel 2019初步整理后,采用SPSS 23.0软件中t检验进行差异显著性分析,以P<0.05为差异显著性判断标准,结果以平均值和均值标准误(SEM)表示。
2 结 果
2.1 牛舍温度、相对湿度及THI变化
根据每日监测的牛舍温度、相对湿度,计算牛舍THI,并绘制成图。由图3可知,正试期内,牛舍日平均THI>72,表明试验牛均处于热应激状态,满足试验所需的热应激条件。
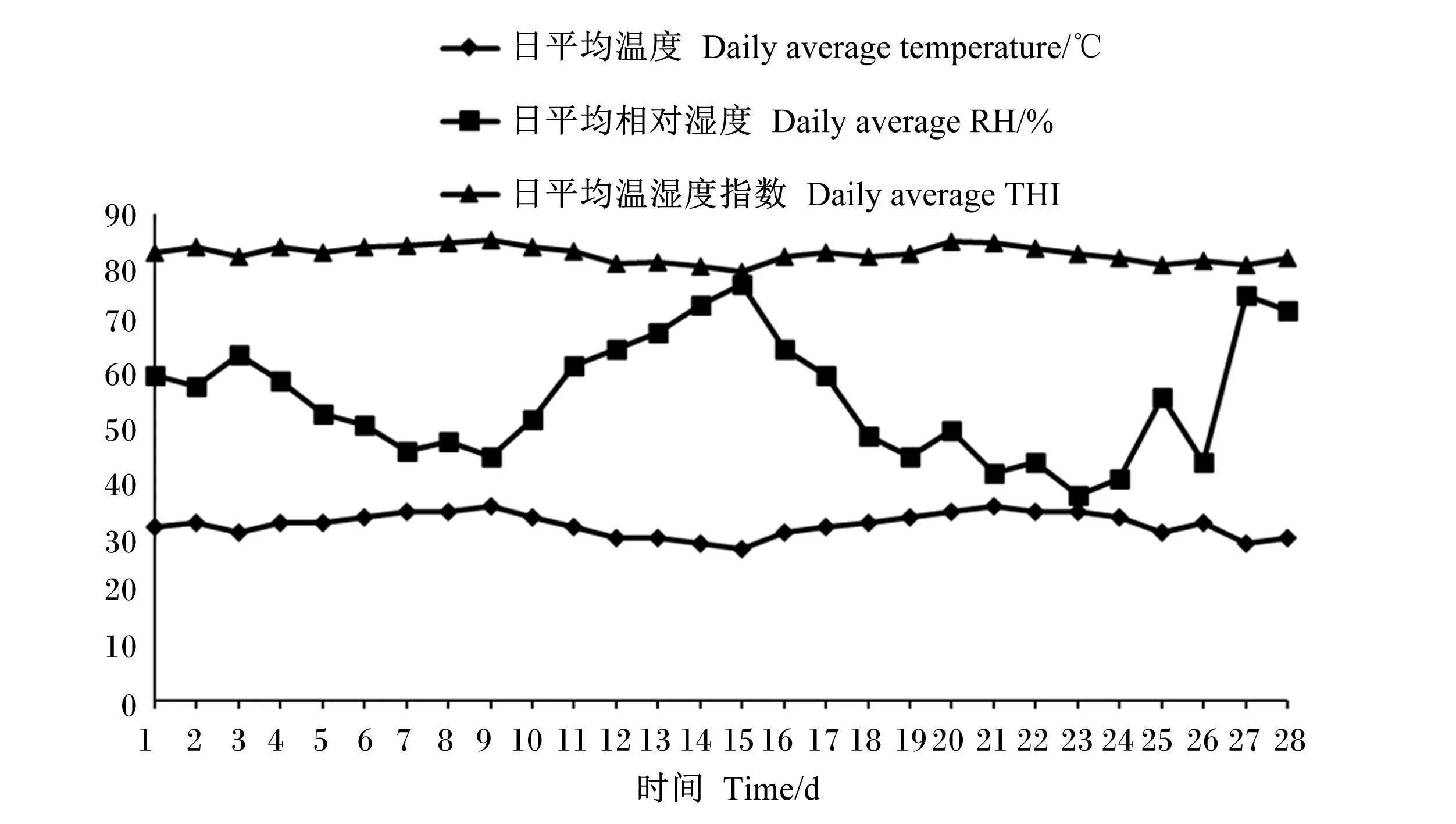
图3 牛舍温度、相对湿度及THI
2.2 蒲公英水提物对热应激条件下奶牛产奶性能的影响
由表4可知,第14、21、28天,DWE50组、DWE70组的产奶量均显著高于DZ组(P<0.05)。第7、14、21、28天,DWE70组的乳蛋白率显著高于DZ组(P<0.05);第21、28天,DWE50组的乳蛋白率显著高于DZ组(P<0.05)。第14、21、28天,DWE70组的乳脂率显著高于DZ组(P<0.05);第28天,DWE50组的乳脂率显著高于DZ组(P<0.05)。

表4 蒲公英水提物对热应激条件下奶牛产奶性能的影响
2.3 蒲公英水提物对热应激条件下奶牛血清抗氧化指标的影响
由表5可知,与第1天相比,DWE50组、DWE70组的第28天血清SOD、CAT、GSH-Px活性及T-AOC均呈有所升高,血清MDA含量则有所下降。第28天,DWE70组的血清SOD、GSH-Px活性及T-AOC显著高于DZ组(P<0.05),DWE50组的血清GSH-Px活性及T-AOC显著高于DZ组(P<0.05),DWE50组、DWE70组的血清MDA含量均显著低于DZ组(P<0.05)。

表5 蒲公英水提物对热应激条件下奶牛血清抗氧化指标的影响
2.4 蒲公英水提物对热应激条件下奶牛血清免疫指标的影响
由表6可知,与第1天相比,DWE50组、DWE70组的第28天血清TP、ALB、GLB、IgA、IgM、IgG含量均有所增加。第28天,DWE50组的血清IgG含量显著高于DZ组(P<0.05),DWE70组的血清GLB含量显著高于DZ组(P<0.05)。

表6 蒲公英水提物对热应激条件下奶牛血清免疫指标的影响
2.5 蒲公英水提物对热应激条件下奶牛乳中SCC的影响
由图4可知,从第1天至第28天,DZ组的乳中SCC略有升高,但整体趋于平稳;DWE50组、DWE70组的乳中SCC均表现出下降趋势。DWE50组第4天至第22天乳中SCC下降,第22天至第28天乳中SCC趋于平稳;DWE70组第4天至第13天乳中SCC下降,第13天至第28天乳中SCC趋于平稳。与DWE50组相比,DWE70组的乳中SCC下降较为迅速,且第28天乳中SCC更低。
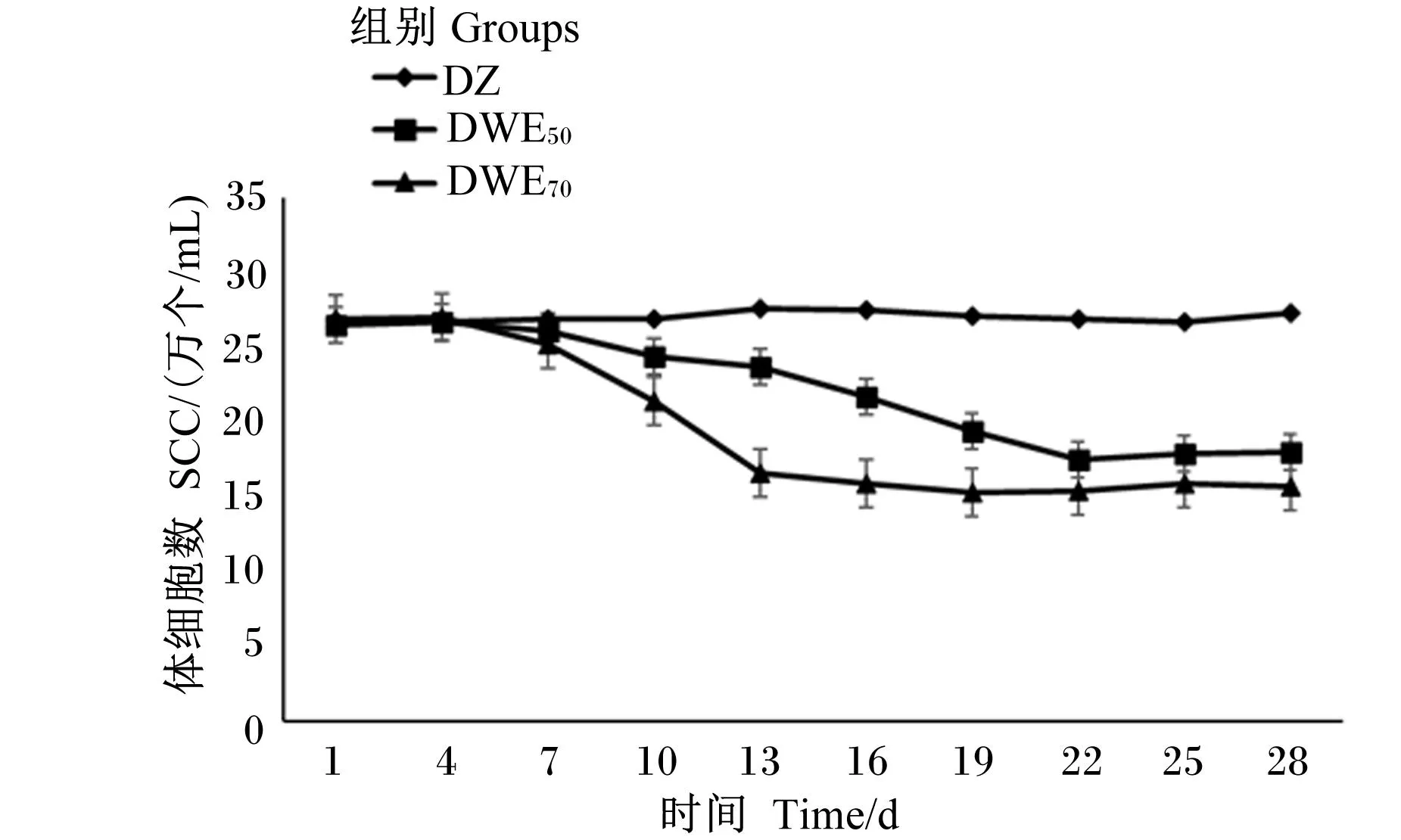
图4 蒲公英水提物对热应激条件下奶牛乳中SCC的影响
2.6 蒲公英水提物对热应激条件下奶牛粪便微生物多样性的影响
2.6.1 粪便微生物Venn图
结束测序后,对Reads在97%的相似度水平下进行聚类,获得操作分类单元(OTUs)。根据OTUs表格分析聚类信息并绘制韦恩图。由图5可知,3组奶牛粪便中共有OTUs数量为828个,DZ组和DWE50组共有OTUs数量为835个,DZ组和DWE70组共有OTUs数量为842个,DWE50组和DWE70组共有OTUs数量为852个,DZ组、DWE50组、DWE70组分别含有853、864、876个OTUs,DZ组独有4个OTUs,DWE50组独有5个OTUs,DWE70组独有10个OTUs。
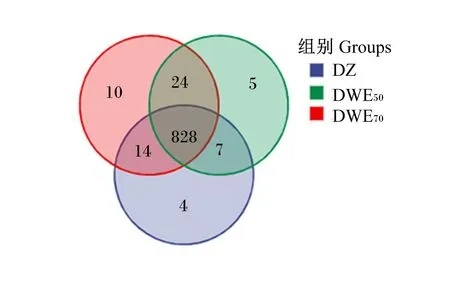
图5 OTUs分布韦恩图
2.6.2 粪便微生物α多样性分析
基于OTUs分类水平对各组奶牛粪便微生物α多样性指数进行分析,由图6可知,与DZ组相比,DWE50组的粪便微生物ACE指数、Chao1指数、Shannon指数、Simpson指数及DWE70组的粪便微生物Shannon指数、Simpson指数均无显著差异(P>0.05),DWE70组的粪便微生物ACE指数、Chao1指数显著升高(P<0.05)。
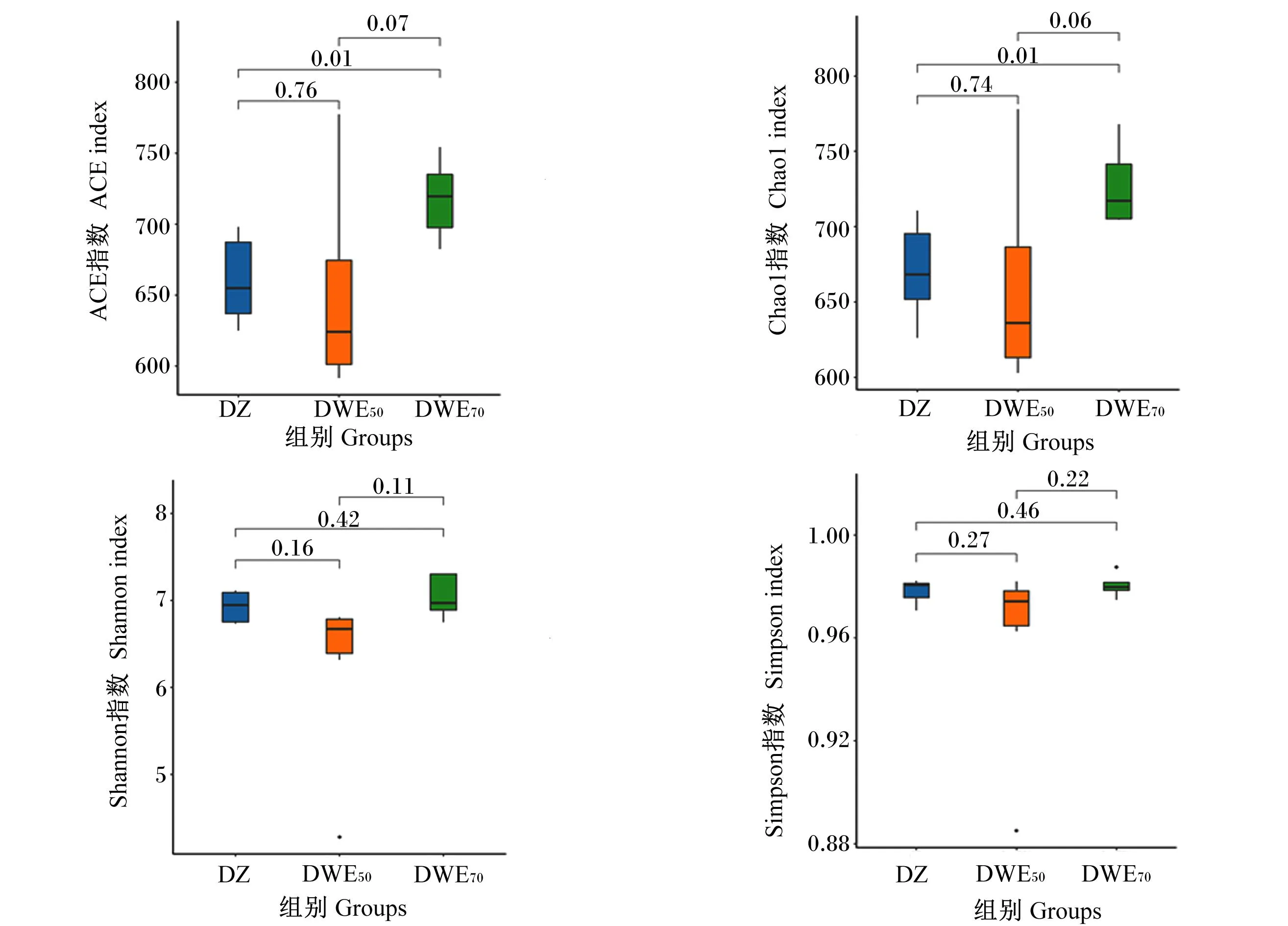
图6 粪便微生物α多样性分析
2.6.3 粪便微生物β多样性分析
基于OTUs分类水平对各组奶牛粪便微生物β多样性指数进行分析,由图7可知,第1主成分贡献率为15.02%,第2主成分贡献率为9.02%。DZ组、DWE50组的粪便微生物样点基本集中分布,DWE70组的粪便微生物样点相对分散,可以明显区分并聚成3个类群,说明粪便微生物群落结构差异明显。
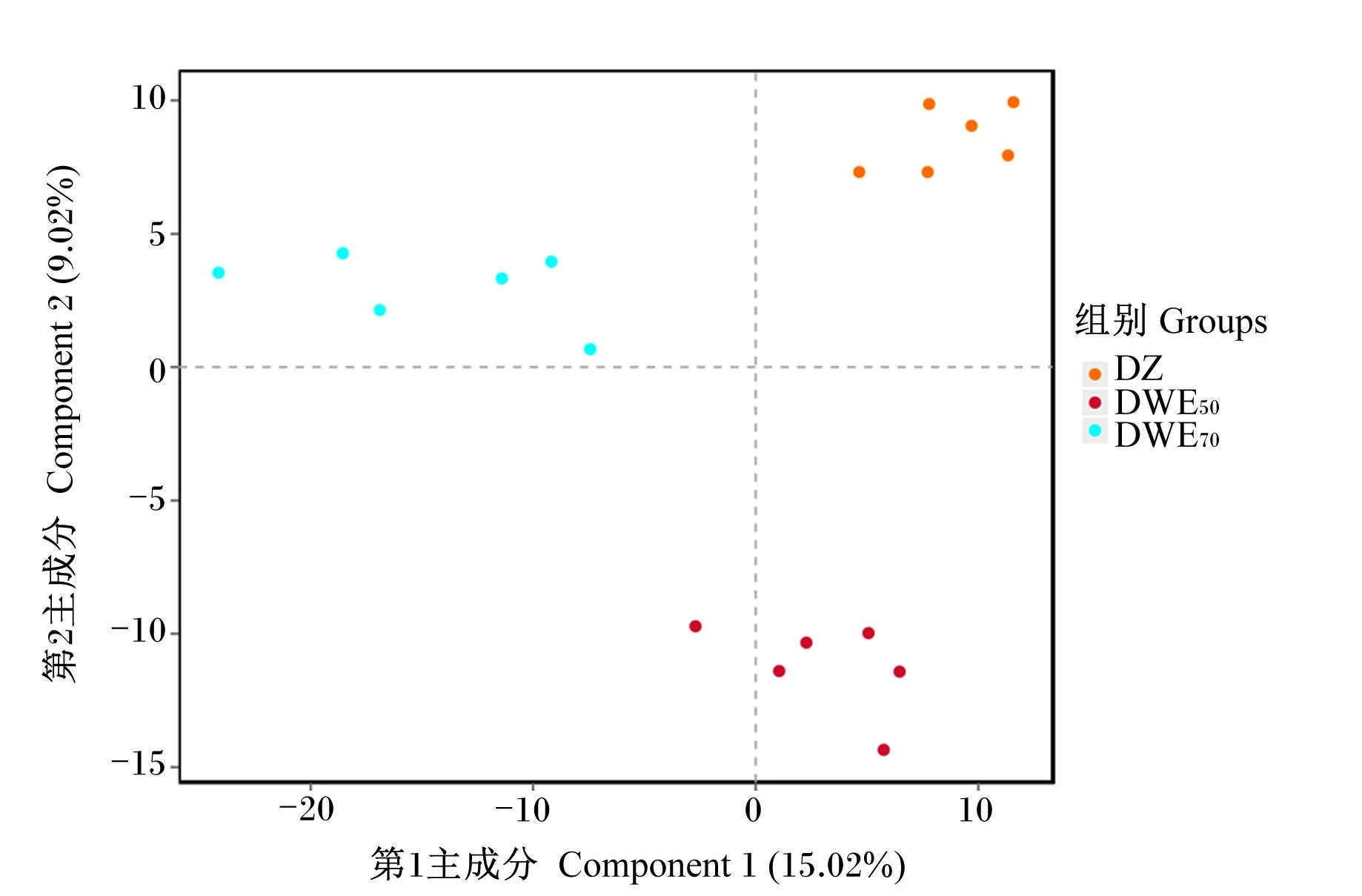
图7 粪便微生物β多样性分析
2.6.4 粪便微生物相对丰度在门和属水平上的变化
在门水平上,对DZ组、DWE50组、DWE70组相对丰度排行前10的菌门进行统计,由图8可知,3个组的粪便优势菌门均为拟杆菌门(Bacteroidetes)、厚壁菌门。由表7可知,与DZ组相比,DWE50组、DWE70组的粪便拟杆菌门相对丰度显著升高(P<0.05),DWE50组的粪便厚壁菌门相对丰度显著升高(P<0.05)。

Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Fusobacteria:梭杆菌门;Euryarchaeota:广古菌门;Actinobacteria:放线菌门;Acidobacteria:酸杆菌门;Epsilonbacteraeota:ε变形菌门;Spirochaetes:螺旋菌门;Elusimicrobia:迷踪菌门;Others:其他:Unknown:未知。
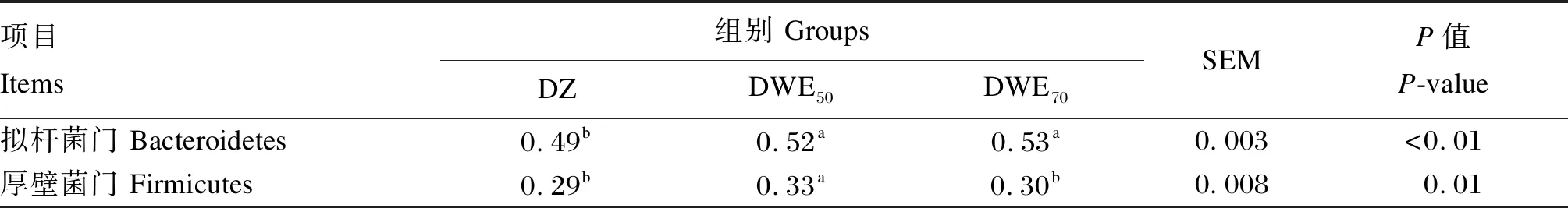
表7 门水平优势微生物相对丰度
在属水平上,对DZ组、DWE50组、DWE70组相对丰度排行前10的菌属进行统计,由图9可知,DZ组的粪便拟杆菌属(Bacteroides)相对丰度最高,其次为未培养的拟杆菌目(uncultured_bacterium_o_Bacteroidales);DWE50组、DWE70组的粪便拟杆菌属相对丰度最高,其次为理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)。

Bacteroides:拟杆菌属;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;uncultured_bacterium_o_Bacteroidales:未培养的拟杆菌目;uncultured_bacterium_f_Ruminococcaceae:未培养的瘤胃菌科;Ruminococcaceae_UCG-014:瘤胃菌科UCG-014;uncultured_bacterium_f_Lachnospiraceae:未培养的毛螺菌科;uncultured_bacterium_f_Clostridiales_vadinBB60_group:未培养的梭状芽孢杆菌科vadinBB60群;[Ruminococcus]_torques_group:瘤胃球菌属组;Desulfovibrio:脱硫弧菌属;Phascolarctobacterium:考拉杆菌属;Others:其他:Unknown;未知。
2.6.5 粪便微生物线性判别分析效应大小(LEfSe)分析
由图10可知,采用粪便微生物进化分支图评估组间微生物丰富度的差异,在线性判别分析(LDA)值>3.5条件下,共计28个不同分类水平优势微生物,DZ组、DWE50组、DWE70组分别为4、11、13个。当LDA值>4.0,DZ组较其他组具有显著差异的物种有未培养的普雷沃氏菌科(uncultured_bacterium_f_Prevotellaceae),DWE50组较其他组具有显著差异的物种有酸杆菌门(Acidobacteria)、酸杆菌纲(Acidobacteriia),DWE70组较其他组具有显著差异的物种有梭状芽孢杆菌纲(Clostridia)、梭状芽孢杆菌目(Clostridiales)、厚壁菌门、未培养的拟杆菌目等。

f_Acidobacteriaceae_Subgroup_1:酸杆菌科-子群1;f_Solibacteraceae_Subgroup_3:索力氏菌科-子群3;o_Solibacterales:索利氏菌目;g_uncultured_bacterium_f_Prevotellaceae:未培养的普雷沃氏菌科;g_Parabacteroides:狄氏副拟杆菌属;g_uncultured_bacterium_o_Bacteroidales:未培养的拟杆菌目;f_uncultured_bacterium_o_Bacteroidales:未培养的拟杆菌目;g_Mucispirillum:黏液螺旋菌属;f_Deferribacteraceae:脱铁杆菌科;o_Deferribacterales:脱铁杆菌目;g_Elusimicrobium:迷踪菌属;f_Elusimicrobiaceae:迷踪菌科;o_Elusimicrobiales:迷踪菌目;o_Lactobacillales:乳杆菌目;g_uncultured_bacterium_f_Clostridiales_vadinBB60_group:未培养的梭状芽孢杆菌属vadinBB60群;f_Clostridiales_vadinBB60_group:梭状芽孢杆菌科vadinBB60群;g_Tyzzerella:泰勒菌属;g_Faecalibacterium:普拉梭菌属;g_Intestinimonas:颤螺旋菌属;o_Clostridiales:梭状芽孢杆菌目;f_Succinivibrionaceae:琥珀酸弧菌科;o_Aeromonadales:气单胞菌目;g_Massilia:马赛菌属;o_Chthoniobacterales:西索恩氏菌目。
3 讨 论
3.1 蒲公英水提物对热应激条件下奶牛产奶性能的影响
奶牛热应激是奶牛处于高温、高湿环境中对热暴露所做出的非特异性生理反应,研究表明,热应激加快机体自身营养物质消耗,造成机体代谢机能紊乱,并抑制免疫功能,最终导致产奶性能下降[17]。产奶性能的提升是增加经济效益的关键,是反映奶牛生产最直接的指标。植物提取物中所富含的多种活性物质能够增强奶牛胃肠道蠕动,调节肠道微生物群[18],促进肠道细胞对养分的消化吸收,提升奶牛对饲料的转化率,提高营养物质的消化吸收,改善奶牛产奶性能,减缓热应激带来的不利影响[19]。
Olagaray等[20]研究发现,黄芩提取物中黄酮类化合物可显著增长奶牛全期泌乳量,同时牛乳中乳脂肪、乳蛋白等营养成分含量明显增加。杜仲提取物中绿原酸等有机酸类化合物、黄酮类化合物可提升牛乳中乳脂率和乳糖率,显著改善牛乳的品质[21]。当奶牛口服夏威夷果实提取物,奶牛中营养成分含量发生积极变化,乳液中pH、电导率均显著降低,产奶性能得到积极改善[22]。另外,植物多糖类化合物可以调节生产期畜禽动物的气血,提高畜禽动物本身的机体抵抗热应激能力,维持畜禽动物正常的内环境平衡,保持旺盛的生殖能力,提高畜禽动物的生产性能[23]。乳腺上皮细胞是奶牛哺乳期分泌乳汁的主要场所,热应激极易使乳腺组织产生炎症,进而受到损伤,使乳腺上皮细胞数量和活性受到影响,导致奶牛产奶量的降低[24]。有文献指出,热应激会抑制机体下丘脑活动,影响生产性能激素的分泌[25],而蒲公英可作用于机体下丘脑-脑垂体系,通过促进卵泡刺激素(FSH)、黄体生成素(LH)、孕激素P分泌来改善乳腺的泌乳性能。
本试验期内,牛舍内THI>72,表明试验奶牛均处于热应激状态,试验结果显示,当奶牛饲粮中添加蒲公英水提物饲喂一段时间,DWE50组、DWE70组奶牛的产奶量、乳蛋白率、乳脂率等较DZ组显著提高。产生该结果的原因可能是因为本试验所用蒲公英水提物包括碳水化合物、多糖、多肽等多种营养物质成分,且包含酚酸类化合物、黄酮类化合物、多糖类化合物、生物碱类化合物等多种活性成分,具有减缓奶牛热应激效应、促进奶牛乳腺上皮细胞增殖、促进乳成分合成的作用,提升了奶牛泌乳功能,与前人研究结果[20-23]基本一致。综上所述,奶牛饲粮中添加适量的蒲公英水提物可改善奶牛热应激状态,增强奶牛产奶性能。
3.2 蒲公英水提物对热应激条件下奶牛抗氧化能力的影响
当奶牛机体健康时,体内抗氧化系统处于动态平衡状态,但随着奶牛受到热应激效应影响时,体内抗氧化系统酶活性会逐渐降低,自由基逐渐积累,并引起脂质过氧化反应,间接加速机体细胞功能的损伤。SOD、CAT、GSH-Px、T-AOC是奶牛机体细胞内清除自由基的内源性抗氧化酶,能够清除体内超氧自由基(·O2-)和脂质过氧化产物MDA[26],同时,MDA含量能够准确地反映出机体脂质过氧化的程度,并间接反映细胞膜脂质双分子层受·O2-破坏程度,MDA含量越低,机体的抗氧化能力越强,对机体热应激的缓解作用越强。研究表明[27],植物提取物中酚酸类化合物对SOD、CAT、GSH-Px、T-AOC等内源性抗氧化酶的活性具有增强效果。Liu等[28]研究发现,植物单宁可降低牛乳中SCC和MDA含量,抑制奶牛血浆和肝脏的脂质过氧化;在断奶仔猪饲粮中添加银杏叶提取物可显著增强断奶仔猪血清SOD、CAT、GSH-Px等抗氧化酶活性[29];植物提取物菊苣酸显著提高了牦牛血清SOD、GSH-Px等抗氧化酶活性,并显著降低了血清MDA含量[30];植物多糖类物质可以显著提高肉仔鸡血清T-AOC、SOD等抗氧化酶活性,且降低血清MDA含量[4]。
在本试验中,与DZ组相比,DWE50组、DWE70组奶牛血清GSH-Px活性及T-AOC均显著升高,血清MDA含量均显著降低,说明蒲公英水提物具有提高热应激条件下泌乳期奶牛机体抗氧化能力的作用。根据现有研究推测,这可能是由于蒲公英水提物中所含的大量酚酸类化合物等活性成分激活了泌乳期奶牛内源性抗氧化系统,增强奶牛机体抗氧酶的表达能力,进而防御机体因热应激所导致过氧化反应而产生的自由基,并及时将自由基清除,从而提高奶牛的抗氧化能力,减轻泌乳期奶牛机体内的氧化应激与热应激效应。
3.3 蒲公英水提物对热应激条件下奶牛免疫功能的影响
免疫是指机体识别自我和非我物质,通过产生免疫应答清除非我物质,维持自身生理平衡和稳定的过程。热应激使外界环境温度超过奶牛自身等热区上限时,便会抑制巨噬细胞的活化,阻碍淋巴细胞分裂和分化,导致淋巴细胞数量减少,抑制细胞免疫和体液免疫,影响自身的免疫功能[31]。因此,如何提高机体免疫力,成为泌乳期奶牛机体健康的关键。由于血清的组成成分和组织间液较为相近,因此血清生化指标可以较为准确地反映出机体内环境的变化,并在一定程度上反映动物机体的代谢情况和健康情况[32]。血清中TP由ALB和GLB组成,参与血液中营养物质的运输和保持组织蛋白的动态平衡,维持血浆渗透压,在一定程度上反映机体营养代谢水平、肝脏功能以及免疫功能状况,血清ALB含量的提升有助于提高机体免疫力[33]。本试验中,与DZ组相比,DWE50组、DWE70组的血清TP、ALB、GLB含量均有不同程度的增加,且DWE70组的血清GLB含量显著增加。
另有研究表明,中草药及提取物中的活性成分可促进奶牛胸腺、脾脏等免疫器官发育[34],维持机体体液和细胞免疫状态平衡[35]。B淋巴细胞作为体液免疫的重要活性细胞,在奶牛抵抗热应激过程中产生特异抗体,发挥体液免疫功能[35],当B淋巴细胞受到特定抗原刺激后,便会产生免疫球蛋白,如IgA、IgM、IgG等,其中,IgA有抑制黏附、调理吞噬等作用,占血清免疫球蛋白总量的10%~15%[24];IgM作为体液免疫应答时最先产生的免疫球蛋白,有溶菌、溶血等作用,在机体免疫防护早期不可被替代[27];IgG有抗菌、抗病毒等作用,参与机体体液抗感染免疫过程[36]。因此,IgA、IgM、IgG常被用来判断动物体液免疫功能的强弱。本试验中,与DZ组相比,DWE50组、DWE70组的血清IgA、IgM、IgG含量均有不同程度的增加,且DWE50组的血清IgG含量显著增加。当奶牛饲粮中补饲瘤胃蛋氨酸和肉桂醛时,血清TP、ALB含量得到显著提升[37];枸杞多糖可显著增加泌乳期奶牛血清IgA含量,极显著增加血清IgM、IgG含量[38]。由此可见,富含多糖类化合物、酚酸类化合物等多种活性成分的蒲公英水提物可刺激泌乳期奶牛B淋巴细胞的增殖,增加其血清抗体水平,提高细胞免疫和体液免疫水平,从而增强奶牛机体免疫功能,减缓热应激效应。
3.4 蒲公英水提物对热应激条件下奶牛乳中SCC的影响
乳中SCC指每毫升原乳中的细胞总数,包含巨噬细胞、淋巴细胞、多形核嗜中性白细胞以及少量乳腺组织上皮细胞等,乳中SCC在20万个/mL以内时,通常认为奶牛处于健康状态。当泌乳期奶牛处于热应激时,机体抗氧化能力和免疫功能便会随着热应激时间的延长而降低,乳腺组织极易被金黄色葡萄球菌、无乳链球菌等病原菌入侵感染,增强乳腺血管通透性,使血液中的白细胞进入乳中,导致乳中SCC升高,产生大量的炎性因子,进而引起炎症反应,最终破坏牛乳营养成分。因此,乳中SCC是牛乳分级的重要依据之一[39]。
研究证实,蒲公英水提物中含有黄酮类化合物、酚酸类化合物等多种活性成分,具有增强机体免疫力及广谱的抑菌作用,对预防奶牛乳房炎的发生及降低牛乳中SCC具有不可比拟的作用。韩映梅等[40]采用蒲公英、黄芪、杜仲、当归等多种中药组方形式治疗患乳房炎的奶牛,使乳中SCC得到显著降低;祝海啸等[41]用以蒲公英为主要原材料的“公英散”中药制剂灌服21头乳房炎病牛,乳中SCC显著降低,且乳房炎治愈率高达90.47%。本试验中,饲喂蒲公英水提物后,乳中SCC均下降,且下降趋势明显,而DZ组乳中SCC趋于平稳且仍有升高趋势,因此,本试验结果表明,饲粮中添加蒲公英水提物可以降低奶牛乳中SCC,对预防因热应激而引发的奶牛乳房炎的发生具有积极作用,进一步证实了前人的试验结果。
3.5 蒲公英水提物对热应激条件下奶牛粪便微生物多样性的影响
肠道微生物是肠道内环境的重要组成部分,各种微生物之间相互作用,处于动态平衡状态,共同维持机体的肠道健康。研究发现,热应激可打破肠道微生物动态平衡状态,抑制肠道微生物活动和内摄作用[31]。本试验为了探究蒲公英水提物是否影响热应激条件下奶牛粪便微生物多样性的变化,对饲粮中添加不同水平蒲公英水提物的奶牛粪便微生物生物多样性进行了分析,Venn图显示,DWE50组、DWE70组总的OTUs数量及独有OTUs数量均多于DZ组。α多样性指数分析结果表明,DWE70组奶牛粪便微生物的ACE指数、Chao1指数与DZ组之间具有显著差异,Simpson指数、Shannon指数不具有显著差异。ACE指数和Chao1指数反映微生物群落的丰富度,Simpson指数和Shannon指数反映微生物的多样性[42]。由此推断,当蒲公英水提物的添加水平为70 g/(头·d)时,奶牛粪便中微生物物种数量增多,与DWE70组独有的OTUs数量多于DZ组、DWE50组的研究结果一致。β多样性指数分析结果表明,3组奶牛粪便微生物样点相对分散,可以明显区分并聚成3个类群,说明粪便微生物群落结构差异明显。
本试验通过LEfSe法分析粪便微生物组间差异性。当LDA值>4.0,与DZ组、DWE50组相比,DWE70组具有显著差异的物种更多,主要为梭状芽孢杆菌纲、梭状芽孢杆菌目、厚壁菌门、未培养的拟杆菌目等。在门水平上,3组奶牛粪便中微生物优势菌门均为拟杆菌门和厚壁菌门,与其他反刍动物后肠道和粪便微生物的研究结果[43-44]一致。厚壁菌门促进碳水化合物分解,并加快机体代谢,拟杆菌门主要降解食物中纤维素成分,将纤维素转化为更容易吸收的糖类物质,进而增强奶牛对饲料中营养物质的吸收,促进奶牛产奶性能的提升[45]。在本试验中,DWE50组、DWE70组奶牛的产奶量在第14、21、28天时显著高于DZ组,进一步证实现有的研究结论。由此可以推断,当奶牛饲粮中添加蒲公英水提物后,后肠道微生态环境受到显著影响,但其优势菌门种类并未改变,表明奶牛肠道中优势菌群在门水平上受饲粮因素影响较小。在属水平上,DWE50组、DWE70组最大的优势菌属为理研菌科RC9肠道群,该菌属可将肠道中的膳食纤维进行分解和发酵,产生乙酸、丙酸、丁酸及其他短链脂肪酸。有研究指出,肠道微生物发酵产生的短链脂肪酸可为肠道上皮细胞的正常代谢活动提供能量,保护肠道完整性,调节机体的免疫力,改善宿主健康[46-48]。当饲粮中添加蒲公英水提物后,奶牛血清IgA、IgM、IgG含量均有增加,说明本试验条件下奶牛的机体免功能得到增强。产生该结果可能是因为蒲公英水提物含有大量酚酸类、黄酮类等化合物,可提高奶牛后肠道中理研菌科RC9肠道群的相对丰度,加强肠道微生物自身的代谢能力,产生大量短链脂肪酸,进而增强奶牛机体免疫功能。
4 结 论
饲粮中添加蒲公英水提物可提高奶牛产奶量、乳蛋白率、乳脂率,降低乳中SCC,增加奶牛粪便微生物多样性及相对丰度,正向调节机体抗氧化能力和免疫功能。
