白术多糖对脂多糖处理下雏鹅十二指肠肠道屏障功能的调节作用
2024-03-05陈枭枭杨舒展陈浩祥马元艺陈丹丹李冰心李婉雁许丹宁田允波黄运茂
陈枭枭 杨舒展 陈浩祥 马元艺 陈丹丹 李冰心 李婉雁 许丹宁 田允波 黄运茂 曹 楠*
(1.仲恺农业工程学院动物科技学院,广州 510225;2. 广州海关技术中心,广州 510623)
脂多糖(LPS)是革兰氏阴性菌细胞壁的主要成分,在细菌黏附在其他细胞或裂解时释放内毒素,可严重损害鸟类和哺乳动物的正常生理活动,降低免疫力甚至死亡[1]。养殖密度大,被粪便严重污染的洗浴池得不到及时清理和饲粮变质等原因累积大量LPS,导致肉鹅生活在富含外源性LPS的环境中,容易遭受外源性LPS的侵袭,出现严重的消化道症状,肠道屏障发生严重的损伤,影响其生产性能和经济效益[2]。
十二指肠是食物消化和营养吸收的关键部位,同时十二指肠通过释放激素和神经调节胃肠道的运动和蠕动,以促进食物的顺利通过,并维持正常的胃肠道功能[3]。除此之外,十二指肠的肠道上皮细胞、细胞间的连接、黏液层、免疫细胞及其分泌产物和肠道菌群组成肠黏膜屏障,屏障将肠道环境和机体内部环境分离,在维持肠道免疫平衡,维持机体内环境稳态中发挥着重要的作用[4-5]。有文献报道,LPS会导致雏鸡小肠黏膜明显受损,肠上皮细胞完整性丧失,小肠中的闭合蛋白(Occludin)、紧密连接蛋白-1(Claudin-1)、闭锁小带蛋白-1 (ZO-1)表达显著下调[6],血清D-乳酸含量增加,血清二胺氧化酶(DAO)活性明显增强[7],对家禽肠道机械屏障造成了损害;LPS使家禽十二指肠、空肠、回肠的杯状细胞数量明显减少[8],显著减少黄羽肉鸡空肠中黏蛋白-2(MUC-2)的表达[9],破坏家禽肠道的化学屏障。也有文献报道,LPS促进了肉鸭回肠黏膜中炎症相关因子Toll样受体4(TLR4)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、白细胞介素-4(IL-4)、白细胞介素-17A(IL-17A)、白细胞介素-1β(IL-1β)的表达[10],破坏肠道免疫平衡。
已经有文献证明了植物多糖对畜禽肠道屏障的影响,黄芪多糖能够促进罗斯308雏鸡空肠中Claudin-1、紧密连接蛋白-3(Claudin-3)、ZO-1、Occludin的表达,增加小肠绒毛高度和绒隐比,并减少雏鸡血清中D-乳酸含量[11],降低肉鸡血清中的DAO活性[12],保护肠道机械屏障;黄芪多糖能够增加罗斯308雏鸡小肠中杯状细胞的数量[11];黄芪多糖和甘草多糖能显著促进肉鸡小肠中MUC-2的表达[12],保护肠道化学屏障;泰山马尾松花多糖都能够增加雏鸡血液中免疫球蛋白G(IgG)和肠黏膜中分泌型免疫球蛋白A(sIgA)的含量,促进肠道中白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、γ-干扰素(IFN-γ)的分泌,促进了补体因子1(BF1)、补体因子2(BF2)、β-淀粉样蛋白(BLA)、β-淀粉样蛋白1(BLA1)、β-淀粉样蛋白2(BLA2)基因的表达,还能促进CD4阳性T细胞(CD4+T)、CD8阳性T细胞(CD8+T)的转化率,从而激活了雏鸡肠道黏膜的免疫系统[13]。白术多糖(PAMK)是中药白术的主要生物活性成分,具有调理脾虚、理气和胃、增强胃肠功能的作用[14]。目前已有文献证明,PAMK能够有效缓解外源性LPS对雏鹅造成的肝脏、脾脏、法氏囊和胸腺这些免疫器官的免疫抑制和炎性损伤。PAMK能通过铁死亡相关通路减少LPS引起的雏鹅氧化应激,降低脾脏组织的铁含量和铁死亡程度[15];还能通过TLR4信号通路缓解LPS诱导的雏鹅法氏囊损伤[16];同时能通过线粒体和死亡受体途径缓解LPS引起的胸腺细胞凋亡,减少胸腺组织的炎症反应和氧化应激[17];通过微小RNA-223(miR-223)/NOD样受体热蛋白结构域相关蛋白3(NLRP3)轴减少LPS处理下雏鹅肝脏组织、肝脏细胞的炎性损伤[18]。然而尚未知晓PAMK能否保护和修复LPS造成的十二指肠肠道损伤。因此,本试验以雏鹅为研究对象,探讨PAMK对LPS造成的十二指肠肠道屏障损伤的缓解作用,为雏鹅容易遭受外源性LPS侵袭的难题寻求有效的解决方法,也为PAMK作为饲粮添加剂的开发提供一个理论依据。
1 材料与方法
1.1 试验动物
试验动物为240只健康的1日龄马岗鹅雏鹅,购自清远市金羽丰鹅业有限公司。在仲恺农业工程学院钟村教学科研基地中进行养殖试验。试验前1周对鹅舍进行严格的清洗消毒,试验鹅可自由采食、饮水、活动,舍内保持适宜温度、湿度及通风,保持鹅舍内的卫生。全程饲养流程、免疫程序及环境控制标准均按照广东省地方标准《马岗鹅肉鹅饲养管理技术规范》(DB44/T 1595—2015)进行。
1.2 试验材料
PAMK购西安某园生物制剂厂,纯度≥95%;PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒购于宝生物工程(大连)有限公司;qPCR预混液购于康润诚业生物科技有限公司;Western及IP细胞裂解液购于Beyotime公司;β-肌动蛋白(β-actin) antibody购于美国Proteintech Group公司;TLR4 antibody、髓样分化因子88(MyD88) antibody、磷酸化核因子-κB(p-NF-κB-p65) antibody、TNF-α antibody、IL-6 antibody、NLRP3 antibody、Caspase-1 antibody购于万类生物科技有限公司;Trizol购于美国Ambion公司;DAO比色法试剂盒、D-乳酸比色法试剂盒购于武汉伊莱瑞特生物科技股份有限公司。
1.3 试验设计及样品采集
240只健康的、精神状态良好的1日龄马岗鹅雏鹅(公母各占1/2)随机分成4组,每组6个重复,每个重复10只雏鹅,各重复之间体重差异不显著(P>0.05)。对照组和LPS组饲喂基础饲粮,PAMK组和PAMK+LPS组饲喂含有400 mg/kg PAMK的基础饲粮[18]。在21日龄时,给LPS组和PAMK+LPS组的雏鹅腹腔注射5 mg/kg BW LPS,对照组和PAMK组腹腔注射1 mL/kg BW生理盐水[18]。
于21日龄注射LPS或生理盐水后的第12个小时,将雏鹅宰杀取样。从心脏中采集血液样品,于37 ℃放置30 min,3 000 r/min离心后收集上清液,保存于-80 ℃冰箱。随后宰杀取样,切取十二指肠1.5 cm的中部肠段,保存于10%中性福尔马林固定液中;再切取同样长度的十二指肠冲洗肠道内容物后置于液氮中保存,随后保存于-80 ℃冰箱。
1.4 指标测定
1.4.1 雏鹅肠道绒毛高度、隐窝深度、绒隐比和杯状细胞数量的检测
取试验鹅十二指肠中间的1.5 cm肠段,放置于10%中性福尔马林固定液中,随后组织脱水、透明、浸钠、包埋、切片、烤片、切片脱钠,用PAS染色法处理切片,在光学显微镜下观察肠道组织形态,统计杯状细胞数量,绒毛高度和隐窝深度通过明美显微数码测量分析系统进行测量。
1.4.2 雏鹅血清D-乳酸含量和DAO活性的检测
严格按照说明书的步骤,通过D-乳酸比色法测试盒和DAO比色法测试盒分别检测血清D-乳酸含量和DAO活性。
1.4.3 雏鹅十二指肠肠道紧密连接蛋白、黏附连接蛋白、黏蛋白、炎性细胞因子和炎症通路相关基因的检测
用Trizol法提取十二指肠的总RNA。用超微量分光光度计在260和280 nm处检测RNA的纯度和浓度,并通过1.5%琼脂糖凝胶电泳检测RNA的完整性。用TaKaRa反转录试剂盒,按照说明书对RNA进行反转录。用Gen Star qPCR预混液和7500实时荧光定量PCR仪进行荧光定量。总反应体系为20 μL:2× RealStar Fast SYBR gPCR Mix 10 μL,上、下游引物各0.5 μL,ddH2O 8 μL,cDNA模板 1 μL。反应条件设定:50 ℃ 预变性2 min,95 ℃ 10 min,1个循环;95 ℃ 15 s,60 ℃退火1 min,40个循环。本试验以β-肌动蛋白(β-actin)作为内参基因,用2-ΔΔCt法计算Occludin、ZO-1、闭锁小带蛋白-2(ZO-2)、E-钙黏蛋白(E-cadherin)、α-连环蛋白(α-catenin)、β-连环蛋白(β-catenin)、连接黏附分子(JAM)、肌球蛋白轻链激酶(MLCK)基因相对表达量。通过NCBI自行设计荧光定量的引物序列,并由生工生物工程技术服务有限公司合成相关基因的引物,引物序列见表1。
1.4.4 雏鹅肠道炎性细胞因子和炎症通路相关蛋白的检测
以β-actin为内参蛋白,采用蛋白质免疫印迹(Western-bolt)方法检测肠道炎症通路相关蛋白(TLR4、MyD88、NF-κB、NLRP3、Caspase-1)和炎性细胞因子(TNF-α、IL-6)的蛋白表达水平。提取十二指肠的细胞蛋白,用BCA法测定总蛋白浓度,加入聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液后进行加热变性,蛋白上样量50 g,上层胶恒压80 V电泳20 min,浓缩胶恒压120 V电泳60 min。电泳结束后将蛋白转至聚偏氟乙烯膜(PVDF),用5%脱脂牛奶室温封闭1 h。一抗4 ℃孵育过夜,磷酸缓冲液-0.1%吐温洗涤缓冲液(PBST)洗3次,每次10 min。二抗室温孵育1 h,PBST洗5次,每次3 min。增强化学发光(ECL)试剂盒显色,将膜置于化学发光仪中进行曝光,拍照并保存。采用Image J软件对蛋白条带进行灰度值分析。
1.5 数据处理与统计分析
数据采用SPSS 26.0软件进行单因素方差分析,随后用Tukey法进行多重比较。数据以平均值和均值标准差表示。GraphPad Prism 5.0被用来将数据可视化。P<0.05代表统计分析差异有显著性。
2 结 果
2.1 PAMK对LPS处理下雏鹅肠道机械屏障的影响
2.1.1 PAMK对LPS处理下雏鹅十二指肠组织形态学的影响
如图1所示,与对照组相比,PAMK组和PAMK+LPS组雏鹅十二指肠绒毛长度、隐窝深度、绒隐比没有显著差异(P>0.05);LPS组雏鹅十二指肠绒毛长度显著减小(P<0.05),隐窝深度显著增大(P<0.05),绒隐比显著变小(P<0.05)。与LPS组相比,PAMK+LPS组雏鹅十二指肠中绒毛长度和绒隐比显著增大(P<0.05),隐窝深度显著变小(P<0.05)。
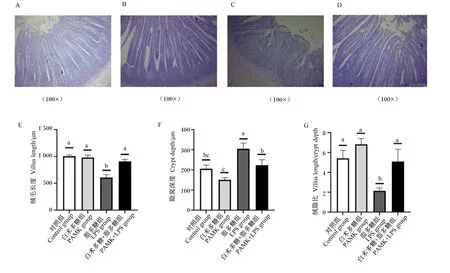
A~D分别表示对照组、PAMK组、LPS组、PAMK+LPS组的十二指肠PAS染色结果;E~G中数据柱标注相同字母或者无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。
2.1.2 PAMK对LPS处理下十二指肠紧密连接蛋白相关基因表达的影响
如图2所示,与对照组相比,PAMK组雏鹅十二指肠中Occludin、ZO-1、ZO-2、E-cadherin、α-catenin、β-catenin、JAM、MLCK的基因相对表达量无显著差异(P>0.05);LPS组雏鹅十二指肠中β-catenin、JAM的基因相对表达量显著下调(P<0.05),雏鹅十二指肠中Occludin、ZO-1、ZO-2、E-cadherin、α-catenin、MLCK的基因相对表达量无显著变化(P>0.05)。

图2 PAMK对LPS处理下雏鹅十二指肠紧密连接蛋白相关基因表达的影响
与LPS组相比,PAMK+LPS组雏鹅十二指肠中Occludin、β-catenin、JAM的基因相对表达量显著上调(P<0.05),但是ZO-1、ZO-2、α-catenin、MLCK的基因相对表达量无显著差异(P>0.05)。
2.1.3 PAMK对LPS处理下雏鹅血清D-乳酸含量、DAO活性的影响
如图3所示,与对照组相比,PAMK组雏鹅血清中D-乳酸含量和DAO活性无显著变化(P>0.05);LPS组雏鹅血清中DAO活性显著上调(P<0.05)。与LPS组相比,PAMK+LPS组雏鹅血清中D-乳酸含量显著下调(P<0.05)。

图3 PAMK对LPS处理下雏鹅血清DAO活性和D-乳酸含量的影响
2.2 PAMK对LPS处理下十二指肠化学屏障相关指标的影响
由图1-A~图1-D和图4-A所示,与对照组相比,PAMK组雏鹅十二指肠中杯状细胞数量无显著变化(P>0.05);LPS组雏鹅十二指肠中杯状细胞数量则显著减少(P<0.05),PAMK+LPS组雏鹅十二指肠中杯状细胞数量无显著变化(P>0.05)。与LPS组相比,PAMK+LPS组雏鹅十二指肠中杯状细胞数量显著增加(P<0.05)。
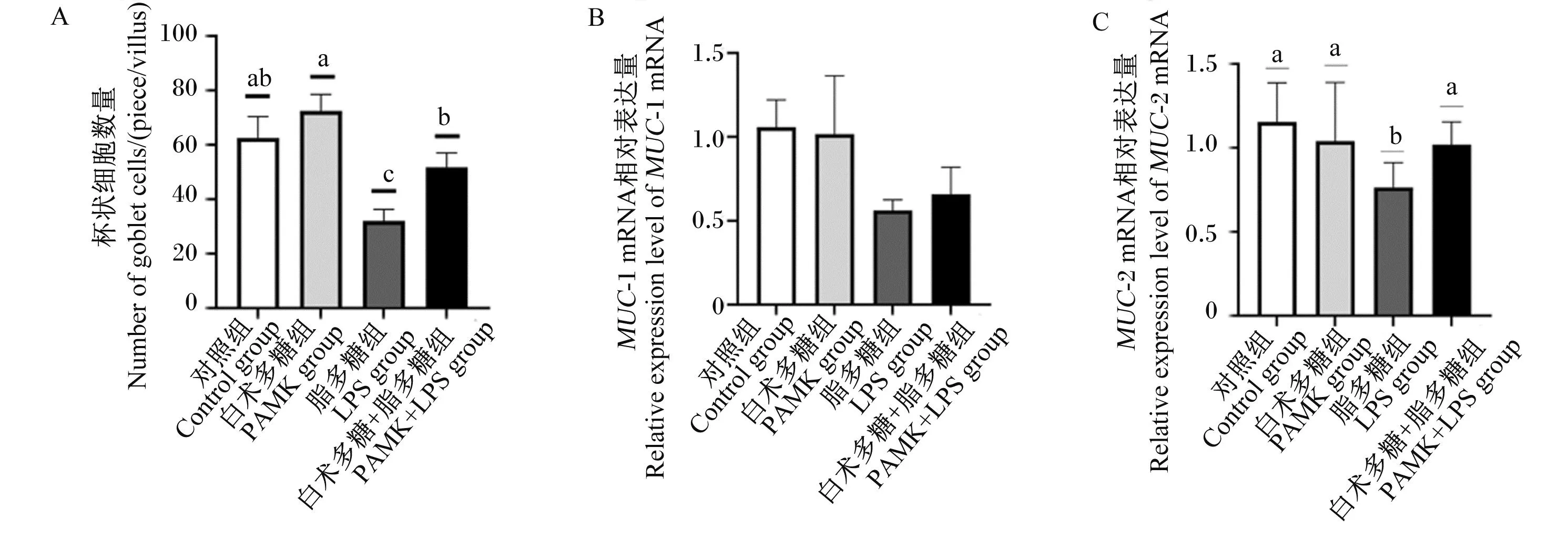
图4 PAMK对LPS处理下雏鹅十二指肠杯状细胞数量和化学屏障相关基因表达的影响
由图4-B~图4-C所示,与对照组相比,PAMK组雏鹅十二指肠中MUC-1和MUC-2的基因相对表达量无显著变化(P>0.05);LPS组雏鹅十二指肠中MUC-2的基因相对表达量显著减少(P<0.05),MUC-1的基因相对表达量没有显著差异(P>0.05)。与LPS组相比,PAMK+LPS组雏鹅十二指肠中MUC-2的基因相对表达量显著上调(P<0.05),MUC-1的基因相对表达量没有显著差异(P>0.05)。
2.3 PAMK对LPS处理下雏鹅肠道免疫屏障的影响
2.3.1 PAMK对LPS处理下十二指肠炎性细胞因子相关基因和蛋白表达的影响
如图5-A~图5-B所示,与对照组相比,LPS组雏鹅十二指肠中TNF-α、IL-6的基因相对表达量显著上调(P<0.05);PAMK+LPS组雏鹅十二指肠中TNF-α、IL-6的基因相对表达量显著下调(P<0.05)。与LPS组相比,PAMK+LPS组雏鹅十二指肠中TNF-α、IL-6的基因相对表达量显著下调(P<0.05)。
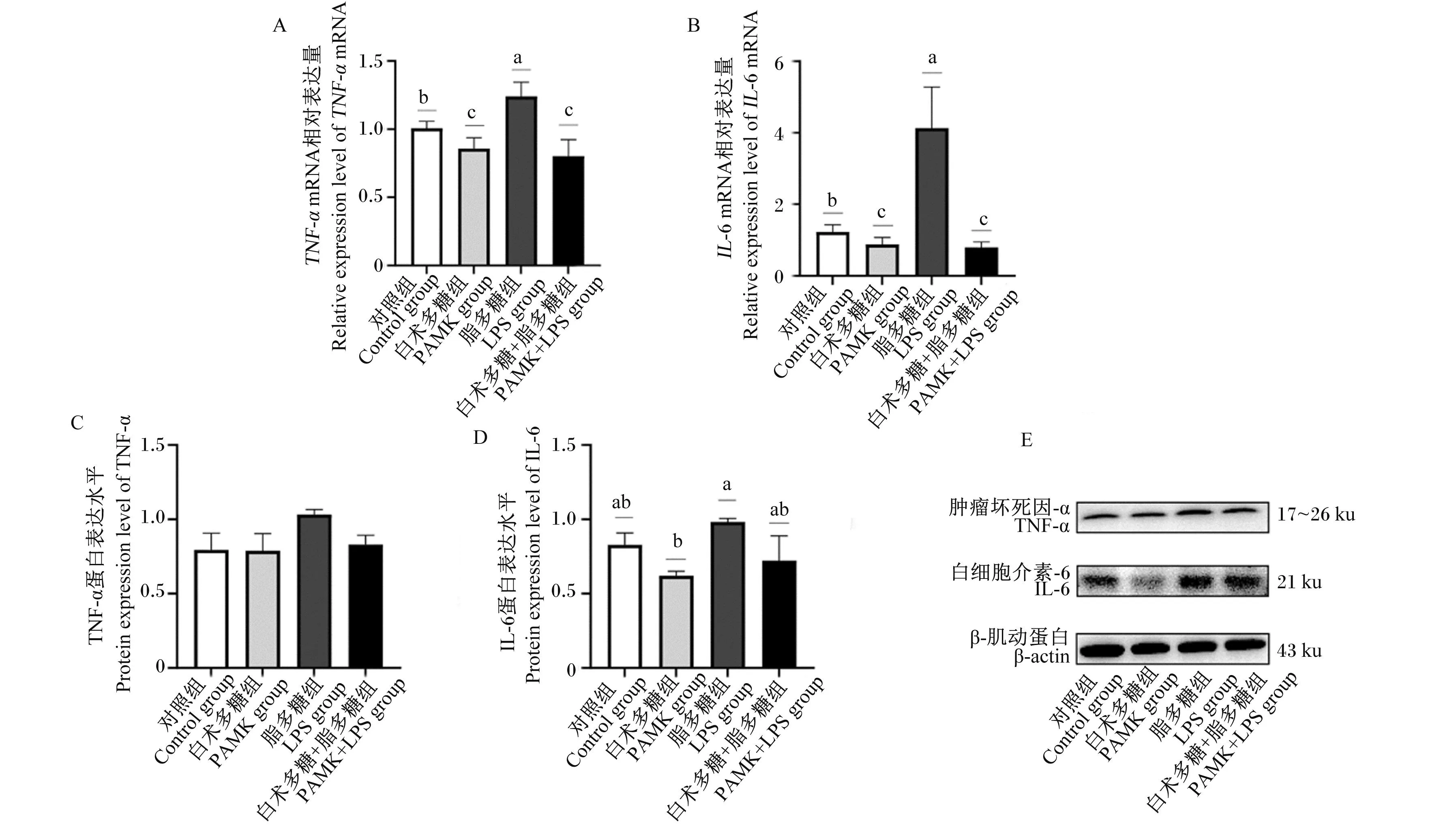
图5 PAMK对LPS处理下雏鹅十二指肠炎性细胞因子基因和蛋白表达的影响
如图5-C~图5-E所示,与对照组相比,PAMK组雏鹅十二指肠中TNF-α、IL-6的蛋白表达水平没有显著变化(P>0.05);LPS组雏鹅十二指肠中IL-6、TNF-α的蛋白表达水平在统计学上没有显著性差异(P>0.05);PAMK+LPS组雏鹅十二指肠中TNF-α、IL-6的蛋白表达水平无显著变化(P>0.05)。与LPS组相比,PAMK+LPS组雏鹅十二指肠中TNF-α、IL-6的蛋白表达水平在统计学上没有显著性差异(P>0.05)。
2.3.2 PAMK对LPS处理下十二指肠炎性信号通路关键基因表达的影响
由图6所示,与对照组相比,PAMK组雏鹅十二指肠中TLR4、MyD88、NF-κB、NLRP3、Caspase-1的基因相对表达量没有显著变化(P>0.05);而LPS组雏鹅十二指肠中TLR4、NLRP3、Caspase-1的基因相对表达量显著上调(P<0.05);PAMK+LPS组雏鹅十二指肠中TLR4、MyD88、NF-κB、NLRP3、Caspase-1的基因相对表达量无显著差异(P>0.05)。
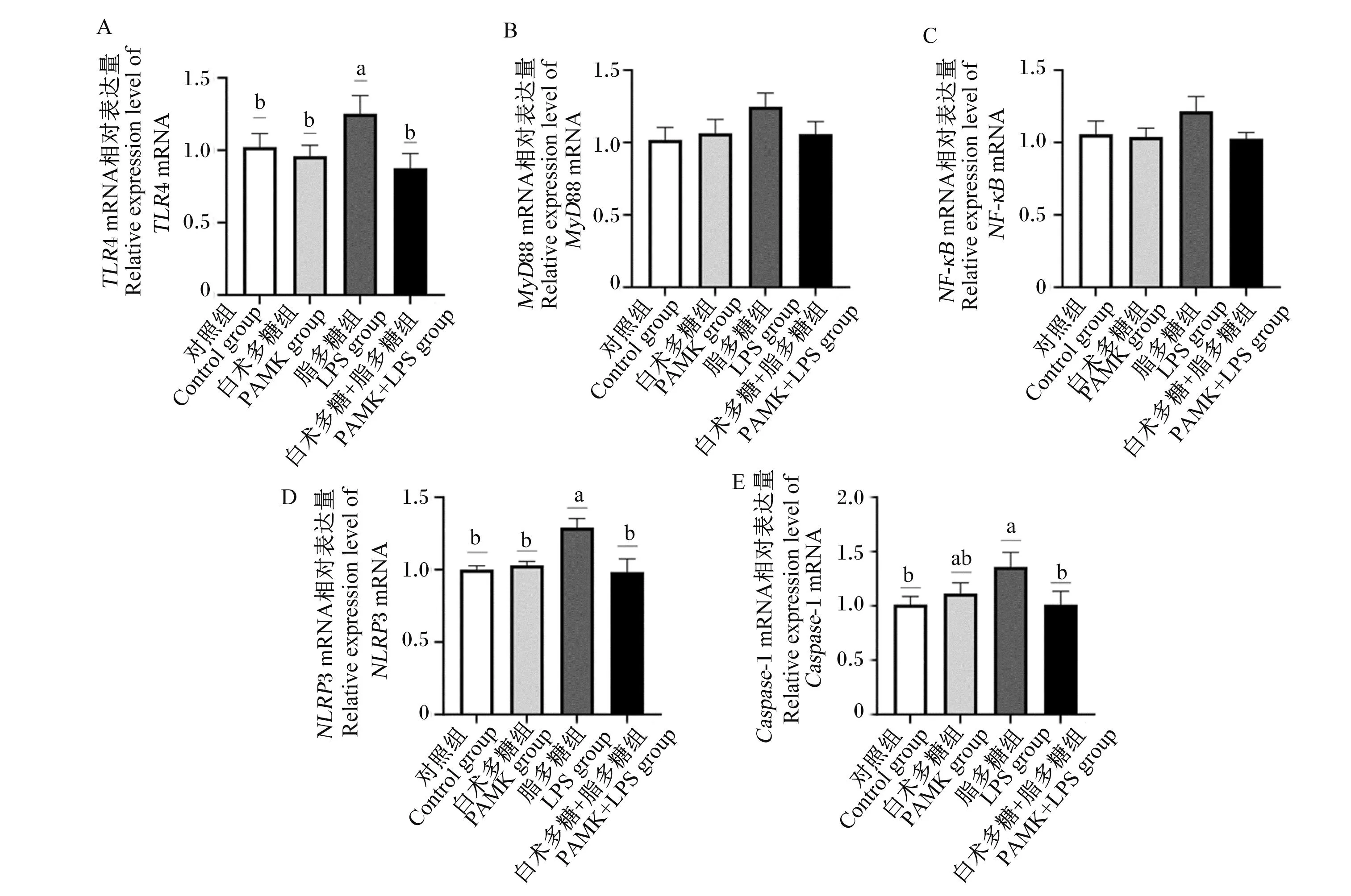
图6 PAMK对LPS处理下雏鹅十二指肠炎性信号通路关键基因表达的影响
与LPS组相比,PAMK+LPS组雏鹅十二指肠中TLR4、NLRP3、Caspase-1的基因相对表达量显著下调(P<0.05),但是MyD88、NF-κB的基因相对表达量在统计学上没有显著差异(P>0.05)。
2.3.3 PAMK对LPS处理下十二指肠炎性信号通路关键蛋白表达的影响
由图7所示,与对照组相比,PAMK组雏鹅十二指肠中TLR4、MyD88、NF-κB、NLRP3、Caspase-1的蛋白表达水平没有显著差异(P>0.05);而LPS组雏鹅十二指肠中MyD88、Caspase-1的蛋白表达水平显著上调(P<0.05)。与LPS组相比,PAMK+LPS组雏鹅十二指肠中MyD88、Caspase-1的蛋白表达水平显著下调(P<0.05)。
3 讨 论
十二指肠连接着幽门,承接来自胃内经过初步消化的食糜并将其进一步消化。因此,针对十二指肠的研究大多集中于消化过程。然而,十二指肠除了是消化器官外,其肠黏膜具有多种防御机制,可保护自身免受氧化应激引起的损伤、幽门螺杆菌引起的感染诱发损伤、缺血和再灌注损伤以及药物诱导损伤[19]。此外,十二指肠黏膜的固有层容纳了大量免疫系统的移居细胞和常驻细胞,如嗜酸性粒细胞、中性粒细胞、肥大细胞和巨噬细胞等[20-21]。病原感染或者生物毒素的侵入除了能够导致十二指肠消化功能失常,还可能会引起十二指肠肠道屏障损伤。因此,保护十二指肠肠道屏障对于维持正常的胃肠道功能和肠道的免疫平衡是至关重要的。
3.1 PAMK对LPS处理下雏鹅肠道机械屏障的影响
肠道形态是评估肠道屏障完整性、肠道健康和肠道消化吸收能力的重要指标,指标包括:绒毛长度、隐窝深度和绒隐比[22]。Wang等[23]用LPS处理小鼠后,回肠、空肠、十二指肠的绒毛高度分别是正常小鼠的33.44%、40.57%和34.98%,回肠、空肠、十二指肠的绒隐比分别是正常小鼠的47.02%、59.34%、49.42%。Xie等[24]为北京鸭腹腔注射LPS,破坏了鸭空肠的形态结构,降低了鸭空肠的绒毛高度、绒隐比,增加了隐窝深度。本试验同样发现LPS对雏鹅肠道形态有损伤作用。与对照组相比,LPS处理下雏鹅十二指肠绒毛高度显著降低,隐窝深度显著升高,绒隐比显著降低。提示LPS可以破坏雏鹅正常的十二指肠肠道形态,这将会影响肠道对营养物质的消化吸收水平,降低其生长性能。通过在饲粮中添加PAMK可以修复LPS处理下的雏鹅病变肠道形态,增加十二指肠绒毛高度,减小隐窝深度,增大绒隐比,提示PAMK能维持LPS处理下雏鹅肠道绒毛的正常形态结构。
肠道黏膜屏障不仅可以调节水、离子、溶质的载体运输,还可以防止病原体、抗原和毒素进入肠道组织,在维持肠道环境平衡方面发挥着重要作用[25]。机械屏障是肠黏膜屏障的一个重要组成部分,而细胞之间紧密连接及其下面的黏附连接、桥粒在保持肠道机械屏障完整性方面发挥着重要作用,紧密连接蛋白和黏附连接蛋白水平的降低通常与上皮屏障功能障碍有关[26-27]。D-乳酸由肠道中的细菌发酵产生,DAO是存在于肠上皮细胞中的细胞内酶,完整的肠黏膜屏障可以阻止D-乳酸、DAO进入门静脉循环。但随着肠道屏障的破坏,它们可以经过上皮黏膜进入血液循环系统进而导致血浆中D-乳酸含量和DAO活性的增加,因此它们也成为了评估机械屏障功能的指标之一[28]。LPS不仅改变正常的肠道形态,还会破坏肠道机械屏障。LPS的处理会减少仔猪回肠中紧密连接蛋白Occludin、ZO-1的表达,增加仔猪血清中DAO活性[29];增加肉鸡血清中D-乳酸含量和DAO活性[30]。本试验用LPS处理雏鹅得到了相似的结果,雏鹅在LPS的刺激下,十二指肠紧密连接蛋白和黏附连接蛋白的基因表达有不同程度的减少,血清中D-乳酸含量增多,DAO活性增强,说明LPS破坏了雏鹅肠道上皮细胞间的连接,破坏了机械屏障,增加了肠道黏膜的通透性。雏鹅在PAMK的保护作用下,能够增加LPS处理下十二指肠中紧密连接蛋白和黏附连接蛋白的基因表达,减少血清中D-乳酸含量和DAO活性。这提示PAMK对雏鹅肠道的机械屏障功能有一定的保护和修复作用,减少肠道通透性,能有效帮助肠道阻挡外界病原、抗原等有害物质的入侵。
有文献报道,LPS的处理引起TLR4信号级联激活,粘着斑激酶(FAK)、MyD88、白细胞介素-1受体相关激酶4(IRAK4)的激活破坏了肠道屏障功能,增加了肠道通透性,而TLR4-/-和MyD88-/-小鼠在LPS刺激下并没有发生肠炎,肠道通透性也没有增加,说明TLR4/FAK/MyD88信号转导轴在调节LPS诱导的肠炎和肠道通透性增加中起着重要作用[31]。而本试验中PAMK能够抑制LPS处理下雏鹅十二指肠肠道TLR4/MyD88/NF-κB炎性信号通路的激活,这可能是PAMK能缓解LPS处理下雏鹅肠道机械屏障损伤的原因。
3.2 PAMK对LPS处理下雏鹅肠道化学屏障的影响
杯状细胞和黏液层对肠道防御和稳态有关键作用,黏蛋白是杯状细胞的主要分泌产物,负责形成黏液层,构建肠道化学屏障,为肠道微生物群提供黏附位点的同时,还能阻止病原体的入侵和定植,杯状细胞的异常分化和黏蛋白的合成分泌不足都能导致肠道化学屏障的功能障碍[32]。Lucke等[33]发现肉鸡在1 mg/kg LPS的攻击下减少了十二指肠中MUC-1、MUC-2的表达。LPS还能破坏肠道杯状细胞的功能,细胞质中出现大量肿胀的溶酶体,导致MUC-1、MUC-2水平明显下降[34]。在本试验中,LPS的攻击也会破坏雏鹅肠道化学屏障,十二指肠MUC-2的表达下调,十二指肠杯状细胞的数量也明显减少。这提示暴露于LPS会导致雏鹅肠道化学屏障的功能障碍。杨巨如[35]发现PAMK能够逆转由于失重导致的大鼠肠道黏膜屏障损伤,增加十二指肠和结肠中的杯状细胞数量。在本试验中同样发现PAMK能够逆转LPS处理下雏鹅十二指肠MUC-2表达减少的情况,并增加十二指肠中杯状细胞的数量,这提示PAMK在病理状态下能够维持雏鹅肠道化学屏障的结构和功能完整。
3.3 PAMK对LPS处理下雏鹅肠道免疫屏障的影响
LPS会被TLR4所识别、结合,通过依赖于MyD88或独立于MyD88的信号级联诱导丝裂原活化蛋白激酶(MAPK)和NF-κB的活化,NF-κB是普遍存在的可诱导转录因子,不仅可以促进炎性细胞因子(TNF-α、IL-6)的表达,还能诱导NLRP3炎症小体的组装,通过Caspase-1介导IL-18、IL-1β的成熟;LPS的刺激同样可以激活TLR2/NF-κB进而促进TNF-α、IL-6、IL-1β的产生,导致炎症反应的发生[36-37]。LPS不仅会影响家禽的生产性能,诱导家禽发生免疫应激,促进血清、脾脏中炎性细胞因子的产生[30],还会引起家禽肠道组织炎症反应的发生,激活肠道中TLR4信号通路,诱导NF-κB、IκBα的磷酸化,促进TNF-α、IL-6、IL-1β和IFN-γ的释放[38]。而肠道炎症与肠道功能屏障息息相关,肠炎往往导致会肠道黏膜屏障的破坏[39]。本试验发现,雏鹅在LPS刺激下,激活十二指肠中TLR4/MyD88/NF-κB和NLRP3-Caspase-1炎性信号通路,导致了十二指肠中炎性细胞因子TNF-α、IL-6的过度释放。炎性信号通路的激活和炎性细胞因子的释放提示LPS激活了肠道免疫屏障,导致了炎症反应,并可能因此发生了炎性损伤。而在PAMK的保护下,有效抑制雏鹅十二指肠TLR4/MyD88/NF-κB和NLRP3/Caspase-1炎性信号通路的激活,减少炎性细胞因子TNF-α、IL-6的过度释放,提示PAMK能够缓解由LPS激活的雏鹅肠道炎症反应,对雏鹅肠道免疫屏障的维持发挥着重要的作用。
4 结 论
外源性的LPS导致了雏鹅十二指肠的机械屏障、化学屏障和免疫屏障失常,而在饲粮中添加400 mg/kg PAMK后能够缓解LPS处理下导致的雏鹅十二指肠肠道屏障损伤。
