基于微生物和代谢组学研究葡萄籽原花青素对鹅肠道健康的影响
2024-03-05任继武乔君毅陈哲秀郝瑞荣
任继武 邓 超 乔君毅 陈哲秀 郝瑞荣*
(1.山西农业大学经济作物研究所,太原 030031;2.山西农业大学动物科学学院,太谷 030801)
在现代化大规模、高密度圈养条件下,鹅群应激增加,导致肠道组织形态改变、有害菌增殖、消化能力下降、饲料利用率降低、抵抗力下降以及炎症等胃肠道疾病频发。肠道是抵御感染的第1道防线,是动物免疫系统的关键组成部分,也是微生物定植的重要场所,肠道菌群对调节肠道免疫至关重要。鹅的胃肠道菌群和肠道生理紊乱可能引起免疫反应失调,引发疾病[1]。既往研究表明,肠道菌群失调不仅引起肠道疾病,还会通过增加肠-肾轴中肠源性脂多糖的渗漏,引发鹅的肾损伤和痛风[2]。胃肠道微生物及其代谢产物在鹅肠-肾轴的免疫激活中起着至关重要的作用[3]。因此,调节和维持肠道菌群平衡和内环境稳态可能是减少疾病发生、实现鹅健康养殖的有效措施。
葡萄籽原花青素(grape seed procyanidins,GSPs)是天然多酚类化合物,超强的抗氧化和调节肠道菌群功能使其在保健品领域备受青睐。近年来,其在饲料添加剂领域也引起了重视。已有研究表明,GSPs能够调节动物肠道菌群,改善内环境稳态[4-5]。本课题组前期针对饲粮添加GSPs对仔猪及生长猪肠道菌群的影响进行了研究,表明GSPs对肠道菌群丰度、多样性以及菌群组成均有改善作用[6-8]。本课题组前期对鹅的研究还表明,饲粮添加GSPs对鹅生长性能没有显著影响[9],但对肠道抗氧化的提升作用毋庸置疑[10]。在前期研究基础上,本试验拟进一步基于细菌基因组和代谢组学方法,探讨饲粮添加GSPs对鹅盲肠菌群、代谢物及组织形态的影响。
1 材料与方法
1.1 试验设计
选取35日龄健康且体重相近的四川白鹅144只,随机分为4个组,每组6个重复,每个重复6只鹅。对照组饲喂基础饲粮;3个GSPs添加组分别在基础饲粮中添加50、100和150 mg/kg GSPs。预试期7 d,正试期21 d。
试验在山西农业大学经济作物研究所进行,动物试验由山西农业大学实验动物伦理委员会审核通过(许可证号:SXAU-EAW-2021G0305001)。试验所用GSPs纯度为95%,含79.28%的低聚原花青素。基础饲粮参照NRC(1994)鹅的营养需要配制,其组成及营养水平见表1。饲粮中粗蛋白质、钙和粗纤维含量分别参照GB/T 6432—2018、GB/T 6436—2018和GB/T 6434—2006方法测定。饲粮营养水平计算公式如下:
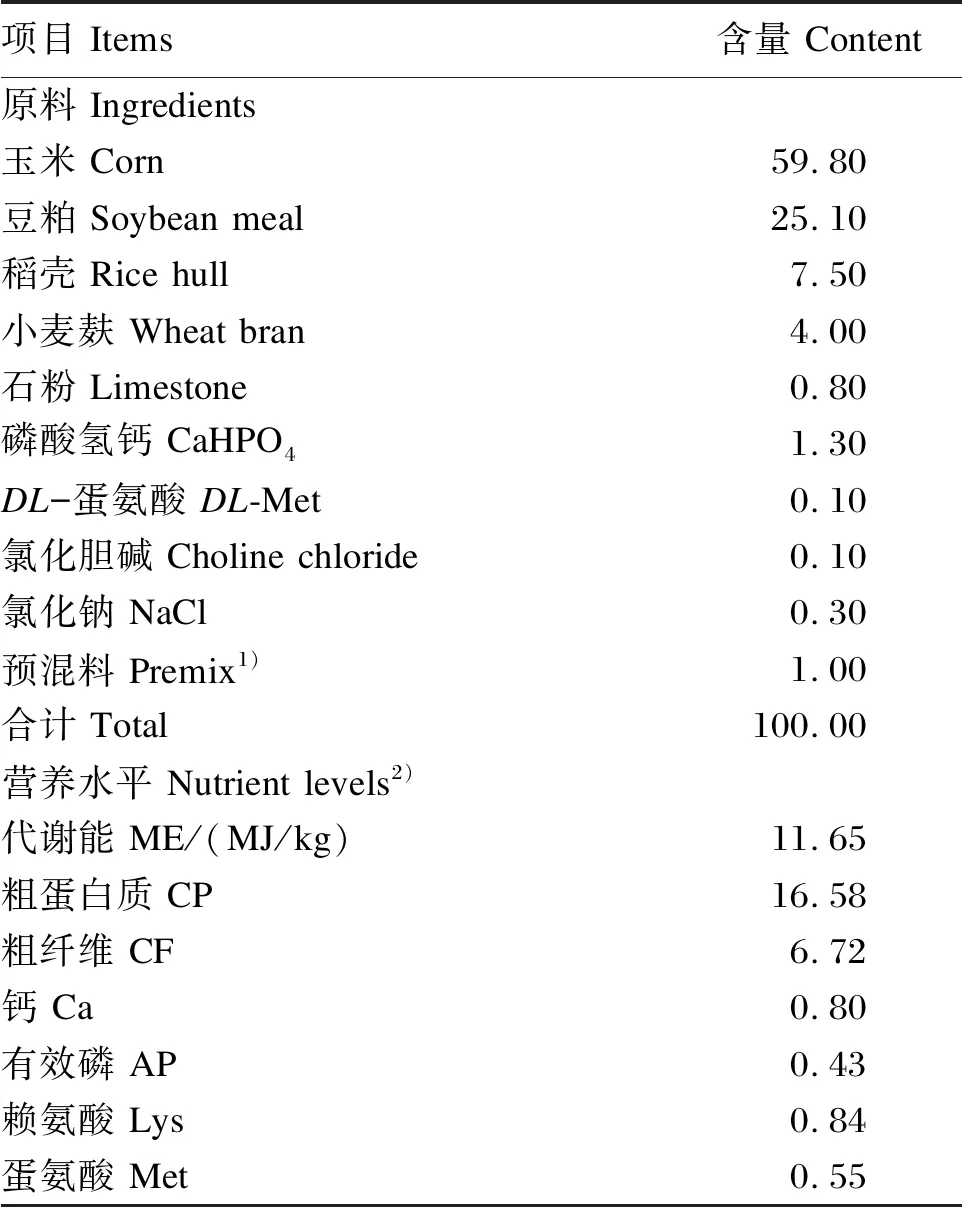
表1 基础饲粮组成及营养水平(风干基础)
某营养水平=∑每种原料该营养成分含量×饲粮中原料所占百分比。
1.2 样品的采集
在63日龄时,每个重复随机选取1只鹅,经二氧化碳麻醉后,通过颈椎脱臼安乐致死。采集盲肠内容物,于-80 ℃低温保存,用于测定盲肠菌群以及代谢物和短链脂肪酸(short-chain fatty acids,SCFAs)含量。分离并截取盲肠中段组织约1 cm,使用生理盐水浸泡并冲洗肠道内容物,并用多聚甲醛固定,进行组织形态学分析。
1.3 盲肠组织形态学分析
固定液中的样品保存6~8 h后,取出盲肠组织,流水冲洗12~24 h,待固定液洗净后经酒精梯度脱水并经透明、浸蜡、包埋、切片和苏木精-伊红(HE)染色,随后用盖玻片以及中性树胶封存,使用ImageView软件进行观察及图像截取。
1.4 盲肠微生物16S rDNA分析
使用MagPure Soil DNA LQ Kit分离盲肠内容物细菌DNA。使用NanoDrop 2000分光光度计测量DNA的浓度,并通过琼脂糖凝胶电泳确定DNA的质量。采用正向引物343F(5′-TACGGRAGGCAGCAGC-3′)和反向引物798R(5′-AGGGTATCTAATCCT-3′)PCR扩增细菌16S rDNA基因V3~V4高变区。PCR扩增程序参考文献[1]。PCR扩增产物纯化后,使用Qubit进行浓度检测,在Illumina NovaSeq 6000(Illumina Inc.,美国)上测序。
微生物原始序列使用Trimmomatic(version 0.35)和FLASH(version 1.2.11)软件处理。利用Vsearch(version 2.4.2)软件将序列聚类为相似度≥97%的多个操作分类单元(operational taxonomic unit,OTU)。利用QIIME选择每个OTU的所有代表性序列,输入Silva数据库(version 138),用RDP分类器(version 2.2)软件进行比较和注释。
1.5 气相色谱-质谱联用(GC-MS)代谢组学分析
取盲肠内容物60 mg于1.5 mL EP管内,与20 μL标准溶液(0.3 mg/mLL-2-氯-苯丙氨酸,甲醇制)和360 μL甲醇∶水混合物(4∶1,体积比)混合,于-20 ℃静置2 min,研磨(60 Hz,2 min);加入200 μL氯仿、400 μL水,涡旋2 min,冰水浴超声提取30 min;于-20 ℃下静置30 min后离心10 min(13 000 r/min,4 ℃)。取150 mL上清液于玻璃衍生小瓶,在冷冻浓缩离心干燥器中干燥。质控样本(QC)由所有样本的提取液等体积混合制备而成,加入80 μL甲氧胺盐酸盐吡啶溶液(15 mg/mL),涡旋振荡2 min后,于37 ℃振荡培养箱中孵育90 min,进行肟化反应。然后加入50 μL双(三甲基硅烷基)氟乙酰胺(含1%三甲基氯硅烷)、20 μL正己烷、10 μL内标,涡旋振荡2 min后,于70 ℃反应60 min,室温放置30 min,进行GC-MS代谢组学分析。
代谢组学分析使用Agilent 7890B气相色谱系统和Agilent 5977A MSD系统进行(Agilent,美国)。采用DB-5MS融合硅胶毛细管色谱柱(30 m×0.25 mm×0.25 μm)进行色谱分离。载气为高纯氦气,流速1 mL/min;进样器温度为260 ℃;初始温度为60 ℃,保持0.5 min,依次以8 ℃/min升温至125 ℃、5 ℃/min升温至210 ℃、10 ℃/min升温至270 ℃、20 ℃/min升温至305 ℃,保持5 min。设置质谱四极杆和离子源(电子撞击)温度分别为150和230 ℃,碰撞能量为70 eV,扫描范围为质荷比(m/z)50~500。
1.6 盲肠内容物SCFAs含量的测定
盲肠内容物中SCFAs,包括乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸,采用气相色谱法按照文献[8]的方法进行测定,色谱条件为:初始温度70 ℃,进样温度和检测器温度设置为220 ℃;载气为氢气,流速30 mL/min。
1.7 数据统计与分析
通过QIIME计算样本生境内多样性指数,采用Tukey’s HSD检验和Kruskal-Wallis H检验分析样本组间α指数的差异;通过R项目中Unweighted Unifrac距离度量进行主坐标分析(principal coordinates analysis,PCoA);通过R项目中Adonis(也称Permanova,变量的排列多元分析)评估样本生境间多样性的差异;采用单因素方差分析判定组间差异。分别以P<0.05和P<0.01为差异显著和极显著。采用Two-tailed Student’sT检验,分析并筛选差异显著的组间代谢物[变量投影重要性(VIP)>1,P<0.05],使用京都基因与基因组百科全书(KEGG)数据库(https://www.kegg.jp/)对所选的差异代谢物进行富集。采用SPSS 26.0统计软件的单因素方差分析(one-way ANOVA)和Duncan氏多重比较法分析鹅饲粮中添加GSPs对于盲肠组织形态及SCFAs含量的作用效果,采用正交多项式法分析GSPs水平的线性和二次效应。P<0.05为差异显著,结果用平均值和均值标准误表示。
2 结 果
2.1 饲粮添加GSPs对鹅盲肠组织形态的影响
如图1所示,饲粮添加GSPs对鹅盲肠肠绒毛密度无明显影响;测量肠绒毛高度及隐窝深度得到的结果见表2,相比于对照组,50 mg/kg GSPs添加组鹅盲肠绒毛高度显著提高(P<0.05),饲粮添加不同水平GSPs对盲肠隐窝深度及绒毛高度/隐窝深度(V/C)值无显著影响(P>0.05)。
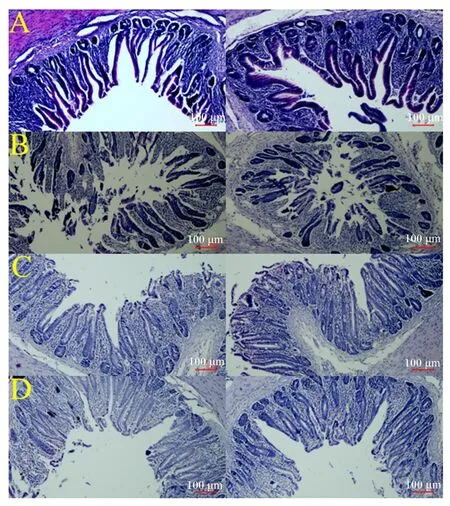
图A、图B、图C和图D分别代表对照组以及50、100和150 mg/kg GSPs添加组。
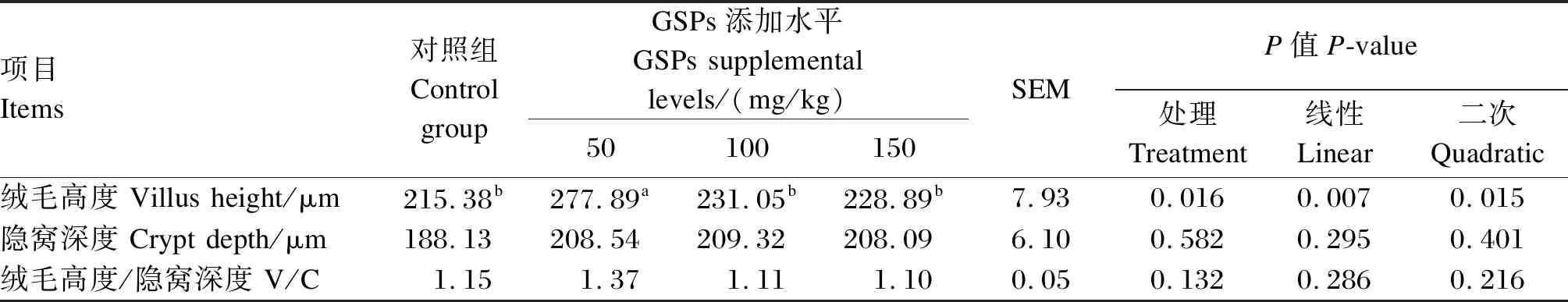
表2 饲粮添加GSPs对鹅盲肠组织形态的影响
2.2 饲粮添加GSPs对鹅盲肠菌群的影响
2.2.1 盲肠菌群生境内多样性分析
盲肠菌群生境内多样性分析如图2所示。与对照组相比,饲粮添加GSPs显著或极显著提高了鹅盲肠菌群Chao1指数和可观测物种(observed_species)数(P<0.05或P<0.01),显示出丰富的微生物群落;饲粮添加GSPs显著提高了盲肠菌群PD_whole_tree值(P<0.05);饲粮添加50和100 mg/kg GSPs显著或极显著提高了盲肠菌群Shannon指数(P<0.05或P<0.01),表明盲肠菌群丰富度增加。在本研究中,各组Good’s覆盖度均大于0.986,表明测序的覆盖率较高。
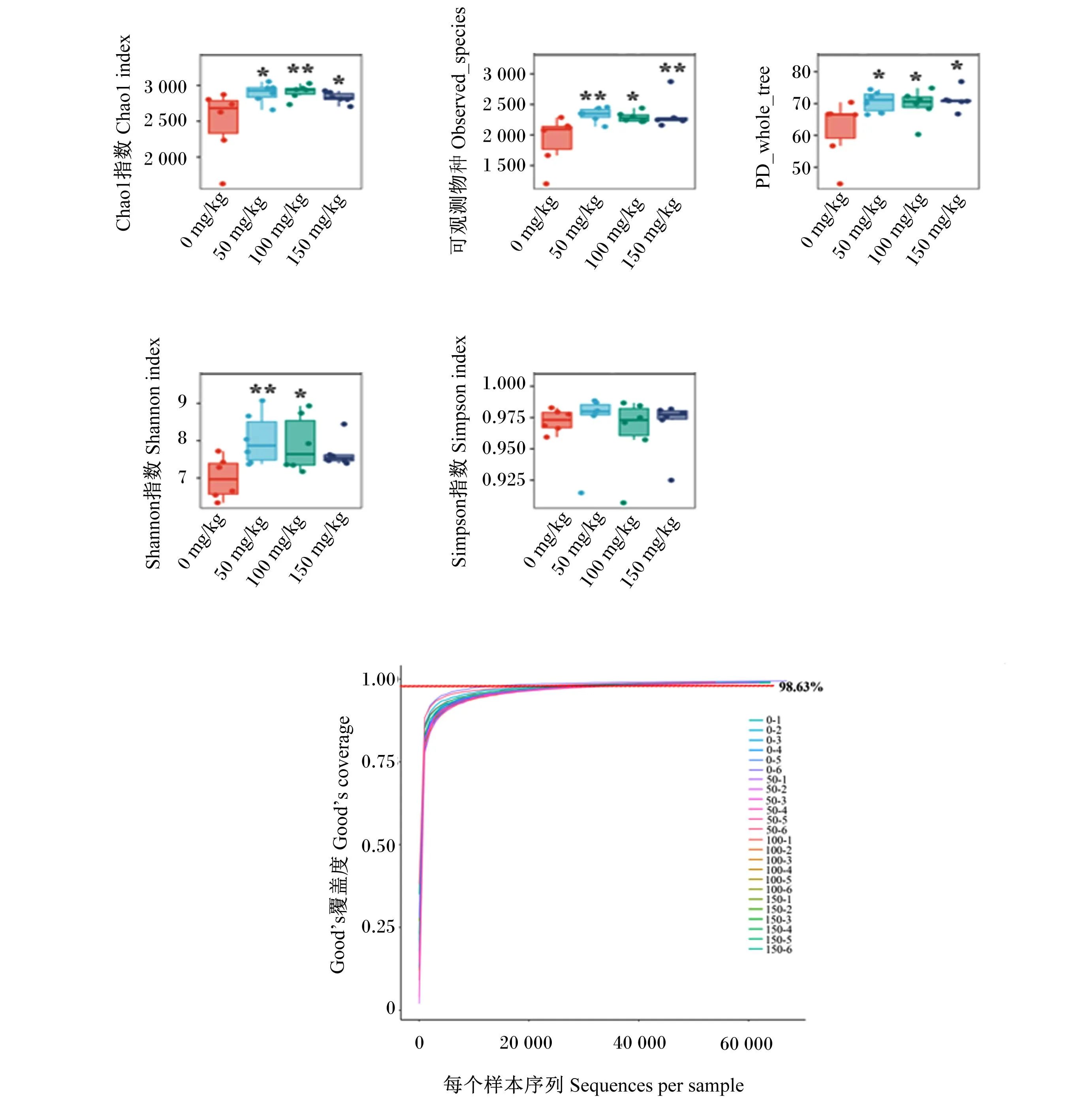
0 mg/kg、50 mg/kg、100 mg/kg和150 mg/kg分别代表对照组以及50、100和150 mg/kg GSPs添加组。下图同。0 mg/kg, 50 mg/kg, 100 mg/kg and 150 mg/kg represented control group, 50, 100 and 150 mg/kg GSPs supplemental groups, respectively. The same as below.
2.2.2 盲肠菌群生境间多样性分析
采用PCoA和非度量多维尺度(non-metric multidimensional scaling,NMDS)分析对生境间多样性进行评价,结果如图3所示。以群落为单位进行评估,空间距离越大说明群落的组间差异性越大。3个GSPs添加组与对照组的盲肠菌群在X轴上均有不同程度的分离,说明饲粮添加GSPs后,鹅盲肠菌群组成发生了有效的变化[在X轴上的可信度:主坐标1(PCo1)=84.53%,NMDS分析的应力(stress)值=0.011 7]。

图3 生境间多样性分析
2.2.3 盲肠菌群组成分析
在门、科以及属水平上测得的鹅盲肠菌群组成如图4所示。在门水平上(图4-A),厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)为优势菌门。与对照组相比,各GSPs添加组盲肠厚壁菌门相对丰度提高,盲肠拟杆菌门相对丰度降低;100和150 mg/kg GSPs添加组盲肠变形菌门(Proteobacteria)相对丰度降低。在科水平上(图4-B),与对照组相比,饲粮添加GSPs提高了盲肠瘤胃球菌科(Ruminococcaceae)、梭菌UCG-014(Clostridia_UCG-014)、毛螺菌科(Lachnospiraceae)和产粪甾醇真细菌群([Eubacterium]_coprostanoligenes_group)的相对丰度,降低了颤螺菌科(Oscillospiraceae)、理研菌科(Rikenellaceae)和拟杆菌科(Bacteroidaceae)的相对丰度。在属水平上(图4-C),拟杆菌属(Bacteroides)、梭菌UCG-014、副拟杆菌属(Parabacteroides)、梭菌vadinBB60群(Clostridia_vadinBB60_group)、产粪甾醇真细菌群和粪杆菌属(Faecalibacterium)是鹅盲肠内容物中的优势菌属。与对照组相比,饲粮添加GSPs提高了盲肠梭菌UCG-014相对丰度,降低了拟杆菌属相对丰度;饲粮添加50和100 mg/kg GSPs提高了盲肠产粪甾醇真细菌群和粪杆菌属的相对丰度。

A:门水平菌群组成;B:科水平菌群组成;C:属水平菌群组成。图C中点越大表明菌属相对丰度越高。A: microbial composition at phylum level; B: microbial composition at family level; C: microbial composition at genus level. Larger dots in Fig.C indicated higher relative abundance of genus.
2.3 饲粮添加GSPs对鹅盲肠代谢物的影响
2.3.1 盲肠代谢物正交偏最小二乘法判别分析(OPLS-DA)
如图5所示,OPLS-DA结果表明,3个GSPs添加组样本与对照组样本在横坐标轴上呈现的距离均比较远,GSPs添加组与对照组明显分离,表明GSPs添加组与对照组间代谢物成分差异显著(P<0.05)。图5-D呈现了各GSPs添加组与对照组之间的盲肠差异代谢物数量,50、100和150 mg/kg GSPs添加组与对照组之间的差异代谢物数量分别为23、18和36种。

A:50 mg/kg GSPs添加组与对照组;B:100 mg/kg GSPs添加组与对照组;C:150 mg/kg GSPs添加组与对照组;D:各GSPs添加组与对照组差异代谢物统计图。
2.3.2 盲肠差异代谢物聚类分析
盲肠差异代谢物聚类分析如图6所示。50、100和150 mg/kg GSPs添加组与对照组之间的共有差异代谢物为亚精胺。与对照组相比,50、100和150 mg/kg GSPs添加组亚精胺表达丰度显著下调(P<0.05);100和150 mg/kg GSPs添加组羟基丙酸、闪白酸和L-丙氨酸表达丰度显著下调(P<0.05),戊二酸和3,7,11-三甲基-3,4-二羟基十二烷酸表达丰度显著上调(P<0.05)。

A:50 mg/kg GSPs添加组与对照组;B:100 mg/kg GSPs添加组与对照组;C:150 mg/kg GSPs添加组与对照组。图7同。A: 50 mg/kg GSPs supplemental group vs control group; B: 100 mg/kg GSPs supplemental group vs control group; C: 150 mg/kg GSPs supplemental group vs control group. The same as Fig.7.
2.3.3 盲肠代谢物KEGG代谢通路富集分析
盲肠代谢物KEGG代谢途径富集分析如图7所示。50 mg/kg GSPs添加组对比对照组极显著富集的代谢通路为β-丙氨酸代谢和ABC转运体(P<0.01),100 mg/kg GSPs添加组对比对照组极显著富集的代谢通路为β-丙氨酸代谢和以及精氨酸和脯氨酸代谢(P<0.01),150 mg/kg GSPs添加组对比对照组极显著富集的代谢通路为丙酸盐代谢、β-丙氨酸代谢、精氨酸和脯氨酸代谢以及ABC转运体(P<0.01);3个GSPs添加组与对照组之间共有的代谢通路为β-丙氨酸代谢。

富集评分越高,富集程度越大;颜色由蓝到红表示P值依次降低;点越大,说明富集到该通路上的代谢物数目越多。The higher the enrichment score, the higher the enrichment degree. The color from blue to red indicated that the P-value was decreased in turn. The larger the dot, the greater the number of metabolites enriched to the pathway.
2.3.4 饲粮添加GSPs对鹅盲肠SCFAs含量的影响
饲粮添加GSPs对鹅盲肠SCFAs含量的影响如图8所示。与对照组相比,饲粮添加GSPs显著提高盲肠乙酸和丙酸含量(P<0.05),饲粮添加50和100 mg/kg GSPs显著提高盲肠丁酸含量(P<0.05);随着饲粮GSPs添加水平的提高,盲肠乙酸、丙酸和丁酸含量呈线性和二次变化(P<0.05)。
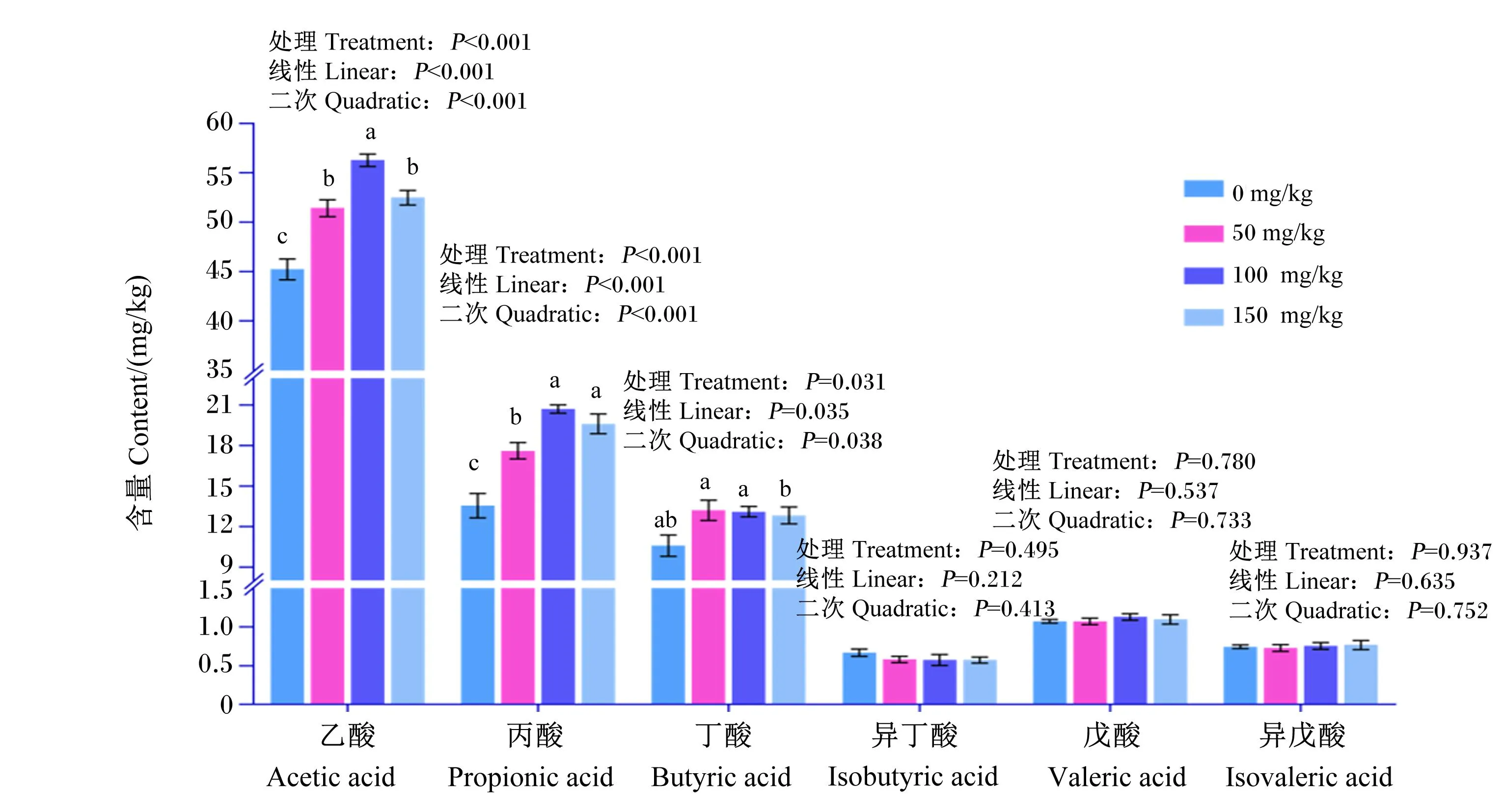
同一组数据柱标有不同字母表示差异显著(P<0.05),无字母或相同字母表示差异不显著(P>0.05)。
3 讨 论
3.1 饲粮添加GSPs对鹅盲肠组织形态的影响
在现代高密度集约化养殖模式下,应激或肠道代谢紊乱是鹅生产中普遍存在的问题,通常会导致免疫力下降、抗氧化能力减弱、肠黏膜受损以及肠道微生物多样性降低。肠道抗氧化性能直接影响肠道内环境稳态和抵抗应激的能力。本课题组前期的研究已经证实,饲粮添加GSPs对鹅肠道抗氧化有显著的促进作用[10],同时还表明GSPs有助于维持肠道上皮的紧密连接,抑制二胺氧化酶、D-乳酸和内毒素等物质从肠道进入外周循环[1]。在本研究中,与对照组相比,50 mg/kg GSPs添加组鹅盲肠绒毛高度显著提高,这进一步表明GSPs对于改善盲肠组织形态有一定的积极作用。
3.2 饲粮添加GSPs对鹅盲肠菌群的影响
饲粮中只有少量GSPs可以通过小肠被吸收进入循环系统,大部分未被消化的GSPs或Ⅱ相代谢产物则进入大肠,在肠道微生物的作用下发生芳香环裂变、去羟基化以及去酯化等一系列复杂反应[11]。因此,肠道菌群对GSPs等多酚类物质在体内的生物转化、吸收、代谢和生理活动具有重要意义。此外,GSPs及其代谢产物对微生物区系的丰富度和组成也会产生一系列积极影响。这表明GSPs与肠道微生物互惠互利,共同维持大肠健康。
肠道菌群多样性和丰富度与肠道健康有关,丰富的微生物种类通常有利于肠道的调节。盲肠菌群中的Good’s覆盖度显示了样本的测序深度,其值越接近1,说明测序结果越全面,结果越可靠,在本研究中,各组Good’s覆盖度均大于0.986,说明测序结果可靠。Chao1指数和可观测物种数反映样品中群落的丰富度,数值越大,说明样品中物种越丰富。Shannon指数、Simpson指数以及PD_whole_tree值反映群落的多样性,受样品群落中物种丰富度和物种均匀度的影响。本研究表明,饲粮添加GSPs提高了鹅盲肠菌群多样性及丰富度。一些有益细菌参与生物功能,如产生消化酶,通过增加白细胞活性来增强免疫力,甚至为身体提供必要的维生素和氨基酸[12]。相反,有害细菌会产生毒素,侵入肠道,影响肠道和机体的正常功能。有害细菌的增殖也会导致生态失调、真菌感染和炎症。既往研究表明,GSPs可以调节动物肠道菌群,加强黏膜屏障,改善肠道功能[4]。本试验结果表明,饲粮添加GSPs可提高鹅盲肠中厚壁菌门的相对丰度,降低盲肠中拟杆菌门的相对丰度。厚壁菌门大多数属有益菌,主要在肠道纤维降解发酵过程中产生SCFAs。SCFAs能够促进有益细菌增殖,为肠道提供弱酸性环境,对部分致病菌有抑制作用。同样的,Li等[13]的研究也表明,多酚作用于动物肠道时,可以显著提高厚壁菌门的相对丰度,降低拟杆菌门相对丰度。此外,本研究还表明,饲粮添加100和150 mg/kg GSPs还可以显著降低鹅盲肠变形菌门相对丰度,变形菌门均属于革兰氏阴性菌,包含很多病原菌种类,如大肠杆菌、沙门氏菌、霍乱弧菌和幽门螺杆菌等,这些菌种是胃肠道疾病的重要致病因素。在属水平上,饲粮添加GSPs显著降低了鹅盲肠中拟杆菌属的相对丰度,提高了盲肠中梭菌UCG-014、产粪甾醇真细菌群和粪杆菌属的相对丰度。拟杆菌属相对丰度的升高与小鼠肠道炎症、胃肠道功能紊乱有关[14-15]。梭菌UCG-014、产粪甾醇真细菌群和粪杆菌属已被认为能够不同程度地促进动物机体健康。其中,梭菌UCG-014是一种与色氨酸代谢相关的有益菌,产粪甾醇真细菌群通过其代谢产物鞘氨醇改善由高脂肪饮食引起的血脂异常,该代谢产物位于糖-鞘氨脂生物合成途径的上游[16]。回肠鞘脂合成的增加可以激活鹅肠道上皮细胞的增殖和肠绒毛的生长,维持肠道结构的完整性[17]。综上所述,饲粮添加GSPs可以通过增加鹅肠道菌群多样性,调节菌群组成,增加部分有益菌的丰度,改善鹅肠道环境,增强鹅肠道功能。
3.3 饲粮添加GSPs对鹅盲肠代谢物的影响
大多数食物中的GSPs由于在小肠中不能被消化,进入大肠后在那里通过微生物发酵转化为代谢物[18]。少数代谢产物可以直接影响动物,而大多数代谢产物通过参与代谢和合成过程,间接影响机体的调节。在本研究中,饲粮添加不同水平的GSPs后,上调鹅盲肠的差异代谢物主要为有机酸及其衍生物,3个GSPs添加组盲肠亚精胺表达丰度显著下调。亚精胺是精氨酸和脯氨酸代谢过程中的关键物质,由精胺氧化酶催化精胺产生,与精胺和腐胺同属于多胺类;多胺可以诱导活性氧(reactive oxygen species,ROS)的聚集,降低细胞内还原型谷胱甘肽的含量,诱导RNA损伤和凋亡[19-20],且过量的ROS是体内氧化应激的主要原因。因此,亚精胺的下调可以减少ROS的产生,降低机体氧化损伤。KEGG代谢通路分析表明,GSPs可能通过β-丙氨酸代谢以及精氨酸和脯氨酸代谢影响鹅肠道健康。
栖息在鹅盲肠的微生物可以将小肠中未消化的食糜分解成对机体有用的营养物质,如SCFAs,降低肠道pH,抑制致病菌的生长[21],并减少脂多糖向细胞的转运,从而削弱致病菌对机体的影响[22]。乙酸被认为是一种抗炎物质,有助于维持肠道稳态;丙酸可以调节肝脏胆固醇的合成[23-24];丁酸通过激活单磷酸腺苷活化蛋白激酶(AMPK),抑制核因子-κB(NF-κB)、肿瘤坏死因子-α等炎症介质,提高紧密连接蛋白基因表达,增强肠道屏障功能[24]。在本研究中,饲喂饲粮添加GSPs的鹅盲肠中乙酸、丙酸和丁酸含量提高。因此,GSPs通过提高产生SCFAs的细菌的丰度和降低分泌内毒素的细菌的丰度,对肠道产生直接的有益影响或调节肠道微生物群落组成。
4 结 论
本试验结果表明,饲粮添加GSPs可通过提高鹅盲肠菌群的多样性和丰富度,促进有益细菌(如梭菌UCG-014、产粪甾醇真细菌群和粪杆菌属)的增殖,提高盲肠乙酸、丙酸和丁酸含量,并通过β-丙氨酸代谢以及精氨酸和脯氨酸代谢改善鹅肠道健康。
