血管内皮生长因子C及其受体对动物肠道脂肪消化吸收的调控作用及机制
2024-03-05汪骏峰张枫琳江青艳王松波
汪骏峰 张枫琳 江青艳 王松波
(华南农业大学动物科学学院,广东省动物营养调控重点实验室,广州 510642)
断奶仔猪对饲粮消化吸收效率较低,不能充分利用饲粮的营养物质,存在饲料资源浪费等问题。因此,提高动物对饲粮脂肪的利用效率,不仅能够缓解饲料原料的缺乏,还可以促进动物的生长发育,从而实现养殖业降本增效的目的。研究动物肠道脂肪消化吸收的生理调控过程,提高动物肠道对脂肪的消化吸收能力,以此提高饲料的利用效率对于养殖业的可持续发展具有重要的意义。最近研究发现,血管内皮生长因子C(vascular endothelial growth factor C,VEGFC)及其受体血管内皮生长因子受体3(vascular endothelial growth factor receptor 3,VEGFR3)参与调控了动物肠道对脂肪的消化吸收,并且主要介导了乳糜微粒进入乳糜管(乳糜管是肠管和肠系膜中的一条淋巴管)的生理过程。因此,本文在介绍动物肠道脂肪消化吸收的过程和VEGFC及其受体表达和功能的基础上,论述了VEGFC及其受体对乳糜管结构和小肠内淋巴内皮细胞(lymphatic endothelial cells,LECs)连接方式以及机体乳糜微粒进入乳糜管的调控作用与机制,为深入了解VEGFC及其受体对动物肠道脂肪消化吸收的调控作用及机制,并为提高动物肠道的脂肪消化吸收效率、促进生长发育、实现动物养殖的降本增效提供参考依据。
1 动物肠道脂肪消化吸收过程
饲粮脂肪在小肠被消化后,形成的脂肪酸(以长链脂肪酸为主)会被小肠上皮细胞表面的载体蛋白白细胞分化抗原36(cluster of differentiation 36,CD36)和脂肪酸转运蛋白4(fatty acid transport protein 4,FATP4)转运进入小肠上皮细胞内。脂质消化产物经肠细胞吸收后被单酰基甘油酰基转移酶(monoacylglycerol acyltransferases,MGATs)、二酰基甘油酰基转移酶(diacylglycerol acyltransferases,DGATs)和酰基辅酶A重新酯化并组装成甘油三酯(triglyceride,TG),肠道脂质与载脂蛋白B-48(apoB-48)一起包装成前乳糜微粒(Pre-CM)或储存在细胞内(脂滴)。微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTTP)介导脂质包装形成乳糜微粒(chylomicron,CM),后者通过乳糜微粒前转运囊泡(pre-chylomicron transport vesicle,PCTV)经内质网转运到高尔基体成熟。成熟的乳糜微粒随后通过LECs之间的纽扣状连接方式进入乳糜管,经淋巴管回流到静脉和心脏,再通过血液循环运输到全身各组织器官[1]。肠道对脂肪的消化吸收过程如图1所示[2-4]。
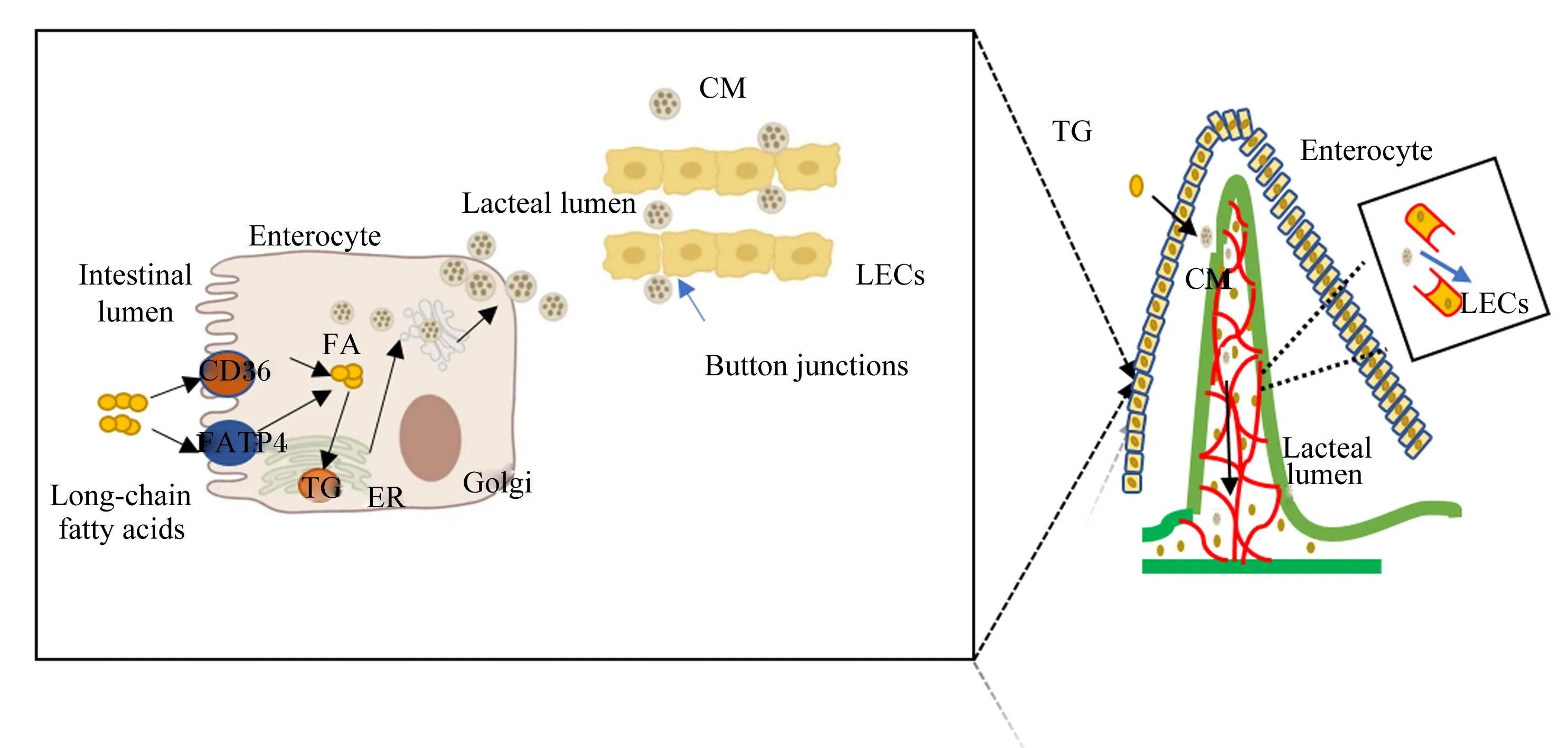
Intestinal lumen:肠腔;Long-chain fatty acids:长链脂肪酸;Enterocyte:肠上皮细胞;CD36:白细胞分化抗原36 cluster of differentiation 36;FATP4:脂肪酸转运蛋白4 fatty acid transport protein 4;FA:脂肪酸 fatty acid;CM:乳糜微粒 chylomicron;Golgi:高尔基体;ER:内质网 endoplasmic reticulum;TG:甘油三酯 triglyceride;LECs:淋巴内皮细胞 lymphatic endothelial cells;Button junctions:纽扣状连接;Lacteal lumen:乳糜管管腔。
2 影响肠道对脂肪消化产物吸收效率的关键因素——乳糜微粒进入乳糜管
小肠上皮细胞对饲粮脂肪酸的摄取、肠上皮细胞内甘油三酯和乳糜微粒的合成以及乳糜微粒进入乳糜管等生理过程均会影响动物肠道对饲粮脂肪的消化吸收。其中,乳糜微粒进入乳糜管的生理过程是影响脂肪消化吸收效率的关键因素。一直以来,乳糜微粒被认为是通过胞吐作用从小肠上皮细胞中排出,并通过淋巴系统运输至血液中[1],但是目前已有的研究表明,小肠上皮细胞中的乳糜微粒进入乳糜管这一过程依赖于淋巴管上淋巴内皮细胞之间的连接方式[5]。当LECs之间的连接方式为不连续的纽扣状的连接时,小肠上皮细胞中的乳糜微粒会通过纽扣状连接方式进入乳糜管;当LECs之间的连接方式由不连续的纽扣状连接转变为连续的拉链状连接时,乳糜微粒则会被阻止进入乳糜管。同时近期研究发现,VEGFC及其受体参与调控了乳糜微粒进入乳糜管的生理过程,进而调控肠道对脂肪的消化吸收[6-7]。
3 VEGFC及其受体的分布
VEGFC是血管内皮生长因子(vascular endothelial growth factor,VEGF)家族成员之一,VEGF家族还包括VEGFA、VEGFB、VEGFD、胚盘生长因子(placental growth factor,PLGF)和2个外源性亚型VEGFE和VEGFF[8]。VEGF家族的受体包括3个跨膜酪氨酸激酶受体,分别是血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1)、血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)和VEGFR3,以及2种神经菌毛素(neuropilin,NRP),分别是NRP1和NRP2。不同的VEGF与其受体结合会产生不同的生理功能,以共同维持生理稳态,其中VEGFC主要和其受体VEGFR2/3结合,参与调节淋巴管系统的稳态[9]、淋巴管的发育和生长[10-11]、血管生成[12]以及小肠淋巴管的脂质转运[7],而VEGFR3是机体肠道中主要表达的VEGF受体[13-14]。
VEGFC及其受体在机体内广泛分布。VEGFC在动物的骨骼肌、心肌和肠道等组织器官中均有表达[15],而VEGFC的受体VEGFR3在淋巴内皮细胞[16]、成骨细胞[17]、神经元祖细胞[18]和巨噬细胞[19]等中高度表达。本文重点论述在肠道中高表达的VEGFC及其受体对动物肠道脂肪消化吸收的调控作用。
已有研究发现,VEGFC在乳糜管周围的平滑肌细胞(smooth muscle cells,SMCs)中广泛表达[7],并且可以诱导肠道淋巴管周围的SMCs收缩[20-22],从而有效地排出肠绒毛中的脂肪[23]。此外,在SMCs中VEGFC的高度表达能够维持乳糜管的完整性和脂肪转运功能,而此过程其受体VEGFR3也参与调控[7]。另外,小肠绒毛上的巨噬细胞[24]和肠道基质细胞[25]也可以通过分泌VEGFC来参与调控乳糜管的完整性以及影响LECs的连接方式,进而影响肠道对脂肪的消化吸收。这些结果表明,VEGFC及其受体在肠道中高度表达,同时主要通过调控乳糜微粒进入乳糜管这一生理过程来参与影响动物肠道对脂肪消化产物的吸收。
4 VEGFC及其受体对动物肠道脂肪消化吸收的调控作用
4.1 VEGFC对动物肠道脂肪消化吸收的调控作用
VEGFC对动物肠道脂肪消化吸收具有重要的调控作用。研究表明,与野生型小鼠相比,特异性敲除小鼠肠道淋巴管中的VEGFC会降低高脂饲喂小鼠血清中胆固醇含量,提高粪便中胆固醇和脂肪酸含量,进而降低体内的总脂肪量和脂肪百分比[7]。此外,在最近的研究中,Hippo-Yap/TAZ信号通路已被证明可以调节LECs的增殖和稳态[26-28],Hippo-Yap/TAZ信号通路的末端转录调控因子被认为是介导淋巴管生成过程中的相对靶基因[26]。研究还发现,特异性敲除饲喂高脂饲粮小鼠肠道基质细胞中的转录调控因子后,VEGFC的mRNA表达量显著降低,小鼠体重和血清中甘油三酯含量也均显著降低,因此敲除小鼠肠道基质细胞中的转录调控因子会导致脂质吸收障碍,这表明VEGFC的减少是引起乳糜管功能受损的关键,进而影响肠道脂肪转运[25]。另外的研究发现,在肥胖小鼠中VEGFC的过表达可以促进小鼠乳糜管的增殖和生长,进而促进体内脂肪的消化吸收,降低胰岛素敏感性,加速肥胖诱导的胰岛素抵抗和脂质代谢异常[29]。综上所述,VEGFC对于机体肠道对脂肪的消化吸收具有重要调控作用。
4.2 VEGFR3对动物肠道脂肪消化吸收的调控作用
VEGFC的受体VEGFR3对动物肠道对脂肪的消化吸收也具有重要的调控作用。据报道,与野生型小鼠相比,特异性敲除LECs中VEGFR3的小鼠粪便中甘油三酯和游离脂肪酸的峰值含量分别降低了39%和24%,这表明此时肠道对脂肪的消化吸收出现缺陷[24]。此外,小鼠肠道中VEGFR3结构域失活突变后,小肠中脂蛋白脂肪酶(lipoprotein lipase,LPL)活性被抑制,同时小鼠肠道中VEGFR3的缺失导致其血清中甘油三酯和胆固醇含量降低,粪便中甘油三酯、1,2-二酰基甘油和游离脂肪酸含量升高,这表明VEGFR3参与了肠道对脂肪的消化吸收[30]。以上结果均说明,VEGFR3参与调控了动物肠道对脂肪的消化吸收过程。
此外,VEGFR3信号在人的肠道脂质吸收过程中也具有重要作用,因个人遗传或原发性淋巴水肿等原因导致人体中VEGFR3的缺失或表达降低均会影响人体中淋巴管的发育,使淋巴管发育延缓[31],这反映了肠道淋巴管未能充分运输乳糜微粒[32]。
5 VEGFC及其受体调控动物肠道脂肪消化吸收的机制
VEGFC及其受体对于动物肠道的脂肪消化吸收具有重要调控作用,可能涉及的机制包括VEGFC及其受体调控乳糜管的结构和LECs之间的连接方式2个方面,VEGFC及VEGFR3调控脂质消化吸收的相关信号通路如图2所示。

VEGFC:血管内皮生长因子C vascular endothelial growth factor C;VEGFR3:血管内皮生长因子受体3 vascular endothelial growth factor receptor 3;Microbe and microbial products:微生物及微生物产物;Lacteal:乳糜管;Blood capillary:毛细血管;Epithelial cell:上皮细胞;MyD88:髓样分化因子88 myeloid differentiation factor 88;TLR:Toll样受体 Toll-like receptor;Macrophage:巨噬细胞;LEC:淋巴内皮细胞 lymphatic endothelial cell;Button-like junction:纽扣状连接;TEAD:转录增强缔合域 transcriptional enhanced association domain;PDGFRβ:血小板衍生生长因子受体β polatelet-derived growth factor receptor β;IntSCs:肠间质细胞 intestinal stromal cells。
5.1 VEGFC及其受体可调控乳糜管的结构
乳糜管的结构能够影响肠道的脂肪消化吸收,VEGFC及其受体VEGFR3参与调控乳糜管的结构。研究发现,乳糜管结构完整性的维持受到邻近基质细胞的多种关键信号的调控[20],其中分布在乳糜管周围的细胞所分泌的VEGFC发挥着重要作用。已有研究表明,特异性敲除成年小鼠肠道淋巴管的VEGFC后,淋巴管逐渐萎缩,乳糜管厚度变薄、长度变短,LECs数量减少[7];与之类似,特异性敲除小鼠LECs中的VEGFC和VEGFR3后,小鼠空肠和回肠中的绝对乳糜管和相对乳糜管长度变短[33],LECs数量减少[24]。同时有报道发现,通过阻断VEGFC-VEGFR3信号通路,可显著逆转小鼠乳糜管LECs数量过度增加、LECs结构过度发芽与过度分支等乳糜管异常的表型[14]。另外也有研究报道,VEGFC与VEGFR3结合通过磷脂酰肌醇-3-羟激酶(phosphoinositide 3-kinase,PI3K)-蛋白激酶B(Akt)信号通路和磷酸化内皮型一氧化氮合酶Ser1177发挥肠道对脂肪消化吸收的调控作用,并且小鼠肠道中VEGFR3结构域失活突变后,引起其小肠上皮细胞中甘油三酯的积累和粪便中脂肪酸的含量增加,该结果说明VEGFC与VEGFR3结合会影响乳糜管的通透性,同时介导甘油三酯从小肠上皮细胞向乳糜管的转运[30]。以上结果均表明,VEGFC及其受体通过影响乳糜管的结构完整性来调控肠道的脂肪消化吸收。
5.2 VEGFC及其受体可调控LECs的连接方式
LECs之间的连接结构能够影响动物肠道对脂肪的消化吸收,VEGFC及其受体VEGFR3参与调控LECs之间的连接方式。已有研究表明,乳糜管中LECs之间的连接结构能够影响乳糜管对乳糜微粒的摄取,当LECs之间的连接方式为不连续纽扣状的连接时,小肠上皮细胞中的乳糜微粒会进入乳糜管;当LECs之间的连接方式由不连续的纽扣状连接转变为连续的拉链状连接时,乳糜微粒进入乳糜管这一过程受阻[5]。研究发现,VEGFC及其受体的缺失会通过影响LECs之间的连接结构进而影响肠道的脂肪消化吸收。例如,特异性敲除小鼠LECs中的VEGFC后,LECs之间纽扣状的连接比例降低,拉链状连接比例升高,此外特异性敲除小鼠LECs中的VEGFR3后表型与特异性敲除小鼠LECs中的VEGFC相似,由此可见特异性敲除VEGFC及其受体均会导致肠道脂肪转运受阻[24]。研究还发现,通过阻断VEGFC-VEGFR3信号通路,小鼠LECs之间的连接模式从纽扣状连接到拉链状连接的转换被阻断[25]。以上结果表明,动物体内VEGFC和受体的缺失均会影响LECs之间的连接结构,进而影响肠道对脂肪的消化吸收。
此外,VEGFC-VEGFR3信号通路上下游信号和肠道微生物的变化均会影响到LECs之间的连接结构。研究表明,VEGFC通过其受体VEGFR2和VEGFR3促进小鼠乳糜管中血管内皮细胞特异性Delta样配体4(Delta-like ligand 4,DLL4)的表达和激活Notch信号通路,从而维持LECs的发育;乳糜管中DLL4的缺失会导致乳糜管的结构被破坏、肠绒毛长度变短以及引起LECs之间的连接方式由纽扣状向拉链状的转变,进而导致乳糜微粒摄取和肠道脂肪运输效率降低,由此表明DLL4/Notch信号通路作用于VEGFR3和VEGFR2的下游,从而维持乳糜管的完整性[6]。另外有研究发现,巨噬细胞能感知肠道微生物的变化进而引起细胞上特定Toll样受体(Toll-like receptor,TLR)与髓样分化因子88(myeloid differentiation factor 88,MyD88)结合,进而促进绒毛巨噬细胞分泌VEGFC,并与LECs上的VEGFC受体VEGFR3相结合,从而促进脂肪从LECs之间的纽扣状结构进入乳糜管,提高肠道脂肪消化吸收效率;因此,在VEGFC促进乳糜管结构完整性的过程中TLR-MyD88复合物对肠道微生物组分变化的感应是其关键的上游信号[24]。以上结果表明,动物体内VEGFC-VEGFR3上游信号通路和肠道微生物的变化均会影响LECs之间的连接结构,进而影响肠道对脂肪的消化吸收。
6 小结与展望
本文介绍了动物肠道对脂肪的消化吸收过程和VEGFC及其受体在肠道周围细胞的表达分布,综述了VEGFC及其受体对动物肠道脂肪消化吸收的调控作用及机制,并初步探讨了其对LECs连接方式和乳糜管结构完整性的调节机制,为深入了解VEGFC及其受体对动物肠道脂肪消化吸收的调控作用提供了参考。目前,困扰养殖业的关键问题是断奶仔猪对脂肪的吸收效率偏低,造成仔猪生长发育受限。最新研究报道,VEGFC及其受体的阻断会影响肠道脂质消化吸收,这提示我们在生产中是否可以通过控制VEGFC及其受体的表达来调控动物肠道对脂肪的消化吸收。同时,后续研究中可以在饲粮中添加激动剂/抑制剂或者营养素等调控VEGFC及其受体的表达,进而调控动物肠道对脂肪的消化吸收。因此,未来需要更加系统和深入地研究VEGFC及其受体对动物肠道对脂肪消化吸收的调控及机制,以其改善养殖业面临的动物对脂肪消化吸收效率低的问题,从而促进动物的生长发育。
