模拟失重对家蚕胚胎发育的影响及基因表达变化的研究
2024-03-05张俊飞骞爱荣黄勇平
张俊飞,郭 莉,骞爱荣,黄勇平,张 舒,张 茹
(1空军军医大学航空航天医学系航空航天生物动力学教研室,陕西 西安710032;2空军第九八六医院第三门诊部,陕西 西安 710068;3西北工业大学生命学院,陕西 西安 710072;4中国科学院上海植物生理生态研究所,昆虫发育与进化生物学重点实验室,上海 200032)
空间微重力环境对航天员身体健康造成严重的威胁[1-3]。家蚕胚胎被认为是探索空间生命科学的理想材料,因为它具有体积小、繁殖率高、遗传背景清晰、胚胎期生命活动活跃等优点[4-5]。一系列实验结果表明,空间环境对家蚕的孵化和发育过程产生了显著影响。例如,美国亚特兰蒂斯号航天飞机搭载的家蚕解滞育的蚕卵在空间中未孵化率较高,未完成胚胎逆转的比例是地面组的2倍[6]。俄罗斯卫星搭载的家蚕空间实验显示,飞行组的蚕卵孵化时间和交配蚕蛾的产卵时间均提前了2~3 d[7]。我国第12颗返回式卫星成功搭载家蚕非滞育卵进行轨道飞行8 d,飞行组的胚胎孵化提前2 d,返回地面后,幼虫发育时间缩短了7 d。2016年,我国首颗微重力科学实验卫星搭载家蚕卵空间飞行12 d,结果显示胚胎基因表达受到影响,返回地面后,幼虫发育时间缩短了3 d[4]。然而,航天飞行耗资巨大、空间环境复杂多变、不易控制。因此,地面模拟研究成为研究空间生物科学的重要选择,具有低成本、小占地面积、易操作和多实验机会的优势。三维回转器,又称随机定位仪,是研究地面模拟失重效应的设备。它包含两个相互垂直的转轴,可以随机转动内框和外框。在一个回转周期内,物体受到的重力矢量和为零,从而模拟失重生物效应[8]。研究表明,三维回转器可以影响细胞的结构和功能,如通过改变卵母细胞骨架进而影响线粒体和内质网的定位与功能[9],降低成骨细胞分化能力[10],增加乳腺癌细胞外囊泡的释放并改变细胞间粘附因子的表达[11-12]。然而地面模拟微重力环境对家蚕胚胎发育的影响及其作用机制的研究鲜有报道。本研究采用三维回转器模拟空间微重力环境,研究其对家蚕胚胎发育和基因表达的影响,为空间基础生物学研究提供理论和实验依据。
1 材料与方法
1.1 材料
家蚕品系是中国科学院上海植物生理生态研究所提供的非滞育Nistari品系;随机定位仪(中国科学院空间科学与应用研究中心);回转控制器(中国科学院空间科学与应用研究中心);RevertAid First Strand cDNA合成试剂盒(美国Thermo Fisher公司);DNA消化酶试剂盒(日本Takara公司);SYBR Green Realtime PCR Master Mix(日本Toyobo公司);Trizol试剂(美国Invitrogen公司);PCR扩增仪、离心机、紫外分光光度计、移液器(德国Eppendorf公司);超净工作台(上海博迅实业有限公司);凝胶成像系统(上海天能科技有限公司);垂直板电泳槽、变性梯度凝胶电泳系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 样品制备 雌雄蚕蛾交配6 h后,雌蛾产卵。蚕卵产下12 h后,置于三维回转器上连续回转11 d,作为回转组,温度维持在21 ℃。对照组则是不进行回转处理的同批次家蚕卵。我们从对照组和回转组中分别随机选取了50粒家蚕胚胎样本和30头蚁蚕样本进行RNA-seq测序。
1.2.2 RNA提取 准备取材工具,包括剪刀、镊子、冰盒、进口离心管和预冷的4 ℃离心机。将500 μL的TRIzol放入灭菌离心管中,并将家蚕胚胎或蚁蚕放入管中,标记样品名称。使用研磨棒研磨组织,将其静置在室温下5 min,然后12 000 r/min离心10 min,取上清液进入新的灭菌离心管,弃去沉淀。加入100 μL三氯甲烷,轻轻摇晃,然后12 000 r/min离心15 min。取上清液进入新的离心管,加入等体积的异丙醇和1/10醋酸钠,轻轻摇晃,冰上静置10 min,然后12 000 r/min离心10 min。弃去上清液,取沉淀晾干,加入50 μL的无酶水。使用DNA消化酶试剂盒消化RNA提取液中的DNA。最后,纯化RNA,将消化完DNA的RNA溶解液中加入150 μL无酶水+200 μL酚氯仿,然后12 000 r/min离心15 min。取上清液进入新的离心管,加入上清液1/10体积的醋酸钠和2.5倍体积的无水乙醇,放置在-80 ℃下30 min,然后12 000 r/min离心15 min。去掉上清液,加入1 000 μL的750 mL/L乙醇,然后12 000 r/min离心5 min以洗去杂质,洗涤过程重复3次。晾干沉淀,加入50 μL的无酶水,测量浓度,并进行电泳检测。
1.2.3 RNA-seq测序 为了检测三维回转对家蚕胚胎基因表达的影响,我们从对照组和回转组分别随机选取家蚕胚胎(发育第5日)和刚孵化蚁蚕进行了RNA-seq测序。通过上述方法提取总RNA,并确保RNA完整性后,送至美吉生物公司进行RNA测序和后续的数据分析,其目的是分析模拟失重环境对家蚕胚胎基因表达和通路的影响。RNA-seq分析的参考基因组来自家蚕EST数据库(http://silkbase.ab.a.u-tokyo.ac.jp/cgi-bin/index.cgi)。
1.2.4 qRT-PCR qRT-PCR使用RevertAid First Strand cDNA Synthesis Kit合成cDNA。以上述cDNA产物为模板,使用SYBR Green Realtime PCR Master Mix进行qRT-PCR扩增。PCR反应体系包含:10 μL的SYBR;0.5 μL的上游引物;0.5 μL的下游引物;2 μL的cDNA模板;7 μL的超纯水。PCR反应程序包含:95 ℃预热1.5 min,然后进行40个循环,循环是95 ℃,1 min;95 ℃,15 s;60 ℃,1 min。qRT-PCR中使用的引物序列如表1所示。另一个引物对RP49(正向)和RP49(反向)(表1)被用作内参[13]。
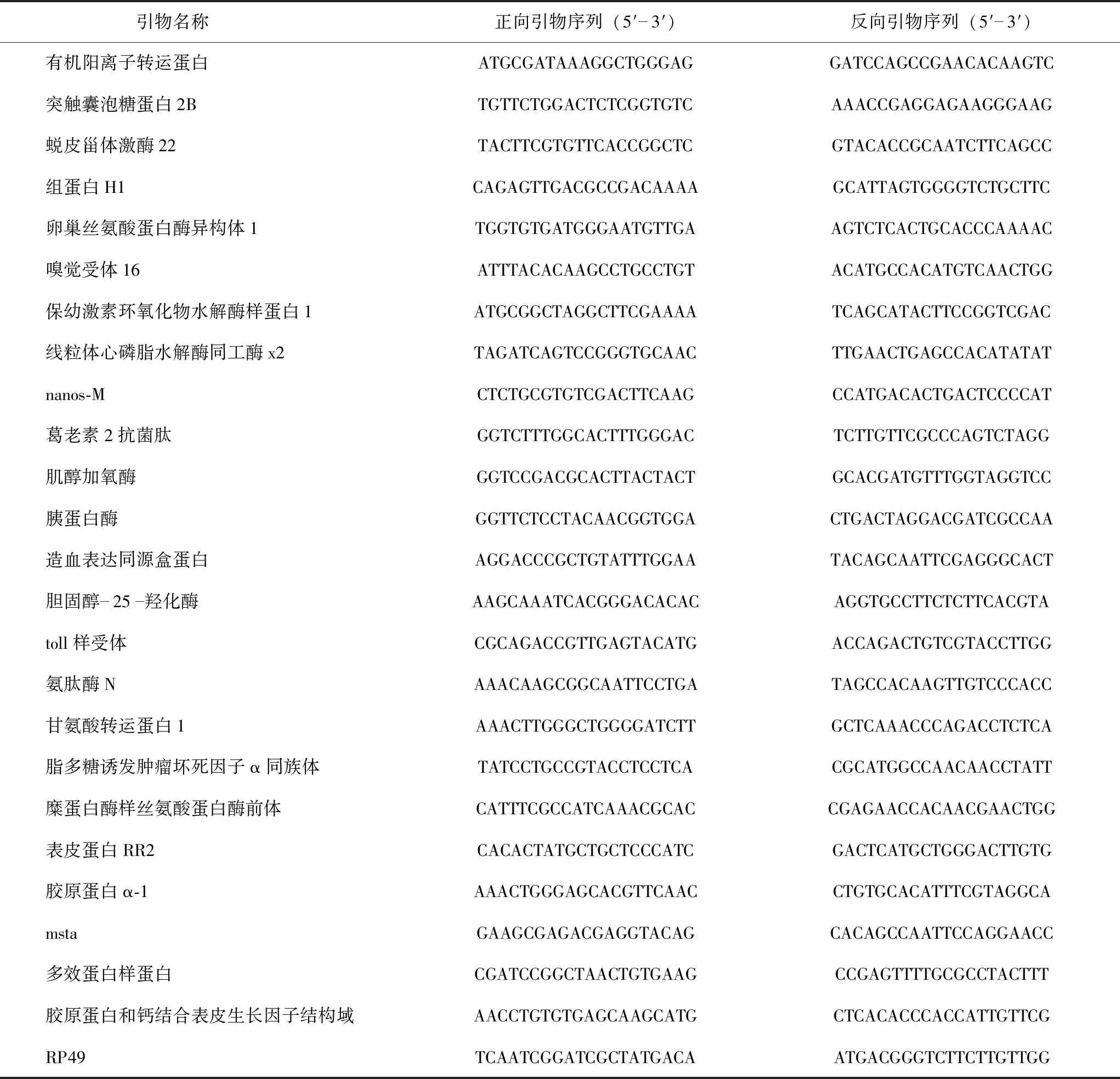
表1 qRT-PCR引物序列
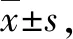
2 结果
2.1 三维随机回转模拟失重使家蚕胚胎发育提前
利用三维回转器对家蚕胚胎样本进行失重效应的模拟。回转组的家蚕胚胎在回转器上连续回转11 d,温度保持在21 ℃。对照组则为未回转的同时期家蚕胚胎(图1A)。在蚕胚胎发育的第10日,回转组的蚕胚胎开始点青,而对照组没有发生变化。第11日,对照组的蚕胚胎也开始点青。第12日,回转组的胚胎开始孵化,而对照组没有发生变化(图1B)。通过三维回转模拟失重效应,我们观察到回转组的家蚕胚胎比对照组发育提前。这说明模拟失重对家蚕胚胎的发育产生了显著影响。

A:三维回转器对家蚕胚胎样本进行失重效应的模拟;B:对照组与回转组胚胎发育照片。
2.2 RNA-seq分析差异表达基因
为了研究模拟失重对家蚕胚胎发育的影响机制,提取对照组和回转组家蚕胚胎(发育第5日),以及刚孵化的蚁蚕的总RNA。随后,对提取的样本进行RNA-seq分析。测序完成并经过质控后,对照组胚胎的测序读段数量为52 750 876,回转组胚胎为43 404 750。对照组蚁蚕的测序读段数量为41 858 620,回转组蚁蚕为58 435 660(表2)。同时,对照组胚胎的测序综合质量值为96.72%,回转组胚胎为96.81%。对照组蚁蚕的测序综合质量值为95.85%,回转组蚁蚕为97.07%(表2)。将质控后的测序数据,即clean data(reads)与参考基因组进行比对,获得能定位到基因组上的测序数据,用于后续分析。值得注意的是,四组样品的数据定位率都远远高于合格值70%(表3)。以上数据提示转录组测序成功且数据结果可靠。

表2 样品质控数据统计表
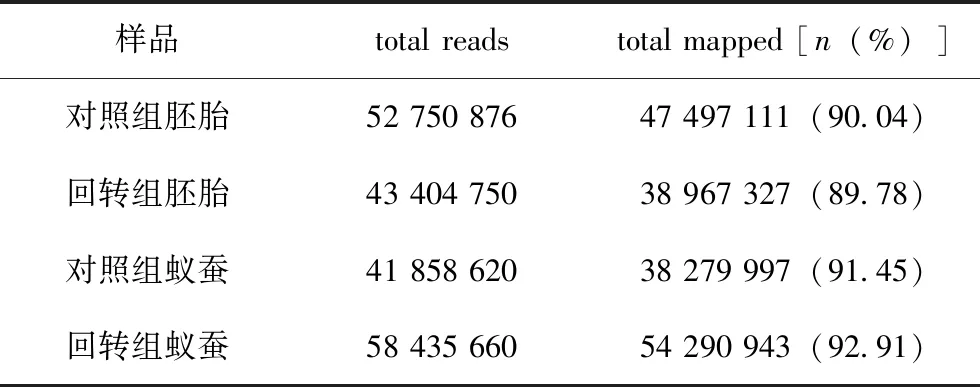
表3 clean reads与参考基因组的比对结果情况统计
差异表达基因筛选的条件:两个样本间显著差异的转录本表达筛选阈值Padjust<0.005,且两个样本中转录本表达倍数大于2,即FC>2。在家蚕胚胎对照组和回转组之间,发现1 247个显著差异表达的基因,其中1 047个基因表达上调,200个基因表达下调(图2A)。在家蚕对照组和回转组蚁蚕之间,发现4 993个显著差异表达的基因,其中3 533个基因表达上调,1 460个基因表达下调(图2B)。随着家蚕胚胎在失重环境中暴露的时间延长,差异表达的基因数量也会增加。
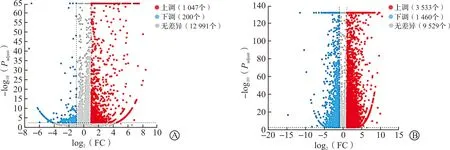
A:对照组与回转组家蚕胚胎发育第5日差异表达基因;B:对照组与回转组蚁蚕差异表达基因。
2.3 差异表达基因的GO功能注释和KEGG通路富集分析
为进一步研究模拟失重对家蚕胚胎和蚁蚕基因表达的影响,我们进行了GO和KEGG通路的富集分析。在GO功能注释分析中,差异基因被归为30个条目中,包含3个生物过程,8个细胞成分和9个分子功能。在筛选的胚胎期差异基因中,生物过程中催化活性富集的基因数量最多(151个),细胞成分中膜结构富集的基因数量最多(95个),分子功能中代谢过程富集的基因数量最多(134个,图3)。此外,KEGG通路富集分析结果显示,回转组胚胎相对于对照组胚胎,表达发生显著变化的基因主要富集于核糖体和RNA转运通路,这提示模拟失重可能通过这些信号通路影响家蚕胚胎发育。
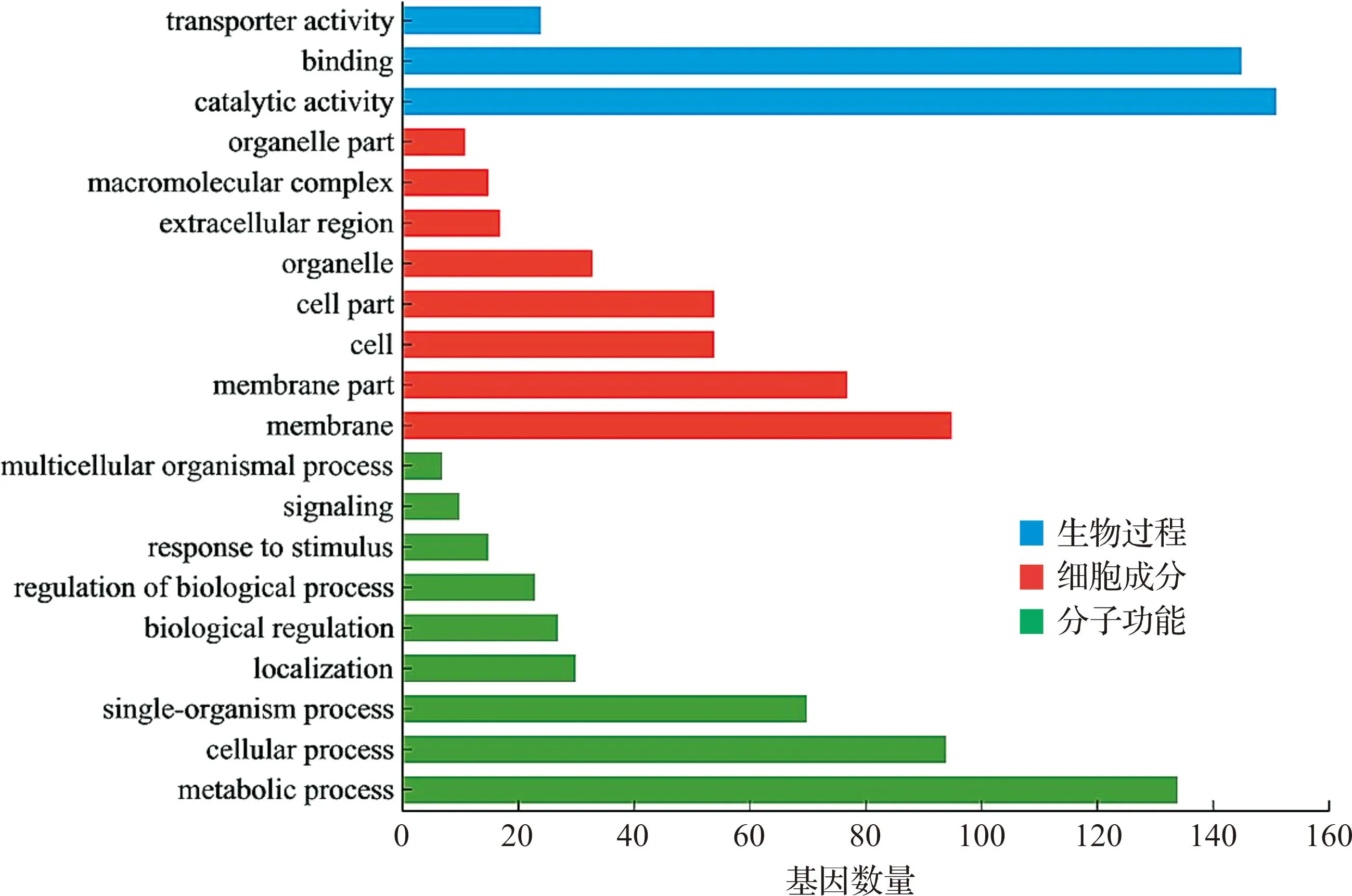
图3 胚胎发育第5日对照组与回转组家蚕胚胎差异基因的GO功能注释分析
此外,在蚁蚕期筛选的差异基因中,生物过程中催化活性通路的富集数量最多(742个);细胞成分中膜结构通路的富集数量最多(489个);分子功能中代谢过程的富集数量最多(691个,图4)。KEGG通路富集分析结果显示,回转组蚁蚕相对于对照组蚁蚕,表达显著变化的基因主要富集于多个代谢相关通路,包括缬氨酸、亮氨酸和异亮氨酸的降解代谢,果糖和甘露糖的代谢,脂肪酸的降解,鞘脂信号通路等。除此之外,还富集于黏着斑、紧密连接等通路(表4)。这些结果提示随着家蚕胚胎回转时间的延长,差异基因及其富集的通路数量也随之增加。
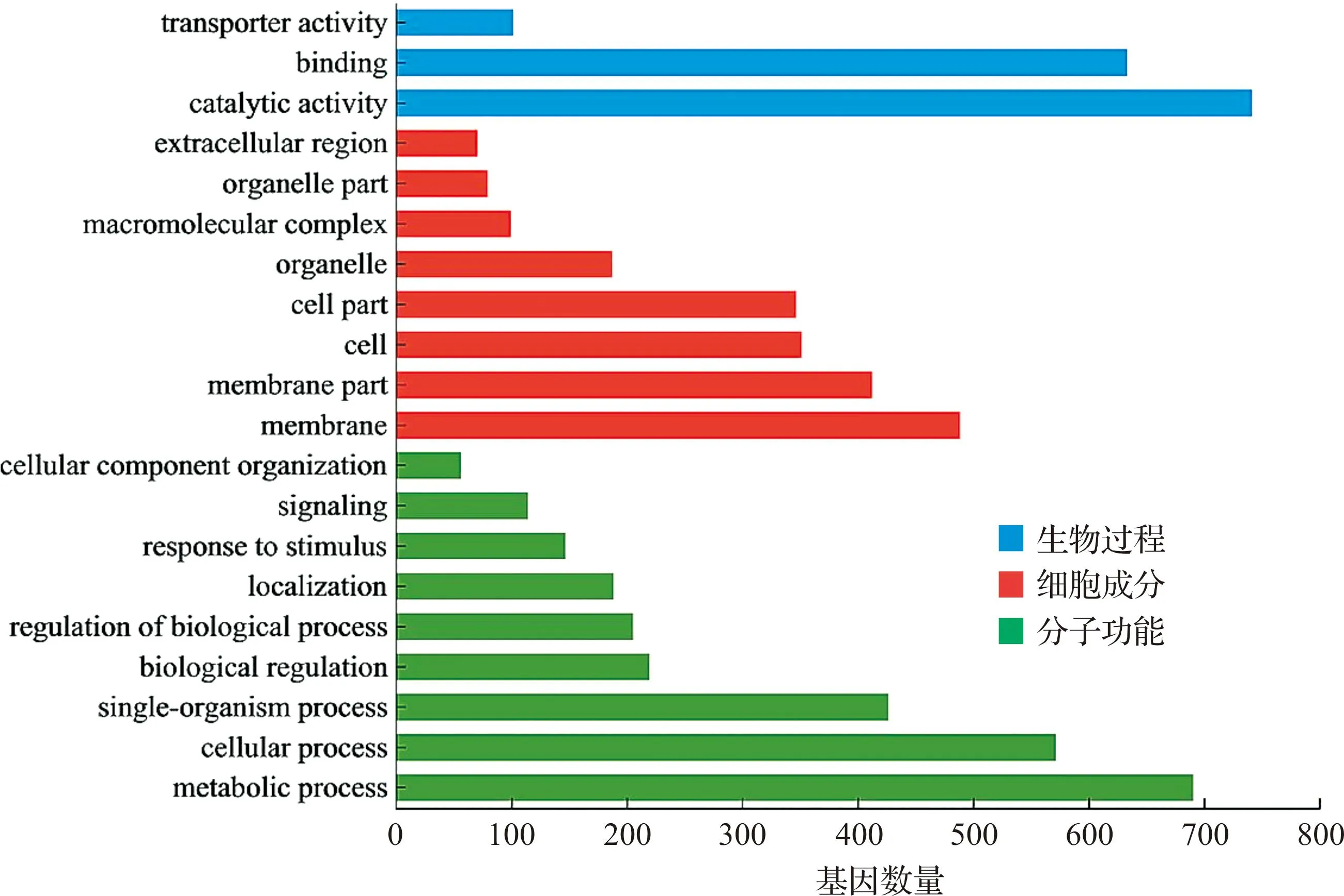
图4 对照组与回转组蚁蚕差异基因的GO功能注释分析
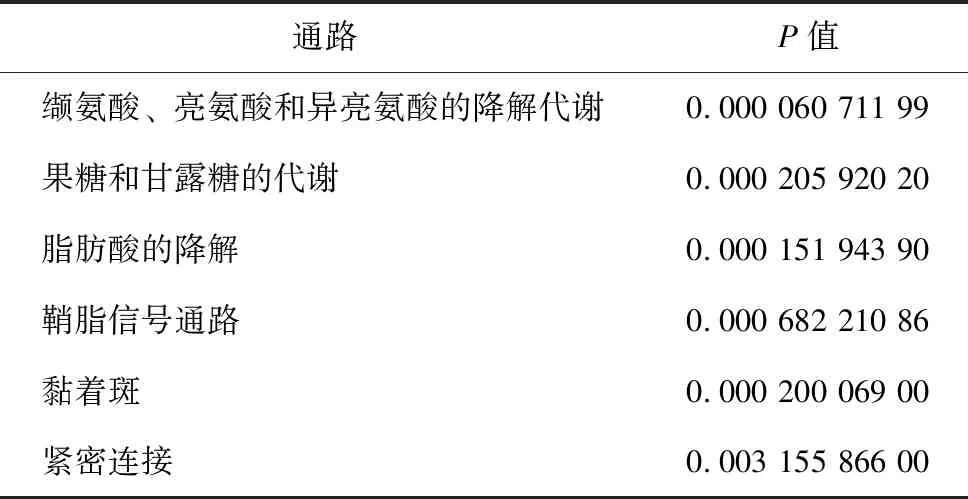
表4 对照组与回转组蚁蚕差异基因的KEGG通路富集分析
2.4 差异表达基因的体外验证
通过qRT-PCR进一步验证了对照组和回转组家蚕胚胎中筛选出的差异显著基因的表达情况。结果显示,与对照组相比,回转组胚胎中有机阳离子转运蛋白、突触囊泡糖蛋白2B、蜕皮甾体激酶22、组蛋白H1、卵巢丝氨酸蛋白酶异构体1、嗅觉受体16、保幼激素环氧化物水解酶样蛋白1、线粒体心磷脂水解酶同工酶x2以及生殖细胞发育必需的nanos-M基因的转录表达水平显著升高(图5)。以上结果表明,模拟失重可能通过调控上述基因的表达促进早期家蚕胚胎的发育。
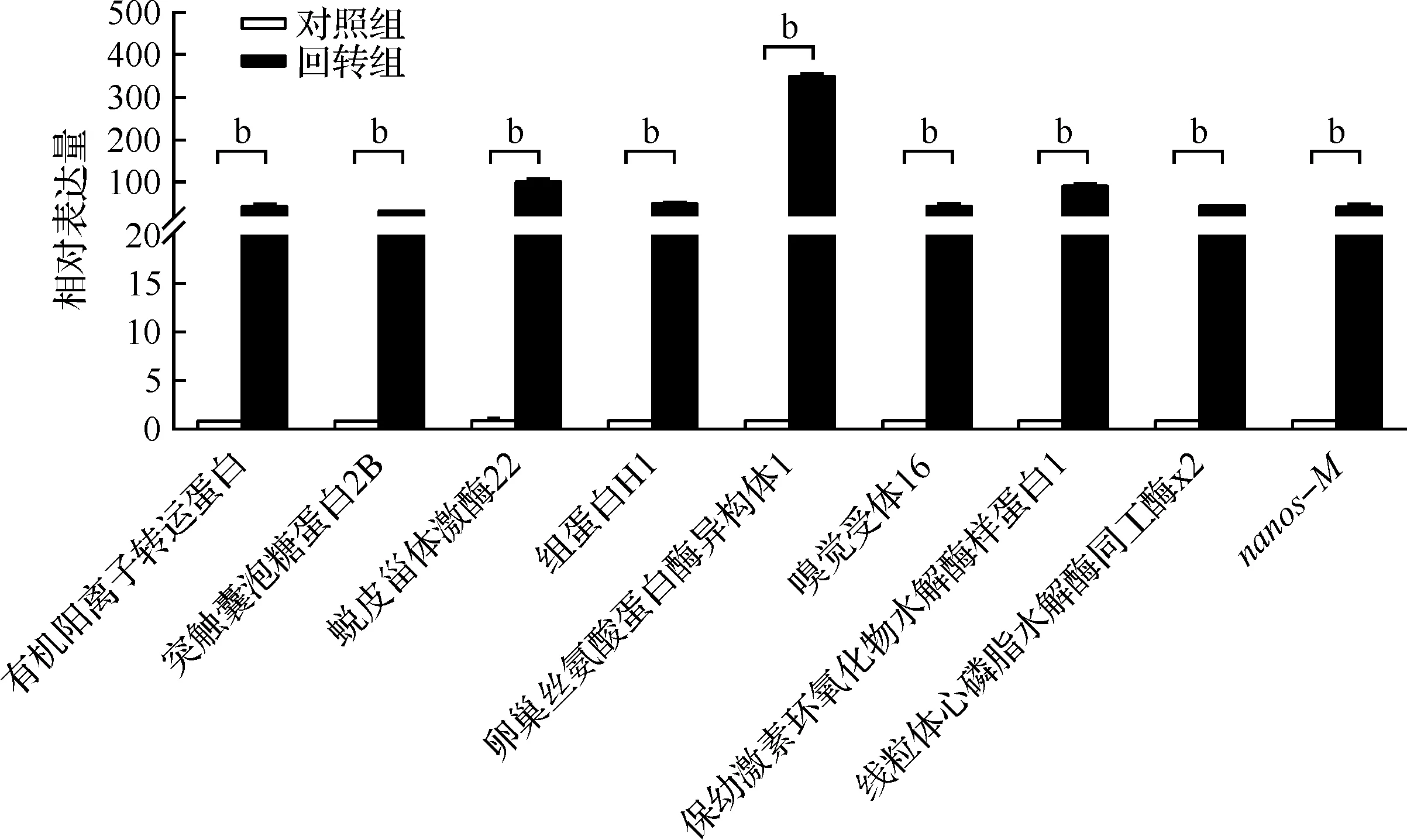
图5 模拟失重下家蚕胚胎相关基因的表达变化(bP<0.01)

qRT-PCR验证对照组与回转组蚁蚕中表达显著上调的基因(A)与下调的基因(B)。aP<0.05,bP<0.01。
此外,我们也利用qRT-PCR验证了筛选出的对照组与回转组蚁蚕差异显著基因的表达情况。结果发现,与对照组相比,回转组蚁蚕中葛老素2抗菌肽、肌醇加氧酶、胰蛋白酶、造血表达同源盒蛋白、胆固醇-25-羟化酶、toll样受体、氨肽酶N、甘氨酸转运蛋白1、脂多糖诱发肿瘤坏死因子α同族体、糜蛋白酶样丝氨酸蛋白酶前体基因的转录表达水平显著升高(图6A)。然而,表皮蛋白RR2、胶原蛋白α-1、msta多效蛋白样蛋白、胶原蛋白和钙结合表皮生长因子结构域基因的转录表达水平显著降低(图6B)。以上结果暗示,模拟失重可能通过促进或抑制上述基因的表达促使蚁蚕孵化时间提前。
3 讨论
本研究使用三维随机回转器模拟失重环境处理家蚕胚胎,发现模拟失重使家蚕胚胎发育提前。RNA-seq分析结果显示,模拟失重影响了家蚕胚胎中期和蚁蚕期基因的表达。随着在失重环境中暴露时间的延长,差异表达基因的数量以及这些基因所参与的富集通路数量也呈递增趋势。
目前,我国的空间站已经完成建造,并进入应用与发展阶段。随着航天员在轨时间的增加,他们所面临的环境也变得更加复杂,包括辐射、失重、振动噪声和昼夜节律的变化等。其中,失重作为一个重要的影响因素对航天员的身心健康产生影响[1-3]。然而,由于空间飞行实验机会少,在轨航天员数量有限,导致实验统计数据相对较少,无法满足对失重生物学效应进行深入研究的需求。因此,地面模拟失重研究成为一种重要的选择。在空间生物学领域,已经应用了多种地面模拟失重的研究方法,包括头低位卧床、后肢尾悬吊、水下模拟失重、回转模拟器、抗磁悬浮超导磁体、飞机抛物线飞行等[14-19]。而三维随机回转器具有占用空间小,能够长时间模拟失重环境的优势。因此,本研究选择采用三维随机回转器模拟失重。
家蚕胚胎是进行空间搭载和地面模拟失重实验的理想材料。家蚕胚胎在发育阶段细胞不断增殖和分化,形成各种器官,并且基因表达活跃,这些遗传信息可以反映整个家蚕生命过程。此外,家蚕具有很高的繁殖率,一只雌蛾可以产卵约400粒,这为实验提供了大量的胚胎材料。家蚕胚胎的孵化周期为10 d,在此期间它们不需要进食,为实验的连续开展提供了便利。家蚕的遗传背景清晰,早在2004年就已完成了家蚕全基因组测序[20],为后续的遗传分子实验奠定了基础。综上所述,家蚕胚胎具有许多优点,使其成为实验研究的理想材料。根据俄罗斯第10号生物卫星搭载中国蚕的实验结果显示,飞行组蚕卵的孵化时间比对照组早2~3 d,且航天飞行中滞育卵的孵化率高于对照组[7]。地面抗磁悬浮超导磁体模拟失重环境处理家蚕胚胎的实验结果显示,胚胎的孵化时间比正常蚕卵缩短了约3 d[21]。本研究发现三维回转模拟失重环境处理家蚕胚胎导致胚胎发育时间比对照组缩短。这些研究结果一致表明,失重处理能够缩短家蚕胚胎的发育时间。然而,失重对家蚕胚胎发育影响的潜在分子机制尚不明确。
本研究分别对家蚕胚胎中期和孵化期的对照组和回转组(模拟失重环境)样本进行了转录组测序分析。结果显示,随着失重环境处理时间的延长,差异表达基因数量增加,并且影响到更多的蛋白通路。这表明失重环境对家蚕胚胎的影响与处理时间呈正相关,而且在较长时间的处理下,影响的生物过程和通路范围更广泛。根据KEGG通路富集分析的结果,模拟失重对家蚕胚胎发育中期的核糖体和RNA转运通路产生影响。这两个通路是相互关联的,并在蛋白质合成和细胞功能中起着至关重要的作用[22]。因此,模拟失重可能会通过影响家蚕胚胎中期的蛋白质合成途径来促进胚胎发育。利用qRT-PCR进行验证,发现模拟失重导致家蚕胚胎相关基因表达显著增加。其中一些基因包括有机阳离子转运蛋白和突触囊泡糖蛋白2B基因,它们参与离子转运功能[23]。另外,蜕皮甾体22激酶和保幼激素环氧化物水解酶样蛋白1参与蜕皮功能的调控[24],卵巢丝氨酸蛋白酶异构体1和nanos-M参与性别调控[25],线粒体心磷脂水解酶同工酶x2参与代谢调控[26],嗅觉受体16参与嗅觉调控[27]。综合KEGG通路富集分析和体外实验结果,提示模拟失重通过调控早期家蚕胚胎中离子转运、蜕皮、性别、代谢和嗅觉关键基因的RNA转运和蛋白质合成来影响家蚕胚胎发育。这些发现有助于我们更好地理解模拟失重对生物体发育过程的影响机制。
对照组与回转组孵化的蚁蚕进行的KEGG通路富集分析显示,模拟失重处理后孵化的蚁蚕中代谢通路发生了显著变化。通过qRT-PCR验证发现,模拟失重导致蚁蚕中氨肽酶N和胆固醇-25-羟化酶的表达显著增加。氨肽酶N主要负责从蛋白质或肽段的N端逐个去除氨基酸残基,从而产生较短的肽段或游离氨基酸。这些肽段和游离氨基酸可以被其他酶和代谢途径利用,参与能量产生、氨基酸代谢和新的蛋白质合成等生物过程[28]。胆固醇-25-羟化酶则催化胆固醇的羟化反应,将其转化为25-羟基胆固醇,在胆固醇和脂质代谢中发挥重要作用[29]。这表明模拟失重可能通过调控家蚕胚胎末期氨肽酶N和25-羟基胆固醇基因的表达,影响家蚕的氨基酸和脂质代谢,从而最终影响胚胎发育。此外,模拟失重还导致孵化的蚁蚕中紧密连接和粘着斑通路发生了显著变化。模拟失重引起了蚁蚕中糜蛋白酶样丝氨酸蛋白酶前体和胰蛋白酶的表达显著增加。糜蛋白酶样丝氨酸蛋白酶参与了蛋白酶活化受体和基质金属蛋白酶-2的激活过程,并调节了紧密连接蛋白claudin-5的表达,从而维持肠上皮屏障功能的稳态[30]。而紧密连接位于相邻细胞间隙的顶端侧面,具有封闭细胞间隙,保持渗透性和维持细胞极性的功能[31]。另外,胰蛋白酶和糜蛋白酶在皮肤角质脱落过程中降解细胞间的粘附分子,促进皮肤细胞的脱落[32]。这提示模拟失重可能通过促进家蚕胚胎末期糜蛋白酶样丝氨酸蛋白酶和胰蛋白酶的表达,调控家蚕胚胎末期细胞的极性、渗透性和细胞粘附性,最终加速胚胎发育。
然而,目前对于模拟失重环境影响家蚕胚胎发育的具体分子网络调控机制还需进一步探究。尽管如此,我们相信本研究中对模拟失重环境对家蚕胚胎发育的影响以及基因表达特征的分析,将为空间生物学研究提供可靠的实验和理论基础。
