丹参-川芎-红花对颅脑损伤后大鼠抑郁-心脏损伤的多病研究*
2024-03-04高曌孙波蔡雅文黄熙
高曌,孙波,蔡雅文,黄熙
(南京中医药大学,南京 210023)
颅脑损伤(TBI)是一种临床中较常见的脑外伤类型,也被称为“沉默的流行病”。TBI 的严重程度根据格拉斯哥昏迷量表(GCS)进行评价:轻度13~15 分,中度9~12 分,重度≤8 分,病理学则多将TBI分为原发性TBI 与继发性TBI[1]。有研究在脑外伤后2 周开始对患者进行追踪测评,用GCS 表来评价患者的严重程度,汉密尔顿量表(HADS)评估抑郁水平,以谈话的方式进行评价。结果显示,TBI 会引发多种精神疾病,抑郁是TBI 后最主要的并发症之一[2]。此外,有研究发现一次脑震荡应激后大鼠,尤其是雄性大鼠即可出现抑郁表现[3],大鼠TBI 后4 d 出现抑郁样行为[4],还有研究通过评估TBI 后24 h 大鼠海马新生细胞水平以评估TBI 后抑郁发生情况[5]。TBI 后的水肿、神经胶质活化和周围免疫细胞浸润等继发性损伤机制导致细胞死亡和神经功能障碍,有医学影像学证实TBI 引发抑郁患者颞叶、顶叶和扣带区域与未引发抑郁患者相比体积显著变小[6]。此外,也有研究发现抑郁的发病率与TBI 的损伤程度并非正相关,反而是轻度脑损伤(mild TBI)更易引发抑郁。研究发现,mTBI 后1 年发生抑郁症的患病率为15.3%~18.0%,TBI 后1 年的抑郁发生率53.1%,在mTBI 后8 年高达61.0%。TBI 患者高发抑郁症的概率范围很广,约为15%~77%[7]。此外,有研究发现严重TBI 患者通常伴有心血管功能障碍[8],TBI 患者心脏的肌酸激酶同工酶(CK-MB)水平以不同于心肌梗死患者的方式升高[9]。认为TBI 可能是一种心脑同病的疾病,并对此进行探究。
研究选择的中药方剂丹参-川芎-红花(丹川红,DCH)是丹参、川芎、红花按2∶1∶1 组成的中药药队,其来源是陈可冀院士联合郭世魁老中医创建的中药复方冠心Ⅱ号。该方具有行气活血,祛瘀通络的功效,临床常用于治疗冠心病、胸闷不适等,研究发现该方及其主要吸收成分的阿魏酸(FA)具有通过抑制心肌细胞凋亡和半胱氨酸-天冬氨酸蛋白酶3(Caspase3)活性的方式减少梗死面积,提供了一种心脏保护作用[10]。研究发现,DCH 能发挥抗氧化、抗炎、增加冠状动脉流速的作用来有效治疗缺血性心脏病,并能改善心绞痛[11],还有证据表明,DCH 可以通过抗炎和神经保护作用有效缓解抑郁症指标,保护心脏免受炎症和细胞凋亡[12]。FA 是DCH 中用于大脑保护的主要吸收化合物[11],最近的1 项研究表明,FA 取代白藜芦醇是“法国悖论”的主要原因,即尽管高脂肪饮食,但葡萄酒和葡萄多酚的摄入与冠心病的发病率低有关,也证明FA 对心脏有显著的保护作用[13]。本课题组既往通过超高效液相色谱-质谱联用(UPLC-MS/MS)法测得DCH 中主要成分FA的质量浓度为(0.232±0.003)mg/mL,而DCH 临床治疗TBI 患者的剂量为1.5 g/kg(生药/体质量)。大鼠灌胃量为人的6.7 倍,故DCH 的大鼠灌胃剂量确定为10 g/kg,FA 的大鼠灌胃剂量确定为2 mg/kg,大鼠灌胃体积为1 mL/100 g。
本实验的造模方式,CCI(controlled cortical impact)造模是常用的TBI 造模方法,通过颅脑损伤仪TBI0310 进行打击,对大鼠造成中-轻度TBI[14-15]。有研究发现,TBI 后引起的海马损伤是TBI 后抑郁发生的重要原因[4,16],本实验因此选择使用研究最为广泛的海马作为TBI 后大鼠抑郁表现的研究对象。目前对于抑郁症的研究常用有强迫游泳测试、慢性轻度压力模型和习得性无助模型[17],但也有研究发现,即使是一次应激创伤也会引发精神病理学的变化,这一新的概念可以了解应激反应的适应与不适应轨迹的决定因素,以此研究抗抑郁药的机制[18]。还有研究表明,抑郁症与树突萎缩和树突棘缺失高度相关,特别是在包括海马在内的与情绪相关的大脑区域[19],因此选择海马神经元树突的密度和长度作为应激后抑郁发生的评价标准并对其改变的发生机制进行探究,同时,将心肌凋亡指标CK-MB 和Caspase3 作为心脏损伤的评价标准[9-10]。基于上述研究背景,认为DCH 和FA 可能对TBI 后的抑郁-心脏损伤具有调节作用,同时认为可能存在一种共享的途径以调控TBI 后的抑郁-心脏损伤共病,并在接下来的实验中对这一共享机制进行验证。
1 材料和方法
1.1 实验动物信息及分组 SD 大鼠,雄性,体质量约200~280 g;购于南京青紫蓝,产地:上海必凯科翼生物科技有限公司;动物许可证号:SCXK-2018-0006。所有动物的饲养和实验操作都严格遵守均遵循国家实验动物管理条例及南京中医药大学实验动物中心动物饲养和伦理委员会的指导方针,并报送南京中医药大学实验动物伦理委员会备案,实验动物伦理号:201912A017。大鼠在适应性喂养1 周后进行TBI 急性实验。随机把12 只雄性SD 大鼠分为4 组,每组3 只;对照组-假手术组(Sham):不击打直接缝合;模型组(TBI+Vehicle):造模后待苏醒灌胃生理盐水;DCH 组:造模后待苏醒灌胃10 g/kg DCH 汤剂;FA 组:造模后待苏醒灌胃2 mg/kg FA。
1.2 主要仪器及试剂耗材 颅脑创伤仪TBI0310Head Impactor(head trauma cont 公司,美国),超纯水系统(Millipore 实验室设备有限公司,美国),酶标仪全波长检测系统(Tecan TWINFINIE 200,瑞士),Allegra X-30 台式高速冷冻离心机(贝克曼库尔特有限公司,美国),HYCD-205 冷藏箱(海尔生物医疗公司,中国),-80 ℃超低温冰箱(三洋,日本),旋转蒸发仪(巩义市予华仪器有限责任公司)BSA2202S 型十万分之一天平(赛多利斯科学仪器有限公司,德国),Freezone-12L 冷冻干燥机(LABCONCO 公司,美国),正置荧光显微镜(Zeiss 公司,德国),冰冻切片机(Thermo 公司,美国),伊文斯蓝、甲酰胺、中性树脂(北京索莱宝科技有限公司,中国),50%/75%/95%/无水乙醇、二甲苯(国药集团化学试剂有限公司,中国),FD 快速高尔基染色试剂盒(FD Neuro technologies,inc,美国),5-羟色胺(5-HT)、Ghrelin试剂盒(南京奥青生物技术有限公司,中国),c-Fos试剂盒(Kendall Scientific,美国),脑源性神经营养因子(BDNF,Rabbit,抗体货号:28205-1-AP),Caspase3(Rabbit,抗体货号:ab32351),CK -MB(Rabbit,抗体货号:15137-1-AP),GAPDH(Rabbit,抗体货号:10494-1-AP),辣根过氧化物酶(HRP)[Goat anti-Rabbit IgG (H+L)Secondary Antibody,抗体货号:AWS0002],阿魏酸(南京景竹)。
1.3 中药DCH 汤剂、冻干粉制备 用天平称量丹参(批号:20032901,长沙湘雅医院,山东)68 g,川芎(批号:200525,长沙湘雅医院,四川)34 g 和红花(批号:19040296,长沙湘雅医院,新疆)34 g 置于不锈钢锅中,按1∶12 加纯水浸泡30 min,用武火煮沸,文火煮30 min。8 层纱布过滤,得滤液。再加12 倍体积纯水,重复上述方法,合并两次药液。用旋转蒸发仪将药液浓缩。取适量液氮将药液均匀冷冻,放入冻干机冷冻干燥24 h,取下。冻干粉得率(%)=冻干粉质量/中药质量×100%=45.33%。实验前称取冻干粉适量,配成体积适量的浓度为10 g/kg(生药)的DCH 药液。
1.4 CCI 造模 使用异氟烷气体麻醉大鼠,诱导麻醉流量3 mL,麻醉时间3 min。用小动物剃毛机剃去在两后眼角连线到耳部连线部位毛发。麻醉后放上手术台,手术台上垫上保温垫,大鼠固定在立体视框架中,并在维持2%异氟烷吸入的情况下,先将头部皮肤剪开,用干棉球擦破黏膜暴露颅骨。在人字缝右边,前后囟间右侧象限,打开一个骨窗,暴露硬脑膜。在颅脑创伤仪TBI0310Head Impactor 上设置好深度速度、停留时间,使用TBI 打击造成中-轻度损伤(速度:5 m/s,停留时间:2 000 msec,深度:3 mm)[14-15]。然后将头部伤口缝合,在伤口涂上碘伏,将老鼠放在保温垫上待苏醒后灌胃。造模后存活率100%。
1.5 高尔基染色及分析法 大鼠腹腔取血后取出整个脑组织,在双蒸馏水中冲洗血液。使用FD 快速高尔基氏染色试剂盒按照要求进行染色。染色结束后室温晾干,在正置荧光显微镜下观察并拍摄图片。使用Image J 对神经元照片进行树突棘密度(Spine density)和树突长度的计数分析。树突棘密度是由End-pooint voxels 除以Longest Shortest Path 计算得出,数据结果通常以树突棘数/10 μm(Spines/10 μm)表示。树突的长度是通过对目标神经元树突描摹后进行测量,其结果为来自一个神经元的树突长度的总和,二值化后获取神经元树突骨骼图。
1.6 制备大鼠血清、海马、心脏样本 持续吸入异氟烷麻醉状态下对大鼠进行腹腔取血,取血后断头处死,将脑置于冰盒上,剥离海马、心脏,胃、小肠,用超纯水冲洗干净。吸干表面的液体,放入冻存管中经液氮速冻,后存放于-80 ℃超低温冰箱待检。血液放入离心机,在3 500 r/min 离心15 min,离心半径为10 cm,取上清液存于EP 管,保存在-80 ℃冰箱。
1.7 ELISA 检测 对各组大鼠血清、海马和心脏样本处理后,按照ELISA 试剂盒的步骤进行检测。指标包括:血清、海马、心脏:c-Fos、Ghrelin;血清:5-HT、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β和IL-6;心脏:内皮型一氧化氮合酶(eNOS)。
1.8 蛋白免疫印迹法(Western blot)检测方法 组织蛋白提取后进行电泳,电泳结束后转膜清洗,用1×磷酸盐吐温缓冲液(PBST)配制5%脱脂奶粉,将膜浸入后,室温放置90 min,而后用一抗孵育90 min后4℃过夜,二抗室温孵育90 min。ECL 显色曝光。指标包括海马:BDNF;心脏:BDNF、CK-MB、Caspase3。
1.9 数据处理及统计学方法 所有数据均采用graphpad prism 9 软件进行统计分析和作图。计量资料以均值±标准误(Mean±SEM)表示。多组间计量资料的比较采用单因素方差分析(one-way ANOVA),多重比较采用Dunnett’s 检验。P<0.05 为差异有统计学意义。
2 实验结果
2.1 TBI 应激前后及给药后大鼠海马树突棘密度变化比较 TBI 应激后Vehicle 组树突棘密度显著降低,给药后给药组树突棘密度有所恢复。证明急性应激TBI 会导致海马树突棘密度变小,给药后有一定恢复效果。见图1。

图1 TBI 应激前后及给药后海马树突棘密度对比(树突棘数/10 μm,n=3)Fig.1 Comparison of dendritic spine density in hippocampus before and after TBI stress and after drug administration (Spines/10 μm,n=3)
2.2 TBI 应激前后及给药后大鼠海马树突长度比较 TBI 造模后Vehicle 组树突长度降低,给药后给药组树突长度有所恢复,证明TBI 急性应激会导致海马树突长度变短,给药后有一定恢复效果。见图2。
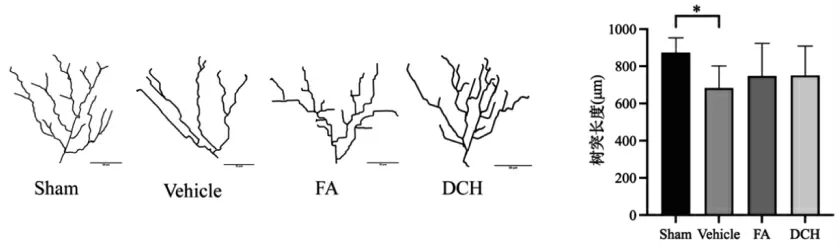
图2 TBI 前后及给药后海马神经元长度比较(50 μm,n=3)Fig.2 Comparison of hippocampal neuron length before and after TBI and after drug administration(50 μm,n=3)
2.3 TBI 应激前后及给药后大鼠血清相关指标水平差异比较 研究发现,炎性因子对海马神经元突触可塑性具有调控的作用,并因此对神经系统疾病产生影响[20]。TBI 应激后,与Sham 组相比,大鼠血清中炎症因子IL-1β、IL-6、TNF-α 均有显著增加(P<0.000 1),给药DCH 和FA 后炎性因子水平均显著降低。血清5-HT 水平可以反映抑郁发生的情况,TBI 后大鼠血清5-HT 水平显著降低,给药后水平升高。见图3。
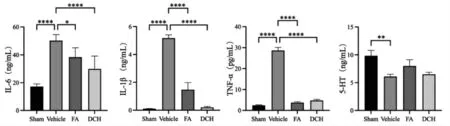
图3 TBI 应激前后及给药后大鼠血清炎性因子水平差异比较(n=3)Fig.3 Comparison of serum inflammatory factors in rats before and after TBI stress and after drug administration(n=3)
2.4 TBI 应激前后及给药后大鼠心脏相关指标水平差异比较 研究发现eNOS 对血管内皮具有重要的保护作用[21],eNOS 水平可以反映应激后心脏损伤的程度。大鼠TBI 应激后心脏eNOS 水平明显降低,在给药后eNOS 升高。心肌损伤指标CK-MB 和心肌凋亡指标Caspase3 均可反映心脏的损伤水平。TBI 应激后心脏CK-MB 和Caspase3 水平明显均明显上升趋势,在给药后有不同程度的下降趋势。见图4。
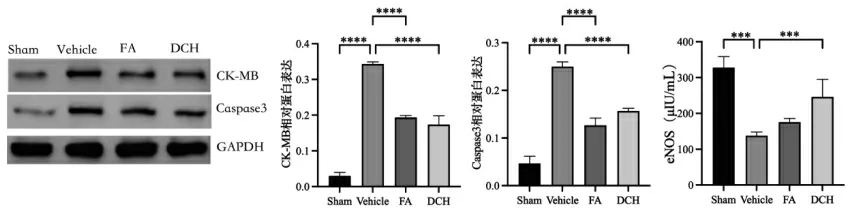
图4 TBI 应激前后及给药后大鼠心脏eNOS,CK-MB 和Caspase3 水平差异比较(n=3)Fig.4 Comparison of eNOS,CK-MB and Caspase3 levels in rat heart before and after TBI stress and after drug administration(n=3)
2.5 TBI 应激前后及给药后大鼠血清、海马、心脏c-Fos 表达比较 TBI 应激后大鼠血清、海马、心脏c-Fos 表达均呈现明显上升趋势,给药后减少。见图5。

图5 TBI 应激前后及给药后大鼠血清、海马、心脏c-Fos 表达(n=3)Fig.5 Expression of c-Fos in serum,hippocampus and heart of rats before and after TBI stress and after drug administration(n=3)
2.6 TBI 应激前后及给药后大鼠血清、海马、心脏Ghrelin 表达比较 TBI 应激后大鼠血清、海马、心脏Ghrelin 表达,呈现为TBI 应激后大鼠海马Ghrelin明显下降,给药后上升。见图6。

图6 TBI 应激前后及给药后大鼠血清、海马、心脏Ghrelin 表达(n=3)Fig.6 Expression of Ghrelin in serum,hippocampus and heart of rats before and after TBI stress and after drug administration(n=3)
2.7 TBI 应激前后及给药后大鼠海马、心脏BDNF 表达比较 大鼠TBI 后海马、心脏中BDNF 水平明显降低,在给药后BDNF 有不同程度的上升。见图7。

图7 TBI 应激前后及给药后大鼠海马、心脏BDNF 表达(n=3)Fig.7 Expression of BDNF in hippocampus and heart of rats before and after TBI stress and after drug administration(n=3)
3 讨论
尽管已有研究认识到TBI 与心血管病变发生之间具有相关性[22],对于TBI 后抑郁-心脏损伤多病发生的机制依旧并不明确,本实验对TBI 后抑郁-心脏损伤的机制探究基于多病这一概念。越来越多的医学研究者将目光放在多病这一概念上,有报道对苏黎世大学医院内科急诊患者进行研究[23],发现内科临床住院患者约有70%~90%为多病患者[24]。以冠心病为例,约有83%以上的冠心病患者为多病人群,即同时主要合并有两个及以上的疾病表现[25]。
有研究表明,抑郁症与树突萎缩和树突棘缺失高度相关,特别是在包括海马在内的与情绪相关的大脑区域[26-27],本研究通过对TBI 后大鼠海马的精神病理研究,发现TBI 应激后大鼠海马树突长度、树突棘密度显著减少,给药DCH 和FA 后这一情况有所缓解。TBI 应激后显著增加的血清促炎性指标(IL-1β、IL-6 和TNF-α)也在给药后降低,说明给药后可以通过对突触可塑性发挥作用以发挥抗抑郁作用。此外,心脏eNOS 应激后水平下降,心脏损伤指标CK-MB 和Caspase3 显著上升,给药后逆转,表明给药后心脏损伤问题有改善。上述结果一定程度上体现了DCH 和FA 的抗抑郁和心脏保护作用。
c-Fos 作为信号传导系统的第三信使对细胞的生长、分化和功能活动至关重要,通常通过对不同脑区表达量的分析用来识别神经元的活动情况来描绘在使用精神活性化合物治疗后被调节的神经元回路[28-29]。c-Fos 的短暂激活伴随着皮层脑损伤,其表现类似于抑郁症的发展[30],同时还对神经的可塑性产生作用[31]。研究发现,c-Fos 的异常高表达可能是高血压病、动脉粥样硬化等心血管疾病的发病原因之一[32]。在本实验对TBI 应激及给药前后大鼠血清、海马、心脏均进行了c-Fos 水平的检测,发现c-Fos 在各个组织的表达具有一致性,即应激后的模型组c-Fos 在各个组织的表达量最高,给药后c-Fos 表达一定程度上有所减少。在海马中,FA 和DCH 均显著降低了应激后大鼠的c-Fos 水平,一定程度上证明治疗对应激后的脑具有重要的保护作用,缓解了突触可塑性的损伤加重程度,在心脏中也具有缓解应激损伤的作用。
Ghrelin 是一种胃肠道分泌生成的生长激素释放肽。有研究认为Ghrelin 可以通过与生长激素促分泌激素受体的结合而发挥作用参与调节多种生命活动进程,对许多疾病产生有益影响[33]。Ghrelin可以通过调节海马突触可塑性改善患者的抑郁状态[34],可以改善心脏功能和重塑,预防严重的心律失常,促进心肌梗死后的重塑[35]。本实验对TBI 应激及给药前后大鼠血清、海马、心脏均进行了Ghrelin 水平的检测,发现Ghrelin 在各个组织的表达具有一致性,即TBI 后的模型组c-Fos 表达量最低,给药后Ghrelin 表达一定程度上有所增加。
BDNF 是一种脑源性神经营养因子,具有调控神经元突触可塑性的能力,有研究发现,BDNF 的上调可能会逆转成人大脑中应激诱导的结构和突触可塑性缺陷[36],在抑郁症患者血液中低水平表达,予抗抑郁药物后明显增加[37]。BDNF 在对血管内皮细胞的生长、发育,以及缺血内皮细胞增殖、移行的过程中同样起着重要的作用[38],有研究发现BDNF 可以降低氧化应激和细胞凋亡,并通过激活eNOS/一氧化氮(NO)通路,保护心脏免受感染性心功能不全的损害[39]。还有研究发现,Ghrelin 可以通过环磷酸腺苷(cAMP)/环磷酸腺苷效应元件结合蛋白(CREB)通路调节BDNF 的表达[40]。本实验中,给药后显著增加应激后TBI 大鼠的BDNF 的表达,可能是通过调节Ghrelin 水平,使BNDF 表达量增加,对突触可塑性产生影响,减轻了TBI 大鼠的抑郁样行为,同时在心脏发挥保护作用。
基于上述研究结果,研究发现TBI 后的抑郁-心脏损伤具有多病发作的特征,Ghrelin-BDNF/c-Fos 可能是抑郁-心脏损伤的共享途径,其发生机制可能是在TBI 应激后,在脑中,海马中Ghrelin 水平降低,导致BDNF 水平降低,脑保护作用减弱,同时Ghrelin 对c-Fos 的表达抑制效果减弱,表现为c-Fos表达量剧增后诱导的炎性因子增多,对突触可塑性造成损伤,海马树突长度、树突棘密度减少,抑郁发生。与此同时,在心脏中,应激后Ghrelin 减少导致BDNF 减少,eNOS 减少,心脏保护能力减弱,心脏保护能力减弱,与此同时c-Fos 高表达损伤了心肌细胞和内皮细胞,对心脏造成了负面影响。DCH 及主要吸收成分FA 可能是通过对这一调控途径的调节改善了抑郁-心脏损伤的多病病变,值得进一步研究。