不同碳源下共存细菌对铜绿微囊藻生长的影响
2024-03-04孙华龙陈国炜吴雪菲方志鹏
孙华龙, 陈国炜, 吴雪菲, 方志鹏, 贾 伟, 刘 丽
(合肥工业大学 土木与水利工程学院,安徽 合肥 230009)
蓝藻有害藻华对水资源和人类健康的影响已成为21世纪全球关注的主要问题[1-2]。在过去的几十年里,由于蓝藻的存在,我国经历了几次水危机事件[3]。当水体中藻华开始腐烂时,耗氧量增加,水体中的生物大量死亡,进而加剧水体污染[4]。因此,对藻类的生长控制一直是水体富营养化及藻华治理的主要目标[5]。
藻类在大量繁殖的同时,会与其他细菌发生相互作用[6-7],两者可能为争夺营养物质及生存空间发生相互抑制的竞争关系[8],也会进行营养互补的有益相互作用[9],这些关系会随环境中生物因素或非生物因素的变化而改变。其中,碳源对微生物的生长与竞争具有重要作用[10]。然而,对碳源等条件如何影响菌藻关系仍需深入研究。
文献[11]表明,许多微藻体内的二氧化碳浓缩机制(carbon concentrating mechanism,CCM)已进化为一种适应机制,可以帮助微藻提高碳同化效率,以克服其自然环境中经常出现的二氧化碳可利用性有限的挑战。在大多数情况下,污水厂对污水的处理仅仅聚焦于有机碳的去除,往往忽略了无机碳的存在,而铜绿微囊藻(Microcystisaeruginosa)既是蓝藻水华的主要优势藻种[12-13],也通过CCM利用水环境中的无机碳进行光合作用固碳来促进自身的生长[14]。因此本文选取藻铜绿微囊藻作为研究藻种,菌种选自含有与铜绿微囊藻有作用菌属的活性污泥。
本文将从不同碳源组合下的菌藻互作机制出发,以菌藻体系为研究对象,选取铜绿微囊藻和活性污泥细菌,探究在不同碳源组合下共存细菌对铜绿微囊藻生长的影响,研究结果将为淡水藻华的治理提供一定的理论依据。
1 材料与方法
1.1 实验藻种
实验采用藻种为铜绿微囊藻(FACHB-905),购自中国科学院水生生物研究所淡水藻种库(武汉),培养于BSG400人工气候培养箱(博讯,上海)中,设置培养箱温度为(25±1) ℃,光照强度为2 000 lux,光暗比为12 h/12 h,接种后瓶口用已灭好菌的透气膜进行封口处理。铜绿微囊藻的接种与培养均采用BG11液体培养基,培养时每天摇动2~3次,使藻细胞充分吸收营养物质,并避免微藻的沉积[15]。
1.2 实验菌种
实验中采用活性污泥混合菌为实验菌种,活性污泥取自合肥工业大学市政工程系SBR反应器。原始污泥群落中气单胞菌属Aeromonas数量最多,其次是噬氢菌Hydrogenophaga铁杆菌属Ferruginibacte和装甲菌纲uncultured-bacterium-f-Fimbriimonadaceae[16],由于活性污泥一直处于曝气状态,初始活性污泥的群落也会随之变化,经LB培养后群落以气单胞菌属Aeromonas、邻单胞菌属Plesiomonas、克雷白氏杆菌属Klebsiella为主[17]。
取出0.5 mL活性污泥混合液接种至含有250 mL经过灭菌的LB培养基的500 mL锥形瓶中,在培养箱中37 ℃恒温培养16 h;培养完成后各取40 mL加入到6个50 mL离心管中,在5804高速离心机中(Eppendorf,德国)3 600 r/min离心10 min后,弃去上清液并使用磷酸盐缓冲液重悬清洗,再次以3 600 r/min离心10 min,重复2次以完全去除LB培养基;最后将每个离心管的底物溶解定容到40 mL,各取1 mL细菌悬液分别稀释1 000、2 000、5 000、10 000倍,用活死染色法进行细菌计数,确定污泥细菌的密度[18]。
1.3 实验设置
为探究细菌及碳源对铜绿微囊藻生长的影响,实验设置无机碳源、有机碳源和混合碳源3种不同的碳源,选用NaHCO3作为无机碳源,葡萄糖作为有机碳源,初始总碳(total carbon,TC)质量浓度设为25 mg/L,并设置4种不同的初始菌藻比(0、1∶2、1∶1、5∶1),实验组别依次为1、2、3、4,探究不同碳源对铜绿微囊藻生长的影响;对照组是体系不加入任何外源碳源仅与大气进行气体交换的实验。各组还可探究相同碳源的不同初始菌藻比对铜绿微囊藻生长的影响。实验在人工气候箱中进行,人工气候箱设置条件与藻种培养条件一致。
实验组1。使用4个500 mL玻璃锥形瓶作为反应器,向4个锥形瓶中各加入300 mL培养液重悬稀释生长至对数期的藻液,使得微藻初始生物量约为4.1×106个/mL(A680=0.18)。向其中3个锥形瓶中分别加入NaHCO3(52.5 mg)、葡萄糖(18.75 mg)、NaHCO3(26.25 mg)+葡萄糖(9.375 mg)3种碳源。
实验组2。向每个锥形瓶中加入1.5 mL的菌液(细菌生物量为4×108个/mL),使得初始菌藻比为1∶2。其余实验设置均与实验组1相同。
实验组3。除初始菌藻比为1∶1外,其余实验设置均与实验组2相同。
实验组4。除初始菌藻比为5∶1外,其余实验设置均与实验组2相同。
对照组。以不加入任何外源碳源在上述4种不同初始菌藻比的培养液中培养。各组实验设置3个平行样,以减小实验误差。
实验时所用培养液及组分A、B的成分分别见表1、表2所列。

表2 组分A和组分B的成分
1.4 分析方法
1.4.1 藻细胞数量的测定
藻细胞数量的测定用血细胞计数法[19]。从锥形瓶中取摇匀的样品藻液3 mL于离心管中。取适量的藻液滴入血球计数板上的计数池,并置于显微镜下,通过显微镜观察计数池内的藻细胞数量,计算得出藻液中的藻细胞密度。
1.4.2 叶绿素a质量浓度的测定
叶绿素a质量浓度使用可见光分光光度计比色法测定[20]。首先,从锥形瓶中取摇匀的藻液10 mL以4 000 r/min的转速离心10 min,去掉上清液;其次,将微藻重新悬浮在90%丙酮(10 mL)中,在4 ℃黑暗中保存24 h;最后,将悬浮液在4 000 r/min下离心15 min。收集上清液,用于测定叶绿素a质量浓度。使用紫外分光光度计测定波长为630、645、663、750 nm下收集的上清液的吸光度A。使用90%丙酮溶液作为空白对照。叶绿素a的质量浓度公式为:
ρa=[11.64(A663-A750)-2.16(A645-
A750)+0.10(A630-A750)]V′/V
(1)
其中:V′为丙酮体积;V为样品体积。
1.4.3 碳酸盐体系的测定
实验采用滴定法测定微藻培养液中碳酸盐体系(CO32-和HCO3-)的质量浓度[19]。从锥形瓶中取摇匀样品藻液5 mL于离心管中,使用0.22 μm的滤膜过滤收集上清液于250 mL锥形瓶中,加入45 mL超纯水稀释水样。滴加2滴酚酞指示剂,振荡均匀,如出现红色,继续使用0.005 mol/L的盐酸标准溶液滴定至溶液红色刚刚消失,记录盐酸标准溶液的用量V1。然后在此无色溶液中滴加2滴甲基橙指示剂,振荡均匀,溶液呈黄色,继续使用0.005 mol/L的盐酸标准溶液滴定至橙色,记录盐酸标准溶液的用量V2。水样中CO32-和HCO3-的质量浓度公式为:
(2)
(3)
其中:c为盐酸标准溶液的浓度;V0为所取水样的体积;60.01 g/mol为CO32-的摩尔质量;61.017 g/mol为HCO3-的摩尔质量。
2 结果与分析
2.1 不同菌藻比下铜绿微囊藻的生长情况
初始菌藻比对铜绿微囊藻在不同营养条件下的生长有不同程度的影响,如图1所示。

图1 细菌对铜绿微囊藻生长的影响
由图1a可知,在无外源碳源的加入时,初始菌藻比从0增加到1∶1,铜绿微囊藻生长速度也随之加快。当初始菌藻比为1∶1时,铜绿微囊藻可预测的最大生物量为2.1×107个/mL,相较于纯藻体系提升33.84%;其次在初始菌藻比为1∶2和5∶1时,可预测的最大生物量分别为1.8×107个/mL和1.7×107个/mL,比纯藻体系分别提升12.81%、8.67%。
由图1c可知,加入25 mg/L的葡萄糖时,在有细菌加入的情况下,随着初始菌藻比的增大,铜绿微囊藻生长速度逐渐降低。初始菌藻比为1∶2时,铜绿微囊藻有最大预测生物量,培养周期内可预测的最大生物量为4.0×107个/mL;初始菌藻比为1∶1时,培养周期内可预测的最大生物量为3.3×107个/mL;当初始菌藻比增大到5∶1时,培养周期内可预测的最大生物量为1.5×107个/mL。而纯藻对照组,实验周期内可预测的最大生物量为2.0×107个/mL。3组加入了细菌的最大生物量分别是对照组的2.05、1.70、0.76倍。
2.2 叶绿素a的质量浓度
铜绿微囊藻叶绿素a质量浓度如图2所示。各组的叶绿素a质量浓度随着时间的延长而增加,并且在无有机碳源存在的情况下,随着初始菌藻比的升高,叶绿素a质量浓度也随之增大;而在有有机碳源存在的情况下,随着初始菌藻比的升高,叶绿素a质量浓度随之降低。
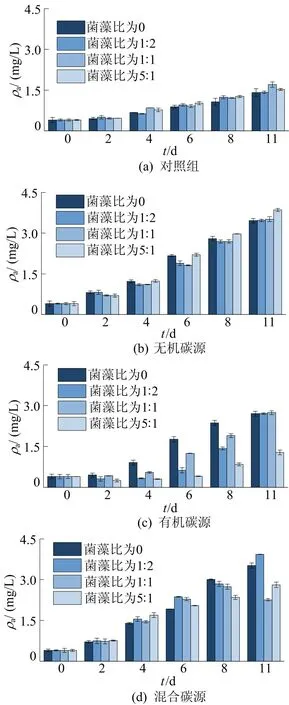
图2 不同菌藻比下铜绿微囊藻叶绿素a的质量浓度
各组叶绿素a质量浓度均在第2 天后快速升高,并在第11 天获得最大叶绿素a质量浓度。
由图2a可知:在无外源碳源加入时,初始菌藻比为1∶1组的叶绿素a质量浓度最大,实验末期时为1.70 mg/L,最小的是纯藻对照组,实验末期时为1.41 mg/L。各组之间无显著差异。
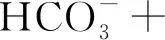
2.3 碳源的吸收

图3 不同菌藻比下的质量浓度变化情况
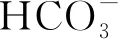

图4 不同菌藻比下质量浓度的变化情况

3 讨 论
本文研究在不同初始菌藻比下,3种碳源营养条件对铜绿微囊藻生长的影响。结果表明,不同碳源条件下初始细菌的出现会极大地影响铜绿微囊藻生长。一方面不同菌属对铜绿微囊藻生长的影响不同,如Rhizobium可以通过固氮作用为微藻提供氮源,促进微藻生长[21];Bacillus、Sphingomonas等可以刺激微藻分泌更多微量营养素代谢物来刺激藻类代谢[22],如维生素B12、植物激素(如IAA、脱落酸、细胞分裂素、乙烯和赤霉素)来刺激铜绿微囊藻的生长[23-24]。但许多链霉菌属Streptomyces,(如S.achromogenes[25]、S.phaeofaciens[26]、S.jiujiangensis[27]等可以分泌含氨基的抑藻物质如蛋白质[28]、赖氨酸[26]和含有赖氨酸的多肽[29])抑制铜绿微囊藻的生长。另一方面,不同碳源对微藻的生长也不相同。
在无机碳源和混合碳源的营养条件下,细菌的出现会极大促进铜绿微囊藻的生长繁殖。这由于细菌与铜绿微囊藻之间存在互利共生的关系,细菌可利用铜绿微囊藻光合作用产生的氧气参与细胞内的物质能量代谢[24],还可防止培养液内的溶解氧过高而抑制铜绿微囊藻的生长。铜绿微囊藻可以利用细菌呼吸作用产生的CO2作为自身光合作用的无机碳源,同时细菌分泌的一些信号分子(如IAA)也会促进铜绿微囊藻的生长[30]。
而当有外源无机碳源碳酸氢盐的加入时,因碳酸氢盐在水中溶解度较高,且与HCO3-相比CO32-对光合作用没有明显的促进或抑制作用,故而HCO3-易被微藻大量吸收利用[31]。在加入碳酸氢钠后,微藻的生物量随着初始碳酸氢钠的质量浓度增加而增大,细菌与铜绿微囊藻之间的物质交换增大了铜绿微囊藻的光合作用效率[32],促进了叶绿素a的合成[33],使得铜绿微囊藻生长变快。因此,在适宜的质量浓度下,细菌的加入有利于铜绿微囊藻的生长。
不同有机碳对铜绿微囊藻生长的影响不同。文献[34]研究了不同浓度有机碳源(葡萄糖、丙酮酸、乙酸、α-酮戊二酸)对铜绿微囊藻产毒的影响,研究表明,碳浓度较低尤其是葡萄糖及α-酮戊二酸处理时毒性水平下降,而当碳浓度提高时,毒性则降到最低。藻类体内的特殊运送系统能主动吸收不同有机碳源[35]。藻细胞对于利用何种有机碳化合物以及利用的程度也具有偏爱性[36]。文献[37]表明,可溶性有机碳对铜绿微囊藻生长更有利。适当浓度的葡萄糖能够促进铜绿微囊藻生长,过高浓度则会抑制[38]。
实验中在有机碳源的营养条件下,适量初始细菌比(如菌藻比为1∶2和1∶1)会促进铜绿微囊藻生长,但细菌数超过一定阀值便会抑制铜绿微囊藻的生长。这是由于细菌与铜绿微囊藻之间不仅是互利共生的关系,更在某些方面也存在着竞争[6]。在有外源有机碳源的加入且细菌的质量浓度过大时,细菌快速增殖,一方面压榨了铜绿微囊藻的生存空间,遮挡光照,阻碍了铜绿微囊藻对于光能的固定利用[39];另一方面,细菌的质量浓度过大时,铜绿微囊藻为细菌提供营养物质的压力也随之变大,铜绿微囊藻的生长相对变慢[40]。本实验中N和P元素在实验周期内基本不受限制,因此对铜绿微囊藻叶绿素a的合成没有影响。
4 结 论
1) 在不同初始菌藻比下,外源碳源的存在均会影响铜绿微囊藻的生长。在TC质量浓度为25 mg/L条件下,外源无机碳和混合碳源对铜绿微囊藻生长的促进较作用较为明显,经11 d培养铜绿微囊藻生物量可达(1.97~3.98)×107个/mL,显著高于对照组的(1.44~1.74)×107个/mL,细菌的加入显著促进了铜绿微囊藻的生长。而当外源碳源为葡萄糖时,随着初始菌藻比的增大,细菌的大量增殖,微藻的生长逐渐受到抑制。初始菌藻比从1∶2增大到5∶1,经过11 d培养铜绿微囊藻生物量从2.75×107个/mL降低到1.32×107个/mL,甚至小于纯藻对照组。
2) 在外源无机碳源和混合碳源组经11 d的培养后,叶绿素a质量浓度(2.26~3.94) mg/L,均明显高于对照组(1.41~1.70) mg/L,其中对叶绿素a合成影响最大的是HCO3-。无机碳源是铜绿微囊藻光合作用的重要原料,其明显影响了叶绿素的合成。在纯无机碳条件培养下,随着初始菌藻比的升高,铜绿微囊藻的叶绿素a质量浓度越高。当外源碳源为葡萄糖时,随着初始菌藻比的升高,铜绿微囊藻叶绿素a质量浓度越低,其质量浓度从2.72 mg/L降低至1.29 mg/L。在混合碳源条件培养下,初始菌藻比过高也会相对抑制铜绿微囊藻叶绿素a的合成。
