超声辅助酶法制备黑水虻抗菌肽的工艺优化
2024-03-04胡文举孙英菲孙玲利
■ 胡文举 孙英菲 孙玲利
(1.郑州信息科技职业学院,河南郑州 450046;2.河南农业职业学院,河南郑州 451450)
抗菌肽是宿主天然免疫系统的构成成分之一,广泛存在于生物体内[1],目前,已经在昆虫、真菌、节肢动物中分离出了具有良好抗菌、抗病毒、特异性抑制肿瘤细胞的抗菌肽[2-4]。研究表明,抗菌肽在高等动物体内具有抑菌、促生长、抗氧化、调节肠道菌群和免疫功能的作用[5-6],且无毒副作用、不产生耐药性,是理想的绿色高效饲用替抗产品[7]。
黑水虻(Hermetiaillucens)又称亮斑扁角水虻,是双翅目科食腐性昆虫,在全世界广泛分布,其幼虫繁殖周期短、群体产量高、营养成分丰富是联合国粮农组织推荐的可饲用昆虫之一[8]。将黑水虻幼虫暴露于高浓度有害微生物或者不良环境中,可诱使其产生抗菌肽来抵抗病原微生物[9]。王龙等[10]利用超滤法、张守玉等[11]利用酸溶碱提法、胡漂琪等[12]利用甲醇提取法,均成功在黑水虻幼虫体内获取具有良好抑菌效果的抗菌肽。
超声辅助酶解法是利用超声波机械效应和空化效应加速蛋白质水解反应而制备抗菌肽[13],具有反应条件温和,抗菌肽得率高,抑菌活性强等特点,被研究者广泛关注。许依能等[7]利用超声辅助酶法成功在南极磷虾中提取了抗菌肽,抗菌肽得率达到了51.24%,抑菌圈直径为20.8 mm,均显著高于传统提取方法。本研究利用响应面设计优化超声辅助酶法制备黑水虻抗菌肽制备工艺,以期提高黑水虻抗菌肽得率,旨在为黑水虻高附加值产品的产业化开发提供参考。
1 材料与方法
1.1 试验材料
黑水虻虫卵由河南某生物安全技术有限公司提供;金黄色葡萄球菌、大肠杆菌菌株购自中国普通微生物菌种保藏管理中心。
1.2 主要试剂
胃蛋白酶(200 U/mg)、胰蛋白酶(200 U/mg)、中性蛋白酶(200 U/mg)、木瓜蛋白酶(200 U/mg)购自合肥博美生物科技有限责任公司;LB 培养基购自杭州微生物试剂有限公司。
1.3 主要仪器设备
HWS-150 恒温恒湿细菌培养箱,上海森信实验仪器有限公司;202-0ES 型电热恒温干燥箱,北京市永明医疗仪器有限公司;TDL-80-2B 离心机,上海安亭科学仪器厂;MKZ-G2A 真空冷冻干燥箱,青岛迈可威微波创新科技有限公司;超低温冰箱MD-86L58,美的集团股份有限公司。
1.4 试验方法
1.4.1 黑水虻幼虫的饲养与处理
黑水虻虫卵在28 ℃、70%相对湿度条件下,孵化72 h。在20~25 ℃条件下,将孵化的黑水虻幼虫以含水量70%的麸皮为基质,继续饲养至5龄期。取5龄期黑水虻幼虫,冲洗干净后断头处死,50 ℃烘干至恒重,粉碎后索氏法脱脂,过70目筛冷冻保存。
1.4.2 黑水虻抗菌肽的制备
参考张书会等[2]和许依能等[7]方法进行黑水虻抗菌肽的制备。称取20 g脱脂黑水虻幼虫粉,用磷酸盐缓冲液配置成1 g/10 mL 的虫粉液,按照试验设计加入蛋白酶,混合均匀,调整pH,超声处理后,置于水浴锅中酶解,期间每30 min 调整pH,酶解结束后95 ℃灭活15 min,冷却至室温。酶解液在8 000 r/min 条件下离心15 min。取离心后上清液加入硫酸铵(质量百分比浓度70%),搅拌至充分溶解,4 ℃静止4 h,10 000 r/min 离心15 min,弃上清液。将粗蛋白提取物用1 kD 透析袋4 ℃下透析24 h,期间换液3 次。将透析后的粗蛋白加入到10 kD 超滤管内,5 000 r/min离心1 h,收集管底液,真空冷冻干燥称重后保存。
1.4.3 制备率测定
式中:m1——抗菌肽的质量(g);
m——黑水虻幼虫粉的质量(g)。
1.4.4 抑菌活性测定
用灭菌纯化水将金黄色葡萄球菌和大肠杆菌分别配制成1.0×107~1.0×108CFU/mL 菌液,用微量移液器吸取100 μL 菌液加入LB 平板表面,用刮刀轻轻涂布均匀。将牛津杯均匀的放置于LB 平板上,在牛津杯中加入100 μL的100 mg/mL黑水虻抗菌肽溶液,在37 ℃条件下培养箱内培养24 h,测量抑菌圈的直径。
1.5 试验设计
1.5.1 蛋白酶的筛选
选取胃蛋白酶、胰蛋白酶、中性蛋白酶、木瓜蛋白酶,在最适条件下分别对黑水虻虫粉进行酶解(酶解最适条件见表1)。料液比1∶10(g/mL)、加酶量5 000 U/g、超声功率40 W、处理20 min、酶解2 h。其余按照1.4.2和1.4.4的步骤制备抗菌肽并测定抑菌活性。

表1 各种酶酶解最适条件
1.5.2 单因素试验设计
基本酶解条件为料液比1∶10(g/mL)、加酶量5 000 U/g、超声功率40 W、处理时间20 min、酶解温度50 ℃、酶解时间2 h、pH 7.0。分别研究超声功率(20、40、60、80、100 W)、处理时间(10、15、20、25、30 min)、酶解温度(30、40、50、60、70 ℃)、pH(5.0、6.0、7.0、8.0、9.0)对黑水虻抗菌肽制备率的影响。每个因素按照试验水平分别设置4个组,每组重复3次。
单因素试验数据采用SPSS 18.0 软件进行统计分析,试验数据以“平均值±标准差”表示,采用(ANOVA)进行单因子方差分析,Duncan’s 多重比较检验,P<0.05为差异显著,P<0.01为差异极显著。
1.5.3 响应面试验设计
在单因素试验的基础上,以超声功率、处理时间、酶解温度和pH 为自变量,制备率为响应值利用Box-Behnken 试验设计原理进行4 因素3 水平响应面优化试验,利用Design-Expert 13.01 软件进行分析。响应面优化试验因素与水平见表2。
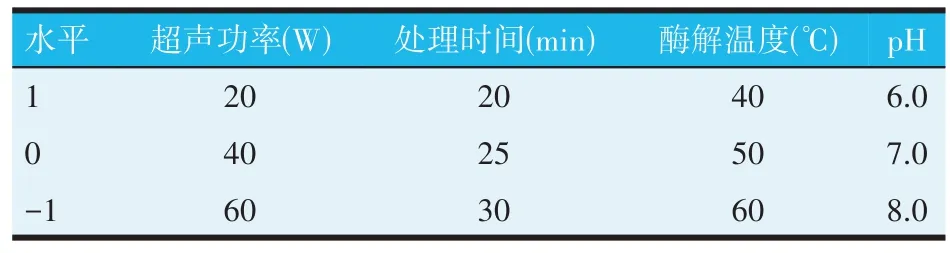
表2 响应面优化试验因素与水平
2 结果与分析
2.1 蛋白酶的筛选结果
以制备率和对金黄色葡萄球菌、大肠杆菌抑菌圈直径为指标,测定胃蛋白酶、胰蛋白酶、中性蛋白酶、木瓜蛋白酶对黑水虻的酶解效果(见表3)。由表3 可知,4 种酶制备黑水虻抗菌肽制备率以中性蛋白酶最高,其次是木瓜蛋白酶、胃蛋白酶、胰蛋白酶。对金黄色葡萄球菌抑菌圈直径大小顺序为胰蛋白酶>中性蛋白酶>胃蛋白酶>木瓜蛋白酶。对大肠杆菌抑菌圈直径大小顺序为中性蛋白酶>胰蛋白酶>木瓜蛋白酶>胃蛋白酶。优先考虑抗菌肽制备率,同时参考抑制金黄色葡萄球菌、大肠杆菌效果,选用中性蛋白酶酶解黑水虻幼虫粉制备抗菌肽。

表3 不同蛋白酶对黑水虻抗菌肽制备效果的影响
2.2 单因素试验结果
2.2.1 超声功率对抗菌肽制备率的影响
由表4 可知,超声功率在20~40 W 时抗菌肽制备率呈上升趋势,超声功率为40 W 时抗菌肽制备率最高,为25.31%。当超声功率高于40 W 时,抗菌肽制备率呈下降趋势,可能是因为高功率的超声波破坏了酶的活性结构,导致酶活性降低。因此,选择超声功率40 W作为试验中心点,进行响应面设计优化。

表4 提取条件对黑水虻抗菌肽提取率的影响
2.2.2 超声处理时间对抗菌肽制备率的影响
由表4 可知,超声处理时间在10~25 min 时抗菌肽制备率随处理时间的增加呈缓慢上升趋势,超声处理25 min 时,抗菌肽制备率最高,为24.68%。当处理时间超过25 min时,制备率随处理时间的增加显著降低,在处理时间为30 min 时,制备率仅为19.36%。因此,选择超声处理时间25 min 作为试验中心点,进行响应面设计优化。
2.2.3 酶解温度对抗菌肽制备率的影响
由表4 可知,酶解温度在30~50 ℃时,抗菌肽制备率随着酶解温度的提高而呈现上升趋势,当酶解温度为50 ℃时,抗菌肽制备率最高,为25.28%。当酶解温度高于50 ℃时,抗菌肽制备率随酶解温度的提高呈降低趋势,当酶解温度达到70 ℃时,制备率最低为14.31%。因此,选择酶解温度50 ℃作为试验中心点,进行响应面设计优化。
2.2.4 pH对抗菌肽制备率的影响
由表4可知,随着pH的增高,黑水虻抗菌肽制备率呈先升高后降低的趋势。当pH为7时抗菌肽制备率最高,为24.48%。pH继续增高时抗菌肽的制备率则呈现下降趋势。分析原因可能是pH在7左右时酶的活性最强,增加或者降低pH 都会影响酶的活性。因此,选择pH为7作为试验中心点,进行响应面设计优化。
2.3 响应面优化试验结果与分析
在单因素试验的基础上,以超声功率(A)、处理时间(B)、酶解温度(C)、pH(D)为自变量,抗菌肽制备率(Y)为因变量,进行29 次响应面试验,优化黑水虻抗菌肽的制备条件。响应面优化试验结果见表5。利用Design-Expert 13.01 软件进行统计分析,建立二次多项回归模型如下。
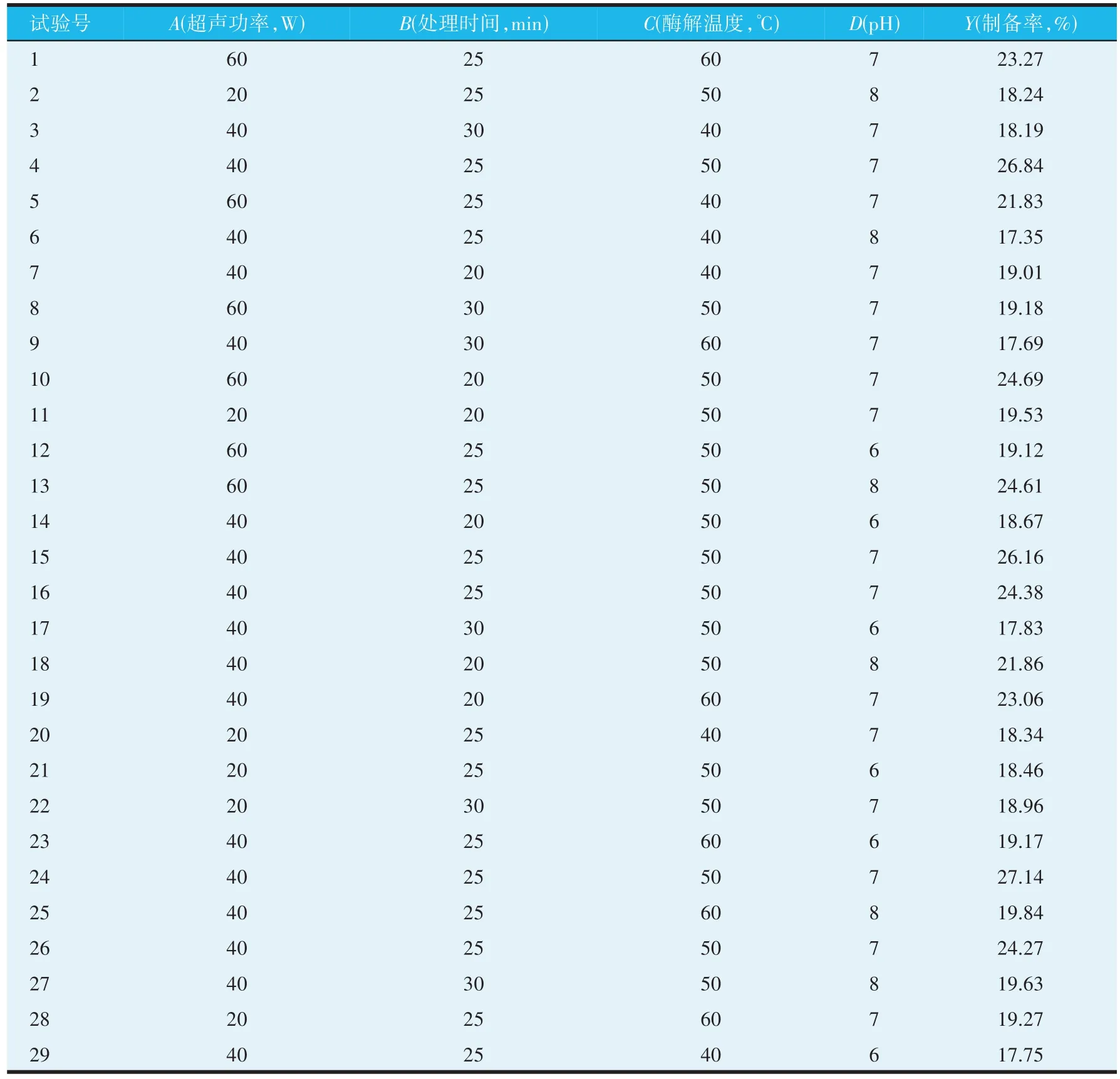
表5 黑水虻抗菌肽制备条件响应面优化试验结果
对建立的回归模型进行分析,由表6 可知该模型P<0.000 1,达到极显著水平,失拟项P=0.883 6(P>0.05)不显著,说明该模型拟合度良好;模型决定系数R2=0.943 3,说明仅有不到6%的变异无法利用该模型进行解释;矫正决定系数R2Adj=0.876 9,拟合决定系数R²pred=0.790 7,说明该模型可靠,预测值与实际值之间误差较小,能准确预测和分析黑水虻抗菌肽最佳制备工艺参数和结果。F值反映了回归方程中各因素对黑水虻抗菌肽制备率的影响,F值越大,影响越显著,4个因素对制备率影响顺序为A>B>D>C。对模型中的回归系数的显著性检验显示,一次项(A、B)、二次项(A2、B2、C2、D2)的回归系数均极显著;一次项(C、D)、互作项(AB、AD、BC)的回归系数均显著;其余均不显著。

表6 回归模型分析结果
2.4 交互作用分析
等高线的形状反映交互效应的强弱,圆形表示两因素交互作用不显著,而椭圆形则表示两因素交互作用显著[14]。由图1~图6 可知,超声功率和处理时间、超声功率和pH、处理时间和酶解温度3个等高线图呈椭圆形,故两因素之间交互作用显著;超声功率与酶解温度、处理时间与pH、酶解温度与pH 3个等高线图近似圆形,表示两因素之间交互作用不显著;各因素在所选择水平范围内抗菌肽制备率均存在极值。从超声功率与处理时间的等高线图来看,超声功率轴向等高线较处理时间轴向等高线稀疏,表明超声功率对响应峰值的影响大于处理时间;同理,超声功率对响应峰值的影响大于pH;处理时间对响应峰值的影响大于酶解温度。

图1 超声功率和处理时间对抗菌肽制备率的影响

图2 超声功率和酶解温度对抗菌肽制备率的影响

图3 超声功率和pH对抗菌肽制备率的影响

图4 处理时间和酶解温度对抗菌肽制备率的影响
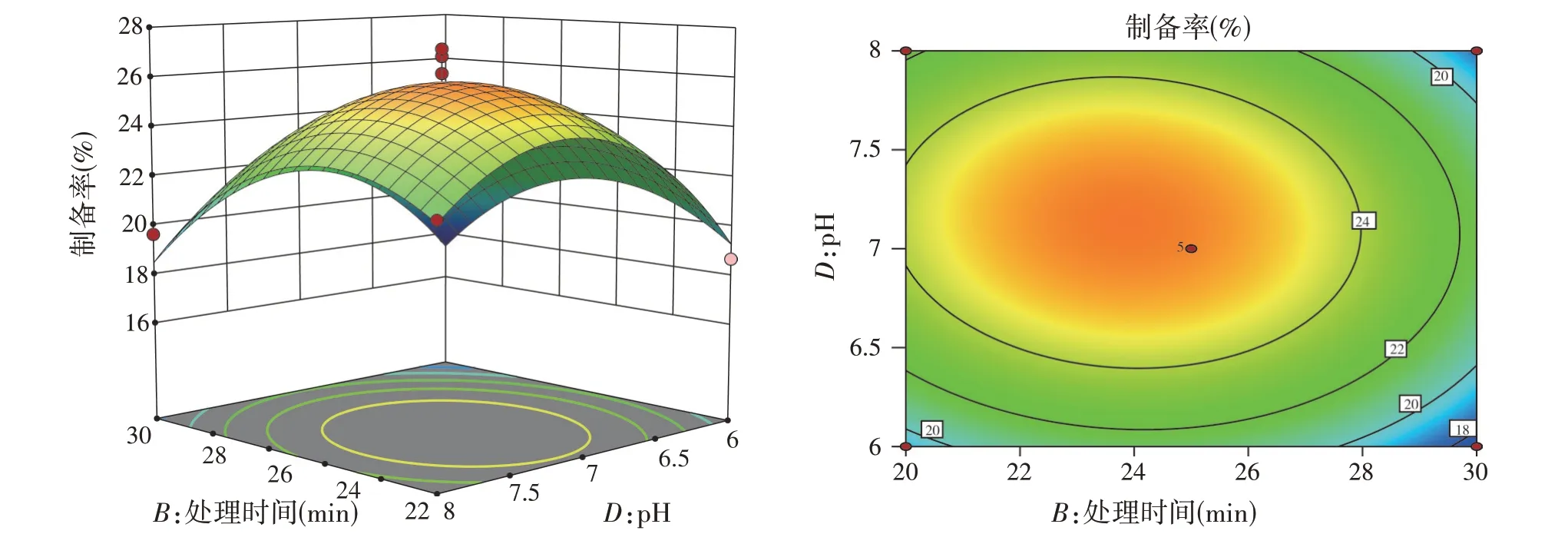
图5 处理时间和pH对抗菌肽制备率的影响

图6 酶解温度和pH对抗菌肽制备率的影响
2.5 最佳制备工艺的确认与验证
根据建立的模型得到最佳制备工艺条件为超声功率52.92 W、超声时间22.92 min、酶解温度52.16 ℃、pH 为7.28,此时黑水虻抗菌肽的制备率为26.77%。为进一步验证最佳制备工艺,综合考虑经济性和可操作性的前提下,将制备条件修正为超声功率53 W、超声时间23 min、酶解温度52 ℃、pH 7.3。按照修正后的制备工艺进行3 次平行试验,测得该条件下黑水虻抗菌肽的制备率为(26.16±0.94)%,与预测值26.77%较为接近,表明该响应面法优化黑水虻抗菌肽制备工艺具有可行性。
2.6 抑菌试验结果
为确认抗菌肽的抑菌性能,测定了3 次平行验证试验所制备的抗菌肽抑金黄色葡萄球菌和大肠杆菌的抑菌圈直径,分别为(16.82±1.27) mm 和(18.71±0.86) mm,表明该制备工艺提取的抗菌肽抑菌效果稳定。
3 讨论
3.1 蛋白酶的种类对抗菌肽制备效果的影响
抗菌肽大多是小分子肽[15],酶解过程中由于不同酶可以识别不同的酶切位点,从而得到的多肽产物也不相同[16]。孙长江等[17]研究认为用胃蛋白酶、胰蛋白酶酶解黄粉虫,抗菌肽得率低,抑菌活性弱,而碱性蛋白酶则取得良好效果。许依能等[7]研究则认为用中性蛋白酶酶解南极磷虾制备的抗菌肽抑菌效果最好,与本试验结果相似。这可能是因为南极磷虾和黑水虻中的蛋白质能够被中性蛋白酶更充分的酶解,从而暴露更多具有抑菌活性的氨基酸序列[18],得到更多的抗菌肽。
3.2 超声条件对抗菌肽制备效果的影响
超声波在辅助酶提取多肽过程中能够产生热效应、机械效应和空化效应[19],使酶的聚合体变得松散,暴露活性位点,让底物与酶活性位点更易结合,从而提高酶的活性和反应速率[20]。当超声强度超过最佳强度时,可以破坏酶和蛋白质的二级结构[21-22],从而降低酶的活性。因此选择适宜的超声条件是提高抗菌肽制备效果的关键。许依能等[7]研究认为超声功率120 W,处理25 min 南极磷虾抗菌肽的提取率最高,抑菌效果最好。本研究则认为,超声功率40 W,处理20 min中性蛋白酶的活性较高,黑水虻抗菌肽制备率高,当超声功率超过40 W 时,随着功率的增大,黑水虻抗菌肽提取率明显降低。这可能是因为底物不同对超声波的耐受性也不同,高强度的超声波改变了底物蛋白质的空间构象[19],影响酶活性位点与底物的结合,从而影响酶解效果。
3.3 交互作用对抗菌肽制备效果的影响
超声功率、酶解时间、酶解温度、pH 等因素不仅单独对抗菌肽制备效果产生影响,各因素之间还可能存在交互作用。孙长江等[17]研究表明,酶解时间与酶解温度、加酶量与酶解温度的交互作用对黄粉虫抗菌肽的制备效果有显著影响,加酶量和酶解时间之间的交互作用不显著。张玥等[13]研究认为,乙酸质量分数与液料比、乙酸质量分数与超声时间的交互作用对紫贻贝加工下脚料抗菌肽的提取率影响显著,液料比与超声时间的交互作用影响不显著。本研究结果表明超声功率和处理时间、超声功率和pH、处理时间和酶解温度之间的交互作用对黑水虻抗菌肽制备效果影响显著,其余因素之间交互作用不显著。这说明底物、酶和制备条件不同,各因素之间的交互作用对制备效果的影响也不同,在进行制备工艺优化过程中,需要考虑各因素之间的交互作用。
4 结论
黑水虻抗菌肽的最优制备工艺为超声功率53 W、超声时间23 min、酶解温度52 ℃、pH 为7.3,在该工艺下抗菌肽制备率为(26.16±0.94)%。制备的抗菌肽抑金黄色葡萄球菌和大肠杆菌的抑菌圈直径,分别为(16.82±1.27) mm 和(18.71±0.86) mm,说明抗菌肽抑菌效果良好。试验表明该工艺制备黑水虻抗菌肽具有可行性。
