白细胞介素1受体颉颃剂抑制脂多糖促奶牛外周血单个核细胞氧化应激损伤作用的研究
2024-03-04郭咏梅齐敬宇闫素梅赵艳丽郭晓宇
■ 郭咏梅 齐敬宇 闫素梅 赵艳丽 郭晓宇
(内蒙古农业大学动物科学学院,内蒙古自治区高校动物营养与饲料科学重点实验室,内蒙古呼和浩特 010018)
机体内低浓度的自由基对于维持动物正常生理功能至关重要,而自由基的过度积累会导致氧化应激发生并发展为炎症性疾病[1-2]。处于氧化应激状态的奶牛,通常免疫功能较低,还伴随着生产性能的下降。因此,深入研究氧化应激的发生机制是改善奶牛抗氧化免疫功能,探索减缓氧化应激措施的重要前提。在奶牛生产中,革兰氏阴性菌感染是导致严重氧化损伤和炎症的主要因素之一,这会提高牛的发病率和死亡率,影响生长速度,从而给经济带来损失。因此,研究革兰氏阴性菌引起的氧化损伤对预防或减少疾病具有重要意义。脂多糖(LPS)是革兰氏阴性细菌外膜的主要组成部分,越来越多的证据表明,LPS 会导致编码各种促炎细胞因子的基因表达增加,用于研究细胞氧化损伤的发生及其减缓作用,但其诱导氧化应激发生的确切机制尚不明确。
LPS 是白细胞介素1β(IL-1β)等炎症因子的诱导剂[3],促炎细胞因子IL-1β是由巨噬细胞产生,可以介导机体多种器官炎症和组织损伤。一氧化氮(NO)是机体内起到重要作用的活性氮(RNS)自由基,具有抗菌、抗病毒、免疫等作用;但是过量的NO 会损害细胞结构、引发氧化应激[4]。炎症因子如IL-1β等可以通过活化一氧化氮合酶(iNOS)导致NO 过量生成,从而引发氧化应激和细胞凋亡[5]。因此,LPS 诱导细胞产生氧化应激可能是通过IL-1β等炎症因子诱发大量NO 产生介导发生的。白细胞介素1 受体颉颃剂(IL-1Ra)是一种能够抑制IL-1β信号传导的炎性细胞因子受体颉颃剂,主要通过调控IL-1β的生成来治疗由氧化应激引起的炎症疾病[6]。研究表明,在氧化应激状态下,IL-1Ra有效抑制了小鼠血清超氧化物歧化酶(SOD)活性的升高、丙二醛(MDA)和脂质过氧化物含量的降低,IL-1Ra 通过抑制氧化应激损伤和炎症反应,减少了小鼠肠细胞凋亡[7]。人小胶质细胞相关的研究中也发现,注射IL-1Ra可以显著降低IL-1β和白细胞介素-6(IL-6)含量,有效地下调IL-1β的基因表达,减缓由LPS诱导的炎症和疾病反应[8-9]。上述研究结果提示,IL-1Ra 可能通过阻断IL-1β过量释放,抑制信号传导,进而对细胞氧化损伤发挥保护作用。然而,目前关于PBMCs 的相关研究很有限。外周血单个核细胞(PBMCs)是免疫系统中抗感染的关键细胞,主要包括B 淋巴细胞、单核细胞等,这些细胞是机体免疫中不可或缺的一部分,可以反映机体感染和疾病的发生程度、评估机体免疫功能的强弱[10]。PBMCs 的氧化应激与多种疾病的发生发展密切相关。课题组前期以奶牛PBMCs 为模型,研究建立了LPS 诱导的PBMCs 细胞氧化损伤模型,确定了适宜的LPS剂量和时间(10 μg/mL 作用24 h)[11],但其是否与IL-1β的释放有关尚不清楚。基于前期研究,为更好地了解奶牛的生理和免疫特点,试验以PBMCs 为体外研究模型,LPS 为应激源,利用IL-1Ra 抑制IL-1β的活性,探究LPS 诱发PBMCs 氧化损伤是否与IL-1β的过量释放有关,并筛选可以对LPS 诱导氧化损伤发挥最佳保护作用的IL-1Ra 剂量,为后续深入探讨奶牛PBMCs 氧化应激的发生机制奠定基础。
1 材料与方法
1.1 试验材料
IL-1Ra(AF-480-SP)购自RD 公司;LPS(L2880)购自美国Sigma 公司;牛外周血单个核细胞分离液(LDS1084)购自天津灏洋生物制品科技有限责任公司;RPMI-1640 基础培养基、胎牛血清均购自美国Gibco 公司;Cell Counting Kit-8(CCK-8)购自上海碧云天生物技术有限公司;PBS缓冲液购自美国HyClone公司;MDA、GPx、T-SOD和CAT的活性及T-AOC测定使用的试剂盒均购自南京建成生物工程研究所有限公司;IL-1β、IL-6、NO 浓度和TrxR、iNOS 活性测定使用的ELISA试剂盒均购自睿信生物科技有限公司。
1.2 试剂配制
1.2.1 LPS细胞工作液的配制
用超纯水将LPS 粉末溶解,经逐级稀释依次配制成浓度为1 mg/mL、100 μg/mL 的一级、二级母液。LPS二级母液与基础培养基以1∶9进行溶解混匀,配制成LPS工作液,浓度为10 μg/mL。工作液经0.22 μm的过滤器过滤后避光保存。
1.2.2 IL-1Ra细胞工作液的配制
IL-1Ra 粉末与超纯水以1∶10 混合溶解,配制成100 μg/mL 的IL-1Ra 一级母液,进一步依据试验要求用基础培养基稀释,配制成IL-1Ra 工作液,终浓度为1 ng/mL。工作液经0.22 μm 的过滤器过滤后避光保存。
1.3 PBMCs的分离与培养
参照郑亚光等[11]报道的方法,PBMCs采用单次密度梯度离心分离法培养。尾静脉采血后12 h 内进行PBMCs 的分离处理。将血样与PBMCs 分离液以1∶1的比例缓慢混合于离心管中,1 300 r/min离心40 min,为保证较高的细胞获得率,离心温度控制在25 ℃以下,离心后从上至下依次为血浆层、白色云雾状PBMCs 层、透明分离液层和红细胞层,吸取PBMCs层。经PBS 清洗重悬后的PBMCs 接种于25 cm2培养瓶中于培养箱中培养(37 ℃、5%CO2),68 h 后离心收集细胞进行后续试验(1 000 r/min离心15 min)。
1.4 试验设计
采用单因子完全随机设计,分别给予PBMCs 不同的处理:第1组是阴性对照组(Neg 组),完全培养基培养30 h;第2组损伤组(Dam组),是在完全培养基中培养6 h 后,再经10 μg/mL 的LPS 工作液培养24 h;第3 至7 组(R0.25、R0.5、R1、R5 组和R10 组)细胞分别经浓度为0.25、0.5、1、5、10 ng/mL 的IL-1Ra 培养6 h,接着经10 μg/mL的LPS工作液培养24 h。每个处理组6个重复。
1.5 样品采集与处理
细胞活力:将PBMCs接种于96孔板中(接种密度6×106个/mL,200 μL/孔),用于细胞活力的测定。
细胞培养液:将PBMCs接种于24孔板中(接种密度6×106个/mL,1.5 mL/孔),处理结束后离心收集细胞培养液上清液(4 ℃、1 000 r/min离心10 min),用于炎症因子的测定。
细胞酶活样品:将PBMCs接种于24孔板中(接种密度6×106个/mL,1.5 mL/孔),处理结束后收集细胞悬浮液,PBS清洗后加入细胞裂解液,4 ℃条件下裂解30 min,后离心收集上清液(1 000 r/min离心10 min),用于细胞酶活测定。
1.6 测定指标与方法
采用CCK-8 法测定细胞活力[12]。采用黄嘌呤氧化酶法测定细胞培养液中的T-SOD 活性;比色法测定细胞培养液中的CAT活性;钼酸铵显色法测定细胞培养液中的T-AOC;二硫代二硝基苯甲酸法测定细胞中GPx 活性;采用酶联免疫法(ELISA)测定细胞中TrxR 含量[13]。细胞培养液中的NO、IL-1β、IL-6 和iNOS 含量均采用酶联免疫法(ELISA)测定[12]。硫代巴比妥酸法测定细胞中MDA 含量[13]。操作步骤按照试剂盒说明书进行,使用BioTekman Synergy H1 酶标仪进行检测。
1.7 数据统计
整理后的数据采用SAS 9.0统计软件的单因素方差分析(ANOVA)程序对所有处理进行显著性检验和Duncan’s 多重比较。统计结果P≤0.05 表示组间差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 IL-1Ra 对LPS 诱导损伤的PBMCs 细胞活力与抗氧化指标的影响
如表1所示,与Neg组相比,Dam 组细胞活力显著降低(P≤0.05);与Dam 组相比,R0.25、R0.5、R1、R5 组和R10 组的细胞活力均显著升高(P≤0.05);随着IL-1Ra 剂量的增加PBMCs 的细胞活力呈现先升高后降低的趋势,且R1和R5组显著高于其他IL-1Ra添加组(P≤0.05)。
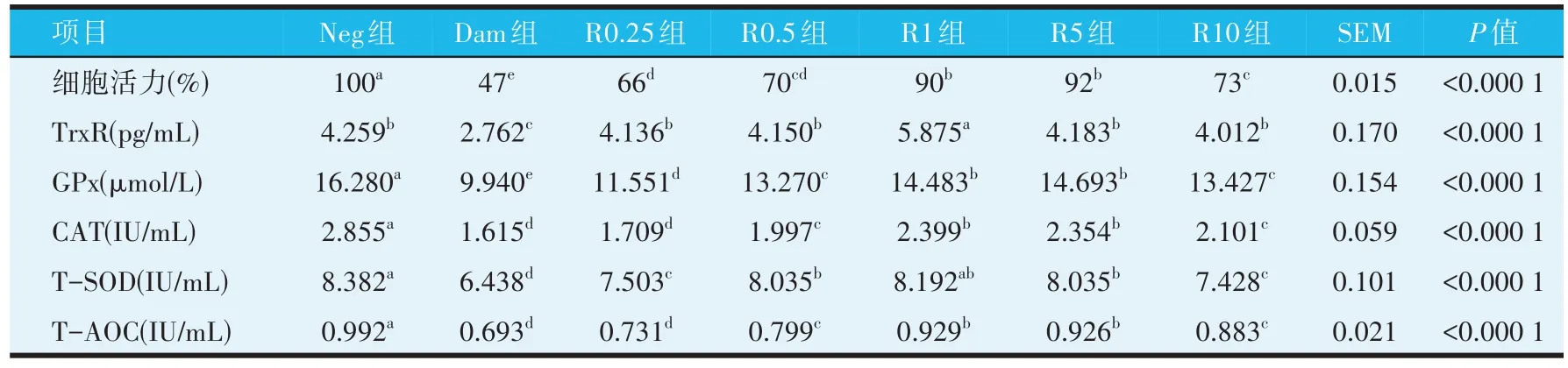
表1 IL-1Ra对LPS诱导损伤的PBMCs的细胞活力和抗氧化酶活性的影响
表1 中,抗氧化酶活性与细胞活力的变化趋势相似。与Neg 组相比,Dam 组TrxR、GPx、CAT 和T-SOD活性和T-AOC 显著降低(P≤0.05);而与Dam 组相比,R0.5、R1、R5组中上述指标均显著升高(P≤0.05),且随着IL-1Ra剂量的增加均呈现先升高后下降趋势;其中R1 和R5 组的GPx、CAT 活性和T-AOC 显著高于其他IL-1Ra 保护组(P≤0.05);R1 组的TrxR 活性显著高于其他IL-1Ra 保护组(P≤0.05);R0.5、R1 和R5 组的TSOD活性显著高于其他IL-1Ra保护组(P≤0.05)。
2.2 IL-1Ra 对LPS 诱导损伤的PBMCs 炎症因子、NO浓度与iNOS活性的影响
由表2 可知,与Neg 组相比,Dam 组的MDA 含量显著升高,IL-1β、IL-6和NO 含量及iNOS活性呈现相似的变化(P≤0.05)。与Dam组相比,不同剂量IL-1Ra添加组的MDA、IL-6 和NO 含量及iNOS 活性均显著降低(P≤0.05),只是变化程度不同;其中R1 组的IL-6含量及iNOS 活性显著低于其他IL-1Ra 保护组(P≤0.05);R1 和R5 组的MDA、NO 含量显著低于其他IL-1Ra 添加组(P≤0.05);与Dam 组相比,R0.5、R1、R5 和R10 组的IL-1β的含量显著降低(P≤0.05),但R0.5、R1和R5三组间无显著差异(P>0.05)。

表2 IL-1Ra对LPS诱导损伤的PBMCs的炎症因子和NO浓度的影响
3 讨论
LPS 是先天免疫系统的有效激活剂,可以通过Toll 样受体4(TLR4)信号诱导巨噬细胞/单核细胞激活和炎症细胞因子的产生。LPS 会引起炎症因子的释放,导致一连串的信号传导与反应,对细胞的损害比LPS 本身要严重得多,特别是炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)和IL-6。在一定范围内增加炎症细胞因子的浓度可以改善免疫功能,而过度增加则表现为免疫功能紊乱和炎症反应加剧。在一项关于小鼠软骨细胞的研究中发现LPS 诱发了细胞的氧化损伤,导致细胞增殖率明显下降,同时炎症细胞因子的水平IL-6、白细胞介素-8(IL-8)和TNF-α等及其基因表达水平显著上调[14]。还有人研究发现,LPS 诱导NO 过量释放和iNOS 基因表达过度。当活性氧(ROS)和NO 等自由基产生过量并超过自身的清除能力时,过量的自由基会破坏体内的氧化还原平衡,导致细胞的氧化应激,进而导致更多炎症细胞因子释放,如IL-1、IL-6 和TNF-α。因此,氧化应激与炎症反应密切相关。SOD、CAT、过氧化物酶和GPx等属于酶促脱毒系统,能有效清除过量的ROS 自由基,并通过阻止自由基链式反应而发挥细胞保护系统的作用,从而减少组织损伤的程度[15]。有报道发现氧化应激与抗氧化酶活性及含量的改变息息相关,且其细胞内氧化应激相关的调控因子参与调控疾病的发生发展[16],因此,炎症因子浓度和抗氧化酶活性的变化可作为成功建立细胞氧化应激模型的判别标准。PBMCs是一组重要的免疫效应细胞,在先天和后天免疫中发挥着重要作用,介导炎症和病原体清除,监测体内感染和疾病的发展;由单核细胞组成的单核吞噬系统不仅是先天免疫的重要组成部分,而且还通过呈递激活淋巴细胞的抗原来触发获得性免疫;主要是由淋巴细胞介导的体液和细胞免疫反应。Bastin等[17]研究发现,10 ng/mL 的LPS 处理PBMCs 22 h 后,使GPx和SOD 活性显著下降,而炎症因子IL-1β、IL-6、MDA和NO 含量显著升高,诱发细胞产生氧化应激和炎症反应;这与本研究结果一致,与Neg 组相比,Dam 组中抗氧化酶、炎症因子呈现与上述结果相似的变化,说明本研究中LPS 导致细胞内氧化还原平衡遭到破坏,诱导PBMCs发生了氧化应激。
IL-1Ra 是IL-1 的天然抑制剂,阻断IL-1 介导的信号通路[18]。IL-1是早期全身炎症反应的重要因子,主要包括IL-1α和IL-1β,两者发挥生物学功能需要与细胞膜上的受体结合,进而介导激活相关信号通路。IL-1α和IL-1β作为促炎性细胞因子可以被IL-1Ra 颉颃,进而减缓IL-1α和IL-1β活性。作为一种典型的促炎症细胞因子,IL-1一方面通过促进其他促炎症细胞因子的表达和刺激中性粒细胞浸润来启动实现扩大炎症反应。另一方面,它们促进巨噬细胞和中性粒细胞的活化和脱颗粒,促进炎症细胞释放生物活性物质,如前列腺素和血小板活化因子,并增加内皮细胞和上皮细胞的渗透性[19],进而引发慢性炎症疾病,故IL-1Ra 在临床医学中被广泛应用。研究发现,IL-1Ra 能有效减少LPS 诱导的人类牙髓细胞中IL-1β的过量合成,这表明IL-1Ra 能减缓炎症反应[20]。关于小鼠的研究也进一步佐证了IL-1Ra 缓解LPS 诱发氧化应激和炎症反应的作用[21]。在本试验中,以LPS 为应激诱导剂诱导PBMCs 氧化损伤,并加入IL-1Ra 以探究其对氧化应激的缓解作用。结果显示,当IL-1Ra 浓度为0.25 ng/mL 时,PBMCs 中MDA 含量、炎症细胞因子IL-6、NO 含量和iNOS 活性显著降低,IL-1β含量也减少,而抗氧化酶TrxR、GPx 和T-SOD 的活性明显提高,缓解了PBMCs 的氧化损伤。IL-1Ra 浓度达到1 ng/mL 时,对减轻PBMCs 的氧化应激作用最明显;炎症因子浓度、iNOS 活性达到最低水平,而除GPx 外其他抗氧化酶活性达到最高水平LPS 诱导的NO 过量释放和PBMCs 中的氧化应激是由IL-1β产生的,而IL-1Ra 通过抑制IL-1β的活性而减缓了LPS 诱导的氧化应激,这种调节作用有一个阈值,适宜浓度的IL-1Ra 可以减轻LPS 诱导的氧化损伤和PBMCs 中的炎症反应,但当超过这个阈值时,缓解效果就会下降。在本研究条件下,1 ng/mL 浓度的IL-1Ra 表现出良好的缓解作用。课题组前期[22]研究表明,在奶牛乳腺上皮细胞的氧化应激损伤模型中,添加10 μg/L 的IL-1Ra 对奶牛乳腺上皮细胞的氧化损伤和炎症反应起到保护作用且效果最好。这说明IL-1Ra 尽管对不同种类的动物细胞产生的氧化应激具有减缓作用,但剂量不完全相同。
4 结论
IL-1Ra通过抑制IL-1β的活性,降低了iNOS活性和NO的过量释放,对LPS引起的PBMCs氧化损伤的减缓作用具有剂量依赖效应,以添加水平1 ng/mL为宜。
