优质强筋春小麦种质筛选及高分子量谷蛋白序列分析
2024-03-03刘颖刘泮旭潘萍萍张家宁刘丹袁卉馥
刘颖 刘泮旭 潘萍萍 张家宁 刘丹 袁卉馥

摘 要:小麥是重要的口粮作物,加工品质的遗传改良是小麦育种的重要目标之一。为了丰富小麦加工品质育种的基因资源,本研究在收集的种质资源中筛选出农艺性状优良的SG-1、SG-2和SG-3,并对其进行加工品质分析和籽粒储藏蛋白组成分析,并评估它们在育种上的利用价值和方式,使用SDS-PAGE、A-PAGE、高分子量谷蛋白亚基编码基因测序、SDS沉降值分析等技术,对这些小麦品种的籽粒储藏蛋白亚基组成进行分析。研究发现,SG-1携带非优质的高分子量谷蛋白亚基Dx2+Dy12,而SG-2和SG-3携带优质的高分子量谷蛋白亚基Dx5+Dy10。在醇溶蛋白方面,3份资源都检测到了γ-1型醇溶蛋白,但只有SG-3检测到了γ-2型醇溶蛋白。加工品质分析显示,SG-1的加工品质优于天津推广的优质强筋春小麦品种津强6号。高分子量谷蛋白亚基序列分析发现,SG-1和SG-3在By8亚基存在序列变异,表明尽管它们在SDS-PAGE水平上亚基类型一致,但在DNA序列上仍然存在变异。本研究结果初步解释了携带优质亚基的小麦品种在加工品质上表现不佳的原因可能是DNA序列存在差异。同时,研究人员还发现携带非优质亚基但具有优良加工品质的SG-1,说明SG-1可能存在其他能够提升小麦加工品质的机制。本研究拓宽了小麦加工品质育种的基因资源,并为加工品质形成机制的解析提供了新的资源和理论依据。
关键词:小麦;籽粒储藏蛋白;高分子量谷蛋白;醇溶蛋白;加工品质
中图分类号:S326 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2024.01.002
The Identification of Spring Wheat Germplasm for End-use Quality and Sequence Analysis of High Molecular Weight Glutenin Subunits
LIU Ying1, LIU Panxu2,PAN Pingping3,ZHANG Jianing4,LIU Dan2,3,YUAN Huifu1
(1.Hebei North University,Zhangjiakou, Hebei 075000 China; 2.Tianjin Zhongtiandadi Technology Company Limited,Tianjin 300384,China; 3.Tianjin Key Laboratory of Crop Genetics and Breeding,Tianjin Crop Research Institute,Tianjin Academy of Agricultural Sciences,Tianjin 300384,China; 4. Hebei Normal University of Science & Technology, Qinhuangdao, Hebei 066000, China)
Abstract: Enhancing the end-use quality of wheat is a major goal in wheat breeding since wheat is an essential food crop. This study examined three accessions, SG-1, SG-2, and SG-3, which showed excellent agronomic traits among the collected germplasm resources, in order to improve the genetic resources for wheat end-use quality. The study investigated their the protein content of seeds stored for storage, end-use quality, ways of utilization and breeding values, end-used quality, and SDS-PAGE, A-PAGE, gene sequencing of genes encoding high molecular weight glutenin subunits, and SDS sedimentation value analysis were used to examine the composition of seed storage protein subunits in different wheat varieties. The results revealed that SG-1 carried the high molecular weight glutenin subunit Dx2+Dy12, whereas SG-2 and SG-3 carried the high molecular weight glutenin subunit Dx5+Dy10. In terms of gliadin, Gli-γ1 was found in all three varieties, however only Gli-γ2 was found in SG-3. The end-use of quality of SG-1 was found to be superior to that of Jinqiang 6, a wheat variety with good end-use quality. Sequence analysis of high molecular weight glutenin subunits identified variation in the By8 subunit of SG-1 and SG-3, indicating that although they shared identical subunits, there was still variation in the sequence. This variation in sequence could potentially explain the poorer performance in end-use quality observed in varieties carrying elite high-quality subunits. Interestingly, the researchers also noted that SG-1, despite carrying a non-premium subunit, exhibited elite end-use quality. This suggests the existence of alternate pathways by which SG-1 can improve wheat end-use quality. Overall, this study expands the genetic resources accessible for wheat end-use quality breeding while also providing new resources and a theoretical basis for studying the mechanism of wheat end-use quality improvement.
Key words: wheat; seed storage protein; high molecular weight glutenin; gliadin; wheat end-use quality
小麦(Triticumaestivum L.)是重要的口糧作物,为全球五分之一的人口提供了能量和蛋白质[1]。小麦粉可以形成独特的面筋蛋白,且依据面筋蛋白含量、质量不同,能够被加工成类型多样的面食品,如面包、饺子、蛋糕和饼干等[2]。由于面食品的口感、外观等综合表现是由小麦品种的加工品质特性决定的,因此加工品质遗传改良是小麦育种的重要育种目标。
小麦籽粒的面筋蛋白主要由谷蛋白和醇溶蛋白组成,是影响小麦加工品质的重要因素,在品质遗传改良中发挥了至关重要的作用[3]。谷蛋白是能够溶解于酸或者碱溶液的蛋白质;醇溶蛋白主要溶解于醇类物质[4]。二者被认为是重要的籽粒储藏蛋白,约占籽粒蛋白含量的80%。小麦谷蛋白与小麦醇溶蛋白通过蛋白质之间的相互作用形成面筋[5],其中谷蛋白决定了面团的弹性,醇溶蛋白决定了面团的延展性和粘性[6]。因此,谷蛋白和醇溶蛋白参与形成的面筋蛋白质量与小麦的营养品质及加工品质密切相关。
目前对于谷蛋白的研究相对清楚,依据谷蛋白在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上的迁移速率不同,将迁移速率慢的蛋白亚基(分子量为80 ~120 KDa)称为高分子量谷蛋白亚基(HMW-GS),迁移速率快的(分子量为20 ~45 KDa)称为低分子量谷蛋白亚基(LMW-GS)。高分子量谷蛋白亚基(HMW-GS)由第一部分同源群染色体长臂上的Glu-1A、Glu-1B、Glu-1D座位编码,每个座位编码2个连锁的基因,分别为x和y基因。因此,高分子量谷蛋白编码基因数量有限,共6个编码基因,为1Ax、1Ay、1Bx、1By、1Dx、1Dy。其中,1Ay不表达,1Ax在部分材料中表达[7]。因此,在一个小麦材料中,通常可以检测到4~5个高分子量谷蛋白亚基表达[8]。低分子量谷蛋白(LMW-GS)编码基因位于第一同源群的短臂上,由多个成簇的基因编码[9]。目前明确Dx5+Dy10高分子量谷蛋白亚基对为优异的亚基,携带该亚基对的材料烘焙品质优于携带Dx2+Dy10亚基对的材料。同时含有1Ax、1Bx7OE的材料烘焙品质优良。大部分优质小麦材料的籽粒高分子量谷蛋白组成为1Ax、1Bx7OE+1By8、1Dx5+1Dy10。这些材料为品质育种的重要亲本资源。
根据醇溶蛋白在A-PAGE电泳图谱上的相对迁移速率可以将醇溶蛋白分为α/β、γ、ω3类[10]。其中α/β型醇溶蛋白占醇溶蛋白总量的55%[11]。由于α、β在电泳图谱上的位置及结构相似,且都为含硫量较高的蛋白质,一般不做区分[3]。γ型醇溶蛋白占醇溶蛋白总量的30%,其含硫量较低[12-13]。ω型醇溶蛋白不含硫,且在电泳图谱上的迁移速率最慢,其相对分子量最大,但是占醇溶蛋白总量最少,仅占其总量的15%[14]。α/β、γ型醇溶蛋白由于含有半胱氨酸等含硫氨基酸又被称为富硫醇溶蛋白,而ω型醇溶蛋白不含半胱氨酸和甲硫氨酸,其氨基酸组成的80%为脯氨酸、苯丙氨酸和谷氨酰胺,因此被称为贫硫醇溶蛋白[15]。目前认为降低醇溶蛋白含量能够提升小麦加工品质。前人研究表明,同时增加面粉中的α/β、γ、ω型醇溶蛋白的含量缩短了面团的形成时间,降低了面包高度,增加了面团的延展性[16]。同时,研究发现,增加ω型醇溶蛋白比增加等量的α/β型醇溶蛋白能够降低面粉加工品质[16]。通过基因编辑技术敲除部分γ型醇溶蛋白,显著提升了小麦加工品质。关于醇溶蛋白对加工品质的研究还不够深入,限制了醇溶蛋白在品质遗传改良中的利用。
目前,天津市农业科学院保有一批加工品质优良的小麦资源。本研究通过鉴定其高分子谷蛋白亚基组成、醇溶蛋白亚基组成、籽粒性状等信息,评价其用于小麦品质育种的可能性及利用方式,为丰富天津地区小麦品质育种基因资源提供有益信息。
1 材料与方法
1.1 试验材料
试验材料为SG-1、SG-2、SG-3、津强11号、津强6号、中国春共6份小麦种子,由天津市农业科学院农作物研究所提供,于2023年种植于天津市农业科学院农作物研究所试验地(117° E,39° N),株距1.5 cm,行距25 cm,行长2 m。
1.2 试验方法
1.2.1 谷蛋白的提取及鉴定 (1)将小麦种子研磨成粉末后转移到2.0 mL离心管中。
(2)加入1 600 μL提取液A(7.5 mL异丙醇+4.5 g NaI)制成悬浮液,之后放入烘箱中,温度设置65 ℃,提取1 h,期间每隔10 min摇晃振荡1次,1 h后转入离心机10 000 r·min-1离心3 min,弃上清液。
(3)重复步骤(2)1次。
(4)在上述沉淀中加入4 00 μL提取液B(25 mL异丙醇+4 mL Tris-HCl pH=0.8+10 g SDS+2 g DTT),充分涡旋后,放于烘箱中,温度设置65 ℃,提取1 h。期间每隔10 min摇晃振荡1次。
(5)加入400 μL提取液C(25 mL异丙醇+4 mL Tris-HCl pH=0.8+10 g SDS+1.4 mL VP),充分涡旋混匀,放于烘箱中,温度设置65℃,提取30 min,之后转入离心机,10 000 r·min-1离心5 min。
(6)将上述800 μL上清液吸出,转移到新的2.0 mL离心管中,编号一一对应,并加入400 μL提取液D(62.5 mL Tris-HCl pH=6.8+5 mL β-巯基乙醇+20 mL甘油+2 g SDS+0.2 g 溴酚蓝),充分涡旋混匀。
(7)下層胶的制备:使用PAGE凝胶快速制备试剂盒(由上海雅酶生物科技有限公司提供),2个烧杯各加入15 mL下层胶溶液12.5%+15 mL下层胶缓冲液,充分混匀后加入300 μL促凝剂,充分混匀,倒入两板之间(液体距离梳齿约1 cm)。
(8)上层胶的制备:使用PAGE凝胶快速制备试剂盒(由上海雅酶生物科技有限公司提供),另外2个烧杯中各加入5 mL上层胶溶液+5 mL彩色上层胶缓冲液(彩色上层胶缓冲液使用前摇匀),充分混匀后加入100 μL促凝剂,充分混匀倒入两板之间插上梳子。
(9)拆下胶板,耳板一侧朝内安装到电泳设备上。
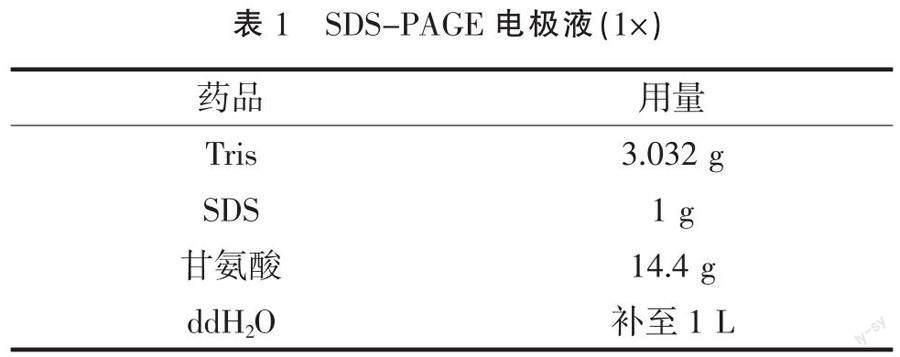
(10)加入1X SDS-PAGE电极液(表1),电极液没过胶孔。
(11)点样:从左往右上样,上样3 μL。
(12)跑胶:将电泳设备转移到电泳槽中,加入1X电极液。电线连接电泳设备和电泳仪,电极两端颜色保持一致。电压设置120 V,时间5 h。
(13)起胶、染色:考马斯亮蓝R-250染液(表2)没过胶面,染色20 min。
(14)脱色、读带。
1.2.2 醇溶蛋白提取及鉴定 (1)将种子研磨成粉末放入2.0 mL离心管中。
(2)加入400 μL醇溶蛋白提取液(表3),90°放置在摇床上,室温下200 r·min-1,摇晃1 h,再加入400 μL loading buffer(表4),12 000 r·min-1离心2 min。
(3)在30 mL预制胶溶液(表5)中加入75 μL H2O2,用蓝枪头快速搅拌均匀并倒入两板之间,插好梳子。待烧杯中残留的胶液凝固后,拔掉梳子。
(4)加入1× A-PAGE电极液(表6,20×电极液用前稀释为1×电极液),电极液没过胶孔。
(5)点样:从左往右上样,上样3 μL。
(6)跑胶:电压设置500 V,时间40 min。
(7)起胶、染色:考马斯亮蓝R-250染液(表2)没过胶面,染色15 min。
(8)脱色、读带:将胶块从染液中捞出,放入清水中,脱色后读带记录、拍照。
1.2.3 高分子量谷蛋白亚基鉴定 根据已经公布的中国春参考基因组、10+genome参考基因组上的高分子量谷蛋白的序列设计1Bx,1By,1Dx,1Dy编码基因的特异性扩增引物,对高分子量谷蛋白编码基因进行扩增(表7)并测序,使用DNAMAN软件进行序列比对分析。
1.2.4 SDS-沉降值测定 (1)称取面粉样品(2.00±0.01)g,于35 mL平底玻璃试管中。
(2)加入16.7 mL的溴酚蓝工作液,加上塞子。将面粉与溶液混匀,放到沉降值测定仪上摇匀5 min。
(3)加入16.7 mL 1 ∶ 50乳酸-SDS工作液,盖上塞子,上下颠倒混匀,将试管放置于摇床上震荡5 min。
(4)从摇床上取下试管,立即将其竖立在水平桌面上,静置5 min,迅速读取沉淀物体积,即为SDS-沉降值。
2 结果与分析
本研究通过在天津市农业科学院历年收集的农家种中筛选出了3个农艺性状优良的春小麦新资源,为了明确上述农家种在小麦加工品质中的利用价值,进行了谷蛋白亚基分析、醇溶蛋白带谱分析、高分子量谷蛋白基因型分析、加工品质初步分析。
2.1 高分子量谷蛋白组成
为了明确SG-1、SG-2、SG-3是否含有优质谷蛋白亚基,本研究以天津主栽的优质强筋春小麦津强11号和公布了参考基因组序列信息的春小麦品种中国春为对照,通过SDS-PAGE电泳分析SG-1、SG-2和SG-3的谷蛋白亚基组成。津强11号的高分子量谷蛋白亚基由1Ax2*、1Dx5+1Dy10、1Bx7OE+1By8组成,由于其高分子量谷蛋白亚基均为优质亚基,其加工品质优于大部分春小麦栽培品种。中国春的高分子量谷蛋白亚基由1Axnull、1Dx2+1Dy12、1Bx7+1By8组成。结果表明,SG-1、SG-2、SG-3在Glu-1A座位上均不表达,未检测到谷蛋白亚基条带。Glu-1B座位上SG-1和SG-3为1Bx7+1By8亚基,SG-2为1Bx7+1By9亚基。Glu-1D座位上SG-2和SG-3为1Dx5+1Dy10优质亚基,SG-1为1Dx2+1Dy12亚基。SG-1、SG-2和SG-3在低分子谷蛋白区域存在条带变异(图1)。
2.2 醇溶蛋白组成
由于醇溶蛋白影响面团的延展性,影响小麦加工品质。本研究通过酸性聚丙烯酰胺凝胶电泳(A-PAGE)对SG-1、SG-2、SG-3的醇溶蛋白亚基组成进行分析(图2)。与低分子量谷蛋白亚基组成类似,SG-1、SG-2、SG-3的醇溶蛋白亚基变异丰富,各不相同。在ω区,SG-1和SG-2条带一致,但是SG-3呈现不同的亚基分布。在γ区,SG-1、SG-2、SG-3均可检测到γ1条带,但SG-3还可以检测到γ2条带。α区SG-1、SG-2、SG-3的醇溶蛋白亚基各不相同,与中国春相比,组成不同,可能为小麦加工品质育种提供丰富的基因资源。
2.3 SDS-沉降值分析
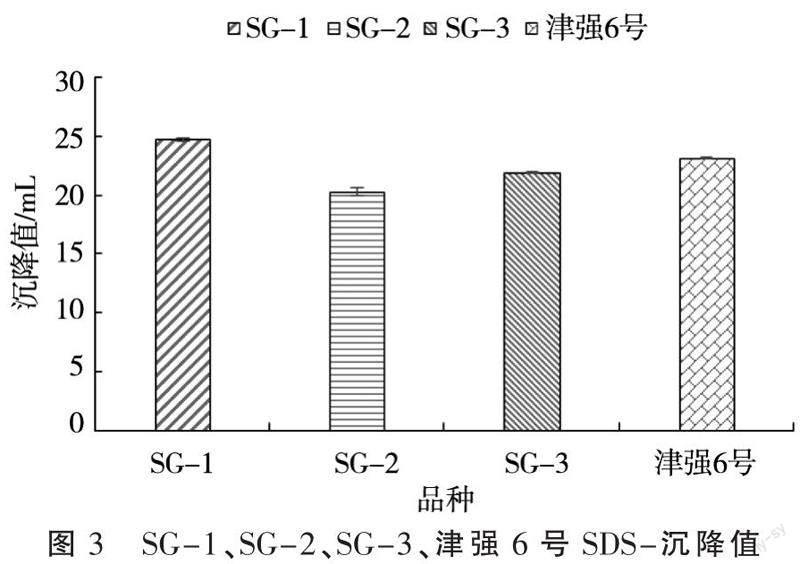
由于SG-1、SG-2、SG-3在籽粒储藏蛋白组成上各不相同,可能在加工品质上存在差异,为了进一步鉴定SG-1、SG-2、SG-3在小麦加工品质中的差异,本研究通过微量SDS沉降值来评价SG-1、SG-2、SG-3的加工品质。结果表明,SG-1、SG-2、SG-3的沉降值分别为24.8、20.3、21.9 mL,目前天津地区优质强筋小麦津强6号的沉降值为23.2 mL(图3)。这说明本批次材料中SG-1的加工品质超过津强6号,可作为品质育种提升的候选亲本。
2.4 高分子量谷蛋白序列信息分析
为了明确各个材料的序列信息,本研究通过设计特异性引物克隆1Dx、1Dy12、1Bx、1By基因,由于未能设计出1Bx位点的特异引物,仅对1Dx、1Dy12、1By基因进行分析。1By位点克隆结果表明,虽然SG-1和SG-3在SDS-PAGE上都呈现By8亚基,但是序列分析在第78位氨基酸存在1个脯氨酸(P)和亮氨酸(L)的差异,在第264位氨基酸存在甘氨酸(G)和精氨酸(R)的差异,同时在279~340的氨基酸区间上存在大量的序列差异(图4)。这说明虽然氨基酸迁移速率接近,但是氨基酸序列不一致,也可能导致品质存在差异。测序表明,SG-2的By9型亚基和SG-1的By8型亚基主要是在320~340区间内连续丢失了15个氨基酸,导致SDS-PAGE的迁移速率不同。SG-2和SG-1在第350位氨基酸存在甘氨酸(G)和丙氨酸(A)的差异。
SDS -PAGE分析表明,SG-2和SG-3为Dx5型亚基,SG-1为Dx2型亚基。序列分析表明,SG-2和SG-3编码的亚基序列一致。测序表明,Dx5和Dx2亚基长度分别为847 aa和838 aa,相差9个氨基酸残基,差异主要位于第18位、第173位、第182位、第201位、第337位、第430位、第589位、第599位、第636位、第650位、第720位和第756位氨基酸,Dx2型亚基在599~607区间连续丢失9个氨基酸,在623~634区间分别连续丢失12个氨基酸(图5)。Dy亚基序列分析表明,SG-2和SG-3编码的亚基序列一致,Dy10和Dy12亚基长度分别为647 aa和657 aa,相差10个氨基酸残基,差异主要位于第130位、第186位、第215位、第264位、第300位、第393位、第491位、第546位、第551位、557位、第581位和第612位氨基酸。SG-1在77-78区间连续丢失2个氨基酸,SG-2和SG-3在200~205、229~234均丢失6个氨基酸(图6)。
2.5 籽粒表型分析
白粒小麦的商品性高于红粒小麦,天津地区主栽的强筋春小麦均为红粒品种,急需利用白粒优质强筋资源提升商品性。本研究在收集到的籽粒中,筛选到2个白粒资源SG-1和SG-3(图7-A、图7-C)。籽粒性状分析表明,SG-1、SG-2、SG-3的籽粒长度分别为0.70、0.66、0.76 cm;籽粒宽度分别为0.38、0.37、0.41 cm(图7-B、图7-D)。SG-1、SG-2、SG-3籽粒长度、宽度正常,可以作为白粒资源用于春小麦品质改良。
3 讨论与结论
由于目前强筋春小麦主栽品种多为红粒,商品性较差。白粒主栽品种津强7和津强12虽籽粒颜色为白色,但其加工品质达不到强筋小麦标准[17-18]。在育种上通常采用强强联合的方式配置杂交组合。因此,目前缺少强筋白粒资源。本研究鉴定到的SG-1材料SDS的沉降值为24.8 mL,高于天津主栽的强筋品种津强6号的沉降值23.2 mL。SG-1在育种中可能是可以利用的强筋白粒春小麦新资源,可与新创制的资源配置组合,提升新资源的综合农艺性状。
研究表明,谷蛋白与醇溶蛋白的含量比例(Glu/Gli)影响小麦加工品质[19]。同时醇溶蛋白和谷蛋白含量之间存在回补效应,即当醇溶蛋白含量降低时可能伴随谷蛋白含量的升高[20]。因此,醇溶蛋白含量降低能够提升小麦加工品质[20]。SG-1、SG-2在γ区中仅含有γ-1醇溶蛋白,缺失γ-2醇溶蛋白。SG-1由于缺少γ-2亚基,因而具备良好的小麦加工品质。
高分子量谷蛋白亚基对加工品质起到了重要的作用[21]。通过SDS-PAGE对高分子量谷蛋白亚基进行划分,不能获得序列变异信息。通过基因序列分析发现,虽然SG-1和SG-3在Glu-1B基因座位携带1By8亚基[22],但是序列存在差异。Glu-1D基因座位序列没有检测出序列差异,可能是B基因组起源复杂,而D基因组起源相对单一[23]。因此,未来需要建立一种可以在基因层面快速鉴定谷蛋白组成的方法,如芯片、标记等检测方法。
目前,强筋小麦的主要遗传机制在于Glu-1D基因座位携带优质的高分子量谷蛋白亚基1Dx5+1Dy10[24]。强筋春小麦除了携带1Dx5+1Dy10优质亚基外,在Glu-1B基因座位携带1Bx7OE亚基[25]。这些亚基的使用提升了小麦的加工品质,但是也造成了遗传资源狭窄的困境,小麦加工品质再次提升存在瓶颈。因此,需要引入新的基因资源,提升小麦加工品质。本研究发现了SG-1,虽然其加工品质优良,但是其高分子量谷蛋白亚基在Glu-1D基因座位携带的是非优质的高分子量谷蛋白亚基1Dx2+1Dy12。因此,其优质强筋的产生机制可能是醇溶蛋白引起的。在今后的研究中,本课题组计划对SG-1的籽粒胚乳进行全长转录组测序,获取其籽粒储藏蛋白转录本,进而解析其优质机理,用于小麦加工品质改良。同时对新创制的资源进行转录本测序,明确新资源在品质育种中的利用潜力。
由于SG-1不在Glu-1A位點携带1Axnull,其基因不表达,可以通过与天津主栽的优质强筋材料津强11号和津强6号进行杂交,在F2代中通过SDS-PAGE筛选携带Glu-1A2*、1Dx5+1Dy10、1Bx7OE+1By8亚基的材料,同时利用A-PAGE对醇溶蛋白进行筛选,过滤醇溶蛋白亚基较多的后代,创制超强筋新资源,选育白粒、优质、强筋新品种。
本研究初步解释了携带优质亚基的品种在加工品质上表现不佳的原因可能是氨基酸序列存在差异。同时,笔者发现,携带非优质亚基但具有优良加工品质的SG-1。这说明SG-1可能存在其他能够提升小麦加工品质的机制。
参考文献:
[1] ASSENG S, GUARIN J R, RAMAN M, et al. Wheat yield potential in controlled-environment vertical farms[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(32): 19131-19135.
[2] KUCHEL H, LANGRIDGE P, MOSIONEK L, et al. The genetic control of milling yield, dough rheology and baking quality of wheat[J]. Theoretical and Applied Genetics, 2006, 112(8): 1487-1495.
[3] WIESER H. Chemistry of gluten proteins[J]. Food Microbiology, 2007, 24(2): 115-119.
[4] SNYDER H. The proteins of the wheat kernel. By Thos. B. Osborne. Published by the Carnegie Institution of Washington, D. C. 1907. Pp. 119.[J]. Science, 1907, 26(677): 865.
[5] HENKRAR F, EL-HADDOURY J, IRAQI D, et al. Allelic variation at high-molecular weight and low-molecular weight glutenin subunit genes in Moroccan bread wheat and durum wheat cultivars[J]. 3 Biotech, 2017, 7(5): 287.
[6] 徐濤. 小麦 (Triticum aestivum L.) 高分子量麦谷蛋白1By15和1Dx1.5t基因高效表达载体的构建及转化研究[D]. 北京: 中国农业科学院, 2006.
[7] CAO S H, LI Z X, GONG G Y, et al. Identification and characterization of high-molecular-weight glutenin subunits from Agropyron intermedium[J]. PLoS One, 2014, 9(2): e87477.
[8] WANG D W, LI F, CAO S H, et al. Genomic and functional genomics analyses of gluten proteins and prospect for simultaneous improvement of end-use and health-related traits in wheat[J]. Theoretical and Applied Genetics, 2020, 133(5): 1521-1539.
[9] KRYSTKOWIAK K, LANGNER M, ADAMSKI T, et al. Interactions between Glu-1 and Glu-3 loci and associations of selected molecular markers with quality traits in winter wheat (Triticum aestivum L.) DH lines[J]. Journal of Applied Genetics, 2017, 58(1): 37-48.
[10] WANG D W, LI D, WANG J J, et al. Genome-wide analysis of complex wheat gliadins, the dominant carriers of celiac disease epitopes[J]. Scientific Reports, 2017, 7: 44609.
[11] HUO N X, ZHU T T, ALTENBACH S, et al. Dynamic evolution of α-gliadin prolamin gene family in homeologous genomes of hexaploid wheat[J]. Scientific Reports, 2018, 8(1): 5181.
[12] CHAUDHARY N, VIRDI A S, DANGI P, et al. Protein, thermal and functional properties of α-, γ- and ω-gliadins of wheat and their effect on bread making characteristics[J]. Food Hydrocolloids, 2022, 124(Part A): 107212.
[13] SAHLI L, BOIRE A, SOL?-JAMAULT V, et al. New exploration of the γ-gliadin structure through its partial hydrolysis[J]. International Journal of Biological Macromolecules, 2020, 165(Part A): 654-664.
[14] ANDERSON O D, GU Y Q, KONG X Y, et al. The wheat omega-gliadin genes: structure and EST analysis[J]. Functional & Integrative Genomics, 2009, 9(3): 397-410.
[15] SHEWRY P R, TATHAM A S, FORDE J, et al. The classification and nomenclature of wheat gluten proteins: a reassessment[J]. Journal of Cereal Science, 1986, 4(2): 97-106.
[16] UTHAYAKUMARAN S, T?M?SK?ZI S, TATHAM A S, et al. Effects of gliadin fractions on functional properties of wheat dough depending on molecular size and hydrophobicity[J]. Cereal Chemistry, 2001, 78(2): 138-141.
[17] 梁丹, 王从磊, 王建贺, 等. 国审优質强筋春小麦新品种津强7号的选育及栽培技术[J]. 农业科技通讯, 2014(10): 199-200.
[18] 梁丹, 王建贺, 李素敏, 等. 优质强筋春小麦新品种津强12号的选育及栽培技术[J]. 农业科技通讯, 2019(9): 261-262.
[19] LI M F, YUE Q H, LIU C, et al. Effect of gliadin/glutenin ratio on pasting, thermal, and structural properties of wheat starch[J]. Journal of Cereal Science, 2020, 93: 102973.
[20] LIU D, YANG H M, ZHANG Z H, et al. An elite γ-gliadin allele improves end-use quality in wheat[J]. The New Phytologist, 2023, 239(1): 87-101.
[21] LI Y, FU J H, SHEN Q, et al. High-molecular-weight glutenin subunits: genetics, structures, and relation to end use qualities[J]. International Journal of Molecular Sciences, 2020, 22(1): 184.
[22] CHEN Q, ZHANG W J, GAO Y J, et al. High molecular weight glutenin subunits 1Bx7 and 1by9 encoded by Glu-B1 locus affect wheat dough properties and sponge cake quality[J]. Journal of Agricultural and Food Chemistry, 2019, 67(42): 11796-11804.
[23] LUO M C, GU Y Q, PUIU D, et al. Genome sequence of the progenitor of the wheat D genome Aegilops tauschii[J]. Nature, 2017, 551(7681): 498-502.
[24] ALTPETER F, POPELKA J C, WIESER H. Stable expression of 1Dx5 and 1Dy10 high-molecular-weight glutenin subunit genes in transgenic rye drastically increases the polymeric glutelin fraction in rye flour[J]. Plant Molecular Biology, 2004, 54(6): 783-792.
[25] LI J, HAN C X, ZHEN S M, et al. Characterization of HMW glutenin subunit Bx7OEand its distribution in common wheat and related species[J]. Plant Genetic Resources, 2013, 12(2): 191-198.
收稿日期:2023-11-21
基金项目:“锡杂麦”小麦新品种栽培关键技术研发(XMZD202301)
作者简介:刘颖(1998—),女,河北张家口人,在读硕士生,主要从事小麦品质育种研究。
同等贡献作者简介:刘泮旭(1985—),男,天津人,高级农艺师,主要从事小麦种子推广研究。
通讯作者简介:刘丹(1989—),女,河北沧州人,副研究员,博士,主要从事小麦基因挖掘与功能验证相关研究。
袁卉馥(1970—),女,河北承德人,教授,硕士生导师,主要从事作物栽培研究。
