肝切除术后肝功能衰竭风险预测模型研究进展
2024-03-02许淙溪王继涛刘登湘郭军魏家豪
许淙溪,王继涛,刘登湘,郭军,魏家豪
(河北省邢台市人民医院 1.肿瘤内科 2.肝胆外科,河北 邢台 054000;3.河北省肝硬化与门静脉高压重点实验室,河北邢台 054000;4.承德医学院 研究生学院,河北 承德 067000)
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内最常见和高致死率的癌症之一,也是我国四大常见恶性肿瘤之一[1]。肝切除术依然是目前HCC最重要的根治性治疗手段之一[2-4]。近些年以来,伴随术者技术水平的提高,断肝器械、手术设备及围术期管理策略的不断进步,肝切除手术的适应证范围明显扩大、例数明显增多,术后病死率也逐渐下降[5]。然而,肝切除术后并发症的发生率仍然较高[6]。肝切除术后肝功能衰竭(posthepatectomy liver failure,PHLF)是肝切除术后最严重的并发症之一,也是患者术后死亡的主要诱因,严重威胁着患者的生命安全[7-8]。国际肝脏外科研究小组(International Study Group of Liver Surgery,ISGLS)将PHLF定义为肝脏维持其合成、排泄和解毒功能的能力受损,其特征是术后第5天或之后国际标准化比率(international normalized ratio,INR)增加,并伴有高胆红素血症[9]。在临床实践中,及时、准确地预测PHLF发生,尽早筛选PHLF高危患者,并提前对高危患者采取治疗可能会带来更高的临床获益[10]。国内外很多学者构建了基于Logistic回归等传统统计学方法的模型来预测PHLF,但仍存在着纳入危险因素不全面、预测效能相对不足等缺点,至今仍未有被广泛接受的PHLF预测方法。
临床诊疗过程中产生的高通量信息数据越来越庞大,使用传统统计学方法难以精准、快速地进行数据处理并挖掘内在规律。人工智能可以通过强大的数据处理能力,使用多种高级算法分析并归纳大量嘈杂数据集,并从中发现复杂的关系,便于指导临床决策[11]。人工智能的发展为解决PHLF早期预测问题带来了新的可能性。本文综述了PHLF风险预测模型的研究现状及进展,以期为更好地构建和应用PHLF风险预测模型提供参考。
1 常见PHLF评估方法
1.1 Child-Turcotte-Pugh评分
Child-Turcotte-Pugh(CTP)评分是评估肝功能的传统评分标准,最初由Child和Turcotte于1964年提出,随后由Pugh等[12]修改,包含腹水、肝性脑病、总胆红素、白蛋白(albumin,ALB)和凝血酶原时间(prothrombin time,PT)或INR等五个指标。该方法易于计算,能够区分出肝功能不良的患者。但是其有一定的局限性:首先,CTP评分没有考虑肾功能的影响;其次,CTP评分包含的腹水和肝性脑病严重等级的判断主观性强;再次,同属CTP评分A级的患者肝功能储备仍然存在差异;最后,CTP评分的开发基于临床经验[13],且包含的5项指标权重相等,因此在评估肝功能方面逊色于基于回归方法开发的评估方法[14-16]。
1.2 终末期肝病模型(model of end-stage liver disease,MELD)评分
2000年Malinchoc等[17]研究了美国4个医疗中心的231例经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunts,TIPS)患者数据,进一步开发了基于血清肌酐和胆红素、INR及肝病病因的MELD评分。该模型最早用于评估TIPS术后患者的生存率,并被广泛应用于评估肝硬化、肝移植、肝切除手术等预后风险。2001年,Kamath等[18]验证了MELD评分在多种病因患者中的有效性。MELD评分考虑了肾功能影响因素,更适用于合并肝硬化的患者[19],但未考虑门静脉高压因素,并且仍然包含主观因素。相较于CTP评分,它的一大优势在于根据变量对预后的影响分配了不同的权重,但也因此需要更复杂的计算,导致其在床旁的实用性不如CTP评分[16]。
1.3 吲哚菁绿15 min滞留率(indocyanine green retention rate at 15 min,ICG-R15)
ICG-R15反映肝细胞摄取与排泄能力,可以用于动态监测肝脏储备功能,优于血清生化指标[20]。有研究[21]显示,术中动态ICG比术前指标更能反映术后残余肝脏的功能。Wang等[22]比较了ICG-R15、CTP和MELD评分对PHLF的预测价值,发现ICGR15的曲线下面积(area under the curve,AUC)值最高。然而ICG-R15易受混杂因素影响[23],比如口服抗凝药物或患有严重心脏病会增加ICG-R15,胆汁排泄障碍、肝血流量减少也可影响ICG-R15[24],因此以ICG-R15为基础构建模型有一定的局限性。
1.4 ALB-胆红素(ALB-bilirubin,ALBI)评分、血小板-白蛋白-胆红素(platelet-ALB-bilirubin,PALBI)评分
2015年Johnson等[25]开发了ALBI评分模型,此模型仅包括血清ALB和胆红素两个简单客观的指标。由于大部分接受肝切除手术的HCC患者的肝功能分级为CTP A/B级,该评分将此类患者进一步细分为不同肝功能分级,更精细地评估肝功能。2020年,Fagenson等[26]通过分析13 783例患者数据发现ALBI评分预测PHLF的能力优于MELD评分(AUC:0.67vs.0.60)。尹子霄等[15]比较了CTP评分、MELD评分和ALBI评分,也得出ALBI评分预测效能最优的结论。Zou等[27]统计了473例患者数据,进一步比较了ALBI评分与CTP评分、MELD评分和ICG-R15的预测能力,证实了ALBI评分预测能力最好。
PALBI评分在ALBI评分的基础上纳入血小板计数(platelet count,PLT),能够更好地反映患者综合情况。Lu等[28]通过2 038例患者数据证实了PALBI评分可以预测接受肝切除术的肝功能分级CTP A级HCC患者发生PHLF的概率,AUC值为0.69。
传统肝功能评估方法构建时间较早,可用于预测PHLF的发生,但诊断效能相对不高[7](表1)。随着时代发展,越来越多的研究发现了多种术前和术中临床参数均影响PHLF发生。如何利用人工智能方法,将肝脏功能(合成、代谢和排泄)、未来残肝体积(future liver remnant,FLR)、存在肝硬化和门静脉高压、手术相关因素等临床参数统筹分析,构建更全面的PHLF预测模型,从而提高模型预测能力成为研究者们密切关注的问题。

表1 传统评估方法Table 1 Traditional evaluation methods
2 Logistic回归模型
2.1 手术相关模型
Wang等[29]基于总胆红素、ALB、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)、PT、临床显著门静脉高压(clinically significant portal hypertension,CSPH)和大范围肝切除术构建Logistic回归模型,该模型C指数为0.88,预测性能优于传统的CTP、MELD、ALBI评分。Xu等[30]结合三个术前变量(总胆红素、INR、PLT)和两个术中变量(切除范围、出血量)建立Logistic回归模型。该模型的AUC为0.84,同样优于传统的MELD和ALBI评分。近期另一项回顾性临床队列研究[31]构建了基于CSPH、肝切除范围、ALT、总胆红素和PLT的Logistic回归模型,预测PHLF的AUC为0.86。
2.2 影像相关模型
2.2.1 ALPlat标准 Yamamoto等[32]回顾性分析了来自8个中心的876例接受肝切除的HCC患者的数据,纳入PLT、PT、ALB和肝残余(liver remnant,Rem)建立了Logistic回归模型——ALPlat标准。此标准预测PHLF的AUC为0.75。
2.2.2 天门冬氨酸氨基转移氨酶与血小板计数比值指数-标准未来残肝体积(aspartate aminotransferase to platelet ratio index-standardized future liver remnant,APRI-sFLR)模型 2021年,Mai等[33]在一项纳入637例患者的单中心研究中,通过多因素Logisitc回归分析发现,前白蛋白、肝硬化、APRI评分、sFLR和大范围肝切除术与PHLF显著相关。该研究对比了CTP 评分、MELD评分、APRI评分、sFLR和APRI联合sFLR(APRI-sFLR)预测PHLF的能力,发现APRI-sFLR的预测能力最好(AUC=0.82)。该模型纳入了与肝体积相关的变量,获得了更好的预测效果。在一项回顾性研究中,Orimo等[34]发现标准化残余肝细胞摄取指数是PHLF的独立危险因素,其预测PHLF的AUC为0.87。APRI-sFLR模型如果能结合SrHUI或其他能够代表残肝质量的指标,或许能提高模型的预测能力。
对有实质性肝病的患者来说,具备正常功能的肝细胞并不是均匀分布的,用CT测量的FLR不能准确评估残余肝功能[35]。通过核成像直接测量肝脏代谢能力,如锝-99m半乳糖人白蛋白显像(technetium-99m galactosyl human albumin scintigraphy,99mTC GSA)[36-37],能更准确地评估功能性残肝体积。有研究者[38]构建了基于99mTC GSA的预后模型,预测PHLF的AUC为0.78。不过与CT相比,99mTC GSA在预测门静脉栓塞后大范围肝切除患者的PHLF方面不占优势[39]。
2.3 联合模型
单个评分模型难以涵盖影响PHLF的所有有效因素。因此,一些学者联合多角度指标建模。瞬时弹性成像测量的肝硬度(liver stiffness,LS)可以反映肝纤维化严重程度,已被证实是PHLF的独立预测因素[40]。LS在识别肝衰竭方面比CTP评分更敏感[41-43]。将LS与其他指标结合,可以对CTP评分相同的人群进行进一步细分,达到更精准的预测效果。有学者[44]纳入FLR指标和LS构建Logistic回归模型,模型的AUC为0.76。
将残肝体积及质量与手术相关因素联合考虑的模型也取得了不错的预测效果。Morino等[45]纳入Rem-ALPlat指数和两个术中变量(肝蒂阻断次数和失血量)构建Logistic回归模型。该模型预测PHLF的AUC为0.88,预测能力高于仅使用Rem-ALPlat指数的模型。此外,还有学者[46]联合放射组学特征、ALBI评分和ICG-R15建模,AUC为0.84。
联合多方面指标在提高模型预测能力的同时也会带来不方便应用的弊端。有研究者[47]创建了包含11个变量的Logistic回归模型,AUC为0.83。但是当去除4个术中变量后,AUC下降为0.74。相比之下,有研究者[48]纳入20个变量建模,AUC为0.80,但是只给出术前变量时AUC仅下降为0.78。该模型虽然由于纳入变量多而略为繁琐,但无论用于术前还是术后均能保持稳定的性能(表2)。
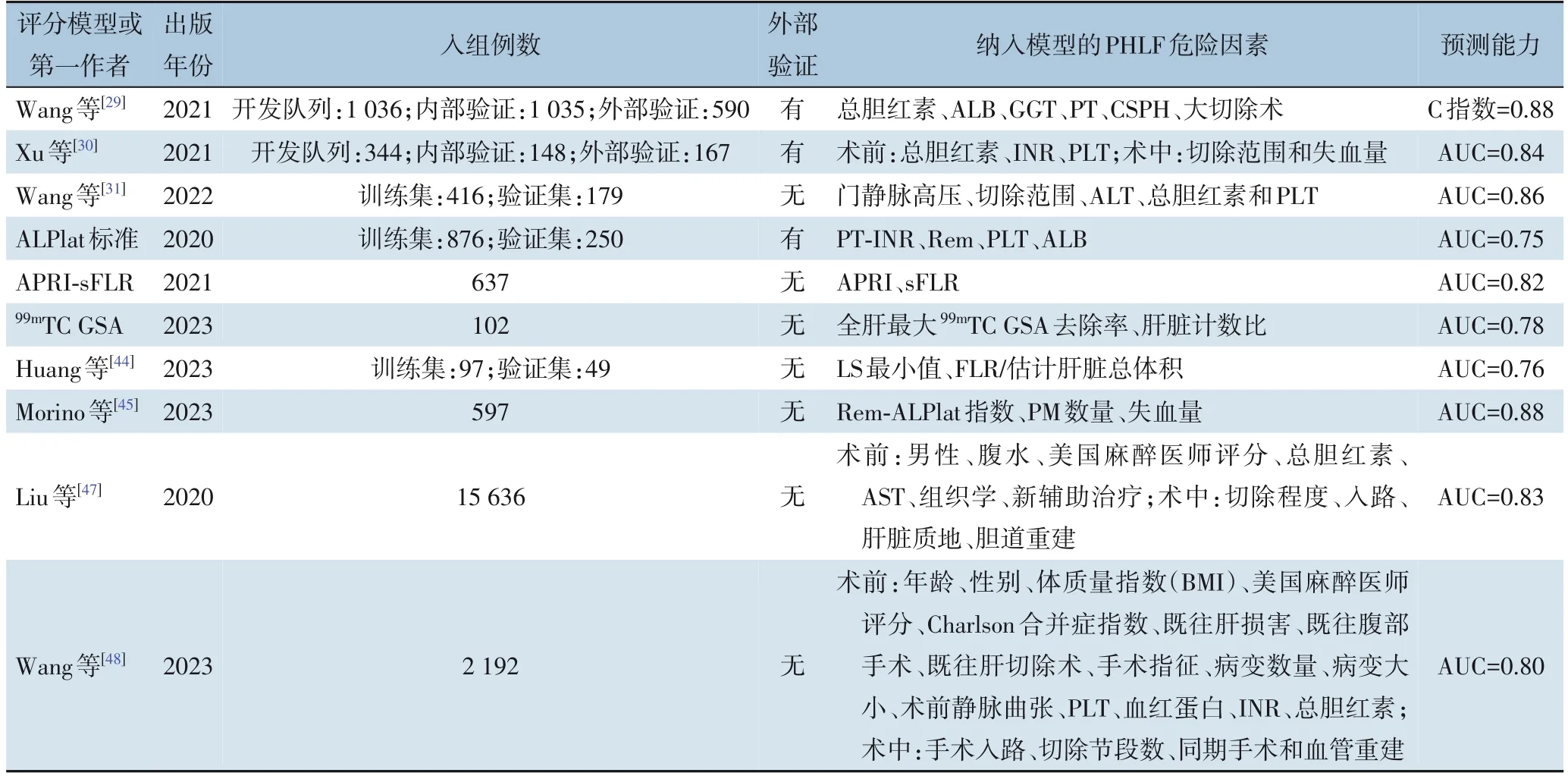
表2 基于Logistic回归方法构建的预测模型Table 2 Prediction models based on Logistic regression
3 机器学习模型
3.1 人工神经网络模型(artificial neural network model,ANN)
Mai等[49]结合PLT、PT、总胆红素、AST和sFLR建立并验证了预测PHLF的ANN,该模型的AUC值为0.88。该模型同时考虑了肝切除术后残余肝细胞的体积和肝功能情况,并且所用到的指标易于获取,适合应用于临床。但是由于缺乏数据,该模型没有纳入ICG-R15预测因子。因此未来应该结合更有效的风险因素构建更全面的模型。并且该研究为单中心回顾性研究,未来需要全面的多中心前瞻性研究进一步验证该模型的可靠性和实用性。
Lu等[50]回顾性研究了871例乙型肝炎病毒相关HCC患者,采用随机森林算法和Logistic回归法确定乙型肝炎病毒相关HCC患者发生PHLF的独立危险因素为:术前ALB、PT、总胆红素、AST、ICG-R15、sFLR和CSPH,并基于这些危险因素建立ANN来预测PHLF的风险,该模型在训练集、内部验证和外部验证集的AUC分别为0.85、0.86和0.87。相较于Mai等[49]的模型,该模型考虑了ICG-R15预测因子,并且在外部验证集中AUC同样较高。
3.2 LightGBM模型
Wang等[51]纳入875例多中心患者数据进行回顾性研究,筛选出PLT、年龄、肌酐(Cr)、INR和甲胎蛋白(AFP)为PHLF的独立危险因素,结合这些因素构建了采用LightGBM算法的机器学习预测模型(ML PHLF)并进行验证。该模型在训练队列、验证队列和测试队列中的AUC分别为0.94、0.87和0.82。研究者还将该模型与传统的ALBI评分、FIB-4、APRI、MELD评分和CTP评分进行比较,结果表明ML PHLF的预测能力最好。该模型采用的临床参数采集简便且客观性强,适用于大多数临床情景。基于机器学习构建预测模型不仅可以纳入更多临床参数,而且可以发现藏匿于复杂数据集中的规律,从而提高模型的预测能力。该研究采用ISGLS标准定义PHLF,且94.5%的患者CTP评分为A级,因此未来有待于进行前瞻性的多中心研究来确定ML PHLF模型在CTP评分B、C级和其他标准定义的PHLF中的预测价值(表3)。
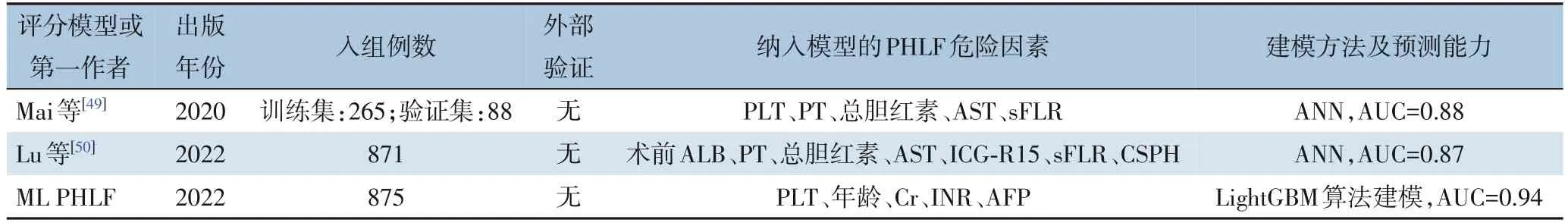
表3 基于机器学习方法构建的预测模型Table 3 Prediction model based on machine learning
4 总结与展望
笔者在PubMed、谷歌学术、Web of Science和CNKI数据库检索筛选了包含PHLF预测模型的文献。传统评估方法的AUC在0.64~0.83之间,中位AUC为0.69;基于Logistic回归的模型AUC在0.75~0.88之间,中位AUC为0.83;而基于机器学习方法建立的预测模型AUC在0.85~0.94之间,中位AUC为0.88。这提示基于机器学习方法构建的预测模型具有更好的预测能力。然而,目前应用机器学习方法建模的研究仍然较少。因此,未来可以基于机器学习方法构建更多具有较好预测能力的预测模型。当然,我们也要考虑到机器学习模型现在仍然是一个“黑匣子”,可解释性还不高。今后可以进一步开发解释性更高的机器学习模型,在提高模型预测能力的同时,使医护人员更清楚地理解模型的预测原理,这也有助于医护人员及时进行医疗干预和促进开发更加优秀的模型。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:许淙溪负责文献检索与撰写初稿;王继涛负责选题与修改文章;刘登湘负责设计指导研究,对整体写作过程中的问题进行指导;郭军负责文章知识指导、校对文章;魏家豪负责检索文献与筛选文献、校对文章。
