右美托咪定通过抑制RIPK/MLKL通路减轻OGD/R诱导的神经元坏死性凋亡
2024-03-01孙凯
孙凯
郑州大学第二附属医院麻醉与围术期医学部 郑州 450014
缺血性脑卒中(ischemic stroke,IS)是最常见的脑血管疾病。由于全麻后血管扩张及围术期禁饮食,常导致有效血容量降低,尤其对有基础病的老年患者,因脑血流灌注不足易发生围术期IS[1]。溶栓后所引发的脑缺血再灌注损伤(ischemia-reperfusion injury, I/R)将进一步加剧脑损伤。减轻脑缺血再灌注造成的脑损伤,对于治疗IS具有重要意义。坏死性凋亡是最新发现的一种兼具凋亡与坏死形态特征的细胞死亡方式[2]。研究表明,I/R过程中伴随着坏死性凋亡[3],而坏死性凋亡抑制剂可显著减轻I/R引起的脑损伤[4-5]。右美托咪定是一种常用的镇静药,具有良好的镇静、镇痛、抗焦虑、抑制交感活动作用[6],并可保护大脑免受I/R导致的损伤[7]。本研究采用HT22小鼠海马神经元细胞,在体外建立氧糖剥夺/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)模型,拟评价右美托咪定在体外对OGD/R诱导的神经元损伤的保护作用,并基于抑制坏死性凋亡探讨其作用机制。
1 材料和方法
1.1 材料
1.1.1 仪器 美国Bio-Rad公司的Imark酶标仪。美国Thermo Fisher公司的FRESCO21离心机。美国ABI公司的Q5荧光定量PCR仪。日本尼康公司的TS-2倒置荧光显微镜。美国Beckman公司的CytoFLEX流式细胞仪。
1.1.2 材料 HT22细胞购自中科院上海细胞库。右美托咪定(纯度≥98%)购自上海阿拉丁生化科技股份有限公司。DMEM培养基、青-链霉素双抗、胰酶购自美国Thermo Fisher公司。胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司。细胞计数试剂盒(cell counting kit-8,CCK-8)购自日本同仁化学研究所。乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所。ANNEXIN V-FITC/PI凋亡检测试剂盒购自北京索莱宝公司。总RNA提取试剂盒、cDNA合成试剂盒购自北京天根生物公司。SYBR荧光定量试剂盒购自美国Invitrogen公司。受体相互作用蛋白激酶1 (receptor-interacting protein kinase 1, RIPK1)、混合系列蛋白激酶样结构域(mixed lineage kinase domain like protein,MLKL)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国CST公司。增强型化学发光试剂(enhanced chemiluminescence,ECL)购自美国Merck公司。
1.2 方法
1.2.1 OGD/R模型的建立 HT22细胞培养于DMEM高糖培养基(含10% FBS,1%青-链霉素双抗)中。细胞长至约60%<70%时,采用PBS清洗细胞3次,将培养基更换为无血清无糖培养基,置于低氧培养箱(1% O2、5% CO2、94% N2)中培养12 h后,复糖复氧24 h。
1.2.2 细胞给药处理 (1)HT22细胞分为7组,右美托咪定分别设0、2.5、5、10、20、40、80 μM不同浓度梯度。给药处理24 h后,采用CCK-8检测细胞存活率。(2)HT22细胞分为5组,分别为对照组,OGD/R组,右美托咪定低、中、高浓度组(分别为2.5、5、10 μM)。细胞低氧12 h后,加入相应药物,复氧24 h后,检测细胞存活率、上清液中LDH含量,流式细胞仪检测细胞凋亡,收集细胞提取RNA和蛋白用于后续实验。
1.2.3 细胞存活率检测 HT22细胞培养于96孔板中,药物处理24 h后,每孔加入100 μL CCK-8溶液,置于37℃、5% CO2培养箱中培养1 h。采用酶标仪在450 nm处测定吸光值,计算细胞存活率。每组设置6个复孔,实验重复3次。
1.2.4 细胞上清LDH含量检测 HT22细胞培养于96孔板中,药物处理24 h后,1 000 rpm离心10 min,取上清液,按照试剂盒说明书加入反应试剂,采用酶标仪在450 nm处测定吸光值,计算上清液中LDH含量。每组设置6个复孔,实验重复3次。
1.2.5 流式细胞仪检测细胞凋亡 HT22细胞培养于6孔板中,药物处理24 h后,加入胰酶消化2 min,加入血清终止消化。1 000 rpm离心10 min,弃上清,加入PBS清洗3次,1 000 rpm离心10 min,弃上清,PBS重悬细胞,加入5 μL Annexin V/FITC染料吹打混匀,室温避光孵育5 min,加入5 μL PI染料后上机检测。
1.2.6 逆转录-聚合酶链式反应(reverse transcription-quantitative polymerase chain reaction,RT-qPCR) HT22细胞培养于6孔板中,药物处理24 h后,消化并收集细胞,采用试剂盒提取细胞总RNA,反转录合成cDNA,采用SYBR荧光定量PCR试剂盒进行扩增。反应条件为:95℃预变性2 min,95℃变性20 s,60℃退火延伸20 s,共40个循环。以GAPDH作为内参,采用2-△△Ct法计算目的基因的相对表达量。引物由上海Invitrogen公司合成,序列为:RIPK1:5’-CTGTTCCCTGTGCCCAATAA-3’ (sense),5’-ATGACTCTGAAGCTGTCCTTT C-3’ (antisense);MLKL:5’-UCAAGGACGUGAACAGGAATT-3’ (sense),5’-UU CCUGUUCACGUCCUUGATT-3’ (antisense);GAPDH: 5’-CAAGGTCATCCA TGACAACTTTG-3’ (sense),5’-GGCCATCCACAGTCTTCTGG-3’ (antisense)。
1.2.7 免疫印迹(Western blot) HT22细胞培养于6孔板中,药物处理24 h后,消化并收集细胞,加入RIPA裂解液,超声破碎10 s,静置裂解20 min,12 000 g离心20 min,收集上清。采用BCA试剂盒检测蛋白浓度,加入loading buffer 后于100℃加热10 min,进行SDS-PAGE凝胶电泳。湿法转移至PVDF膜,5%脱脂奶粉室温封闭2 h,加入一抗(RIPK1: 1∶1 000,MLKL:1∶2 000,GAPDH:1∶5 000),4℃摇床孵育过夜。PBST漂洗3次,加入HRP标记的二抗孵育30 min,PBST漂洗3次,滴加ECL显色液后显影,计算目的蛋白的相对表达量。

2 结果
2.1 右美托咪定对OGD/R诱导的HT22细胞存活率的影响与对照组比较,右美托咪定浓度在20 μM以上显著降低了HT22细胞存活率,差异有统计学意义(P<0.05);当浓度低于10 μM时对细胞存活率无影响,因此后续研究选择10 μM以下浓度。与对照组比较,OGD/R组细胞存活率显著降低,差异有统计学意义(P<0.001)。与OGD/R组比较,右美托咪定5 μM和10 μM组均显著提高了细胞存活率,差异有统计学意义(P<0.01,P<0.001)。见图1。

注:与Control组相比,*P<0.05,**P<0.01,***P<0.001;与OGD/R组相比,##P<0.001,###P<0.001图1 右美托咪定对OGD/R处理HT22细胞存活率的影响
2.2 右美托咪定对OGD/R诱导的HT22细胞上清LDH含量的影响与对照组比较,OGD/R组细胞上清中LDH含量显著增加,差异有统计学意义(P<0.001)。与OGD/R组比较,右美托咪定5 μM和10 μM浓度组的LDH含量显著降低,差异有统计学意义(P<0.001)。见图2。
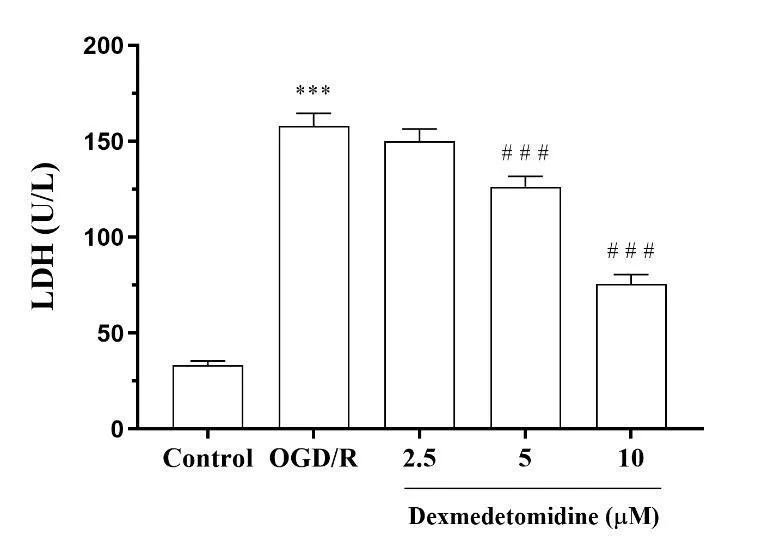
注:与Control组比较,***P<0.001;与OGD/R组比较,###P<0.001图2 右美托咪定对OGD/R处理HT22细胞上清LDH含量的影响
2.3 右美托咪定对OGD/R诱导的HT22细胞凋亡的影响与对照组比较,OGD/R组细胞凋亡率显著升高,差异有统计学意义(P<0.001)。与OGD/R组比较,右美托咪定5 μM和10 μM浓度组的细胞凋亡率显著降低,差异有统计学意义(P<0.001)。见图3。

注:与Control组比较,***P<0.001;与OGD/R组比较,###P<0.001图3 右美托咪定对OGD/R处理HT22细胞凋亡率的影响
2.4 右美托咪定对OGD/R诱导的HT22细胞RIPK和MLKL的mRNA表达的影响与对照组比较,OGD/R组细胞RIPK1和MLKL的mRNA表达水平均显著升高,差异有统计学意义(P<0.01);与OGD/R组比较,右美托咪定5 μM和10 μM组RIPK1和MLKL的mRNA表达水平均显著下调,差异有统计学意义(P<0.01)。见图4。
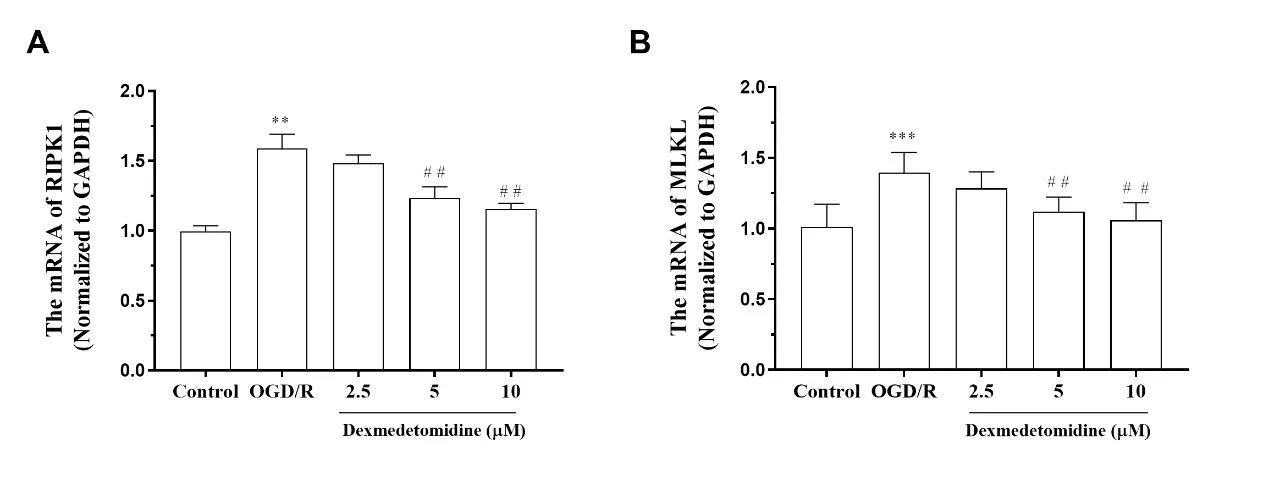
注:与Control组比较,**P<0.01;与OGD/R组比较,##P<0.01图4 右美托咪定对OGD/R处理HT22细胞RIPK和MLKL的mRNA表达水平的影响
2.5 右美托咪定对OGD/R诱导的HT22细胞RIPK和MLKL蛋白表达的影响与对照组比较,OGD/R组细胞RIPK1和MLKL的蛋白表达水平均显著升高,差异有统计学意义(P<0.01,P<0.001)。与OGD/R组比较,右美托咪定5 μM和10 μM组RIPK1和MLKL的蛋白表达水平均显著下调,差异有统计学意义(P<0.01)。见图5。

注:与Control组比较,**P<0.01,***P<0.001;与OGD/R组比较,#P<0.05,##P<0.01,###P<0.001图5 右美托咪定对OGD/R处理HT22细胞RIPK和MLKL的蛋白表达水平的影响
3 讨论
近年来,IS的发病率逐年上升,我国每年约有190万人死于IS[8]。及时恢复大脑供血是降低IS病死率的关键,但再灌注会造成脑组织新的损伤。因此,合理选择具有脑保护作用的麻醉药可有效减轻脑卒中引起的大脑损伤。本研究采用OGD/R处理HT22细胞,发现右美托咪定可显著减轻OGD/R诱导的神经元凋亡,提高细胞存活率,减少LDH的释放,与有关研究的结果一致[9]。
大量研究表明,坏死性凋亡是I/R引起大脑神经元死亡的重要方式,而抑制坏死性凋亡可显著减轻I/R造成的脑损伤[3,6]。坏死性凋亡是一种依赖于RIPK和MLKL的细胞程序性坏死,其中RIPK1是坏死性凋亡的关键调控因子,其N端参与激活NF-κB信号,C端可与TNFR1相互作用,而同型作用结构域可与RIPK3结合形成坏死小体并参与诱导坏死性凋亡[2]。研究表明,RIPK1在I/R模型中表达显著上调,RIPK1抑制剂可显著减轻I/R引起的小鼠脑组织损伤[4,10]。MLKL是坏死性凋亡的执行者,其N端有个4HB结构域,正常时与C端的假性激酶样区域结合而保持失活状态。当RIPK1促使RIPK3活化后,RIPK3与MLKL结合,并使其暴露出4HB结构域,促使MLKL向细胞膜发生异位并寡聚化,影响细胞膜上的离子通道,促使水钠内流及钾离子外流,升高细胞内渗透压,导致细胞坏死性凋亡[11]。另外,寡聚化的MLKL还可以与磷酸肌醇结合,直接破坏细胞膜的完整性而导致细胞坏死[12]。MLKL抑制剂可通过抑制坏死性凋亡,减轻急性缺血性脑损伤[5]。本研究中,RIPK1和MLKL的表达在OGD/R组均显著升高,表明OGD/R诱导了细胞坏死性凋亡。右美托咪定可通过下调RIPK1的表达抑制MLKL活化,减轻OGD/R诱导的细胞坏死性凋亡。Chen等[13]在心肌细胞中也证实了右美托咪定可抑制低氧/复氧诱导的坏死性凋亡。
综上所述,右美托咪定可通过抑制坏死性凋亡减轻OGD/R诱导的神经元损伤,不仅揭示了右美托咪定的神经元保护作用机制,也为右美托咪定在临床麻醉中减轻围术期IS提供了实验依据。
