超高效液相色谱-串联质谱法快速测定挂面、方便面中15 种真菌毒素
2024-02-29曹瀚文
许 嘉 王 硕 曹瀚文
(北京市朝阳区疾病预防控制中心, 北京 100025)
真菌毒素 (Mycotoxins) 是由某些真菌产生的化合物, 常见的真菌毒素包括黄曲霉毒素B1(AFB1)、 黄曲霉毒素B2(AFB2)、 黄曲霉毒素G1(AFG1)、 黄曲霉毒素G2(AFG2)、 雪腐镰刀菌烯醇 (NIV)、 脱氧雪腐镰刀菌烯醇 (DON)、 3-乙酰基脱氧雪腐镰刀菌烯醇(3-AcDON)、 15-乙酰基脱氧雪腐镰刀菌烯醇 (15-AcDON)、 玉米赤霉烯酮 (ZEA)、 赭曲霉毒素A (OTA)、 伏马菌素B1(FB1)、 伏马菌素B2(FB2)、 伏马菌素B3(FB3)、 T-2 毒素和HT-2 毒素等。 这些毒素在食品安全领域引起了全球关注, 因为它们广泛存在于各种谷物及其制品中, 对人类和动物健康有显著影响。 据联合国粮食及农业组织估计, 全世界谷物供应链25%受到真菌毒素的污染, 对人体和动物的健康具有极大危害[1]。 小麦在生长时期容易受到镰刀菌、 青霉菌、 曲霉菌等致病菌的污染[2]。 侵染小麦的镰刀菌产生的DON、 ZEA、 T-2 和HT-2 这4 种镰刀菌毒素对小麦污染情况最为严重[3]。 另外,伏马菌素主要污染玉米、 小麦等粮食作物, 在大豆、 坚果中也有分布[4]。 基于小麦广泛被多种真菌毒素污染的背景, 本研究选择同时测定15 种污染严重、 风险较高的真菌毒素(AFB1、 AFB2、 AFG1、AFG2、 NIV、 DON、 3 -AcDON、 15 -AcDON、ZEA、 OTA、 FB1、 FB2、 FB3、 T-2 和HT-2 毒素)。
目前, 真菌毒素的检测方法包括酶联免疫法[5]、 荧光免疫分析法[6]、 薄层色谱法[7]等。 相较于上述测定方法, 超高效液相色谱-串联质谱法(UPLC-MS/MS) 可降低假阳性率、 改进分离不完全[8~9]的问题, 具有高通量、 操作简单、 快速灵敏、回收率高、 重复性好等特点。 UPLC-MS/MS 通过高度灵敏的质谱检测, 能够确保非常低的检出限,并准确鉴定微量的真菌毒素, 这对于评估食品(如谷物和挂面、 方便面) 中的低浓度真菌毒素至关重要[10]。 且因具有高通量的分析特性, 使UPLCMS/MS 可以同时检测多种真菌毒素, 极大地提高了样品处理的效率, 特别适用于大规模的食品安全监测[11]。 同时, 由于其高灵敏度和强大的分离能力, 采用UPLC-MS/MS 时允许使用更为简单的样品前处理步骤, 如简单的萃取和净化, 从而减少样品处理时间并降低成本[12]。
在我国, 谷物是居民膳食结构的核心成分, 尤其在北方, 小麦的种植和消费可以追溯到几千年前, 它与当地的历史、 文化和生活方式密不可分。在现代社会, 人们的生活节奏加快, 对方便食品的需求随之增加, 这使得像挂面和方便面这样的产品成为了消费热点。 这种转变也带来了食品安全上的新挑战。 真菌毒素, 特别是在存储不当的情况下,可能在谷物中滋生, 进而污染食品。 鉴于这种风险, 确保产品质量和安全性显得尤为重要。 为此,需要制定严格的检测标准和方法, 确保消费者能够放心食用。 本研究拟基于UPLC-MS/MS 开发一种针对挂面和方便面中多种真菌毒素的快速测定方法, 以期满足监管机构要求, 也为广大消费者健康提供有力技术保障。
一、 材料与方法
(一) 仪器与设备超高效液相色谱-串联三重四极杆质谱仪 (ACQUITY UPLC I-Class/Xevo TQ-S, 美国Waters 公司), 配有电喷雾离子源(ESI); 电子天平(日本岛津公司); 振荡器(德国Elma 公司); 高速粉碎机(上海比朗仪器制造有限公司); 漩涡混匀器 (德国IKA 公司); 高速冷冻离心机(美国Sigma 公司)。
(二) 试剂乙腈、 甲醇(色谱纯, 美国Thermo Fisher Scientific 公司); 甲酸(色谱纯, 美国Acros Organics 公司)。 乙腈-水-甲酸溶液(70∶29∶1,V∶V∶V): 量取700 mL 乙腈加入290 mL 水中,加入10 mL 甲酸, 混匀。 0.1%甲酸甲醇溶液: 吸取1 mL 甲酸, 用甲醇稀释至1 L, 混匀。 0.1%甲酸水溶液: 吸取1 mL 甲酸, 用超纯水稀释至1 L,混匀。
(三) 标准物质与标准溶液
1.内标物质。13C20-OTA, 10.00 μg/mL;13C34-FB1, 5.04 μg/mL;13C34-FB2, 5.05 μg/mL;13C34-FB3, 10.02 μg/mL;13C17-AFB1, 0.500 μg/mL;13C17-AFB2, 0.500μg/mL;13C17-AFG1, 0.502μg/mL;13C17-AFG2, 0.502μg/mL;13C18-ZEA, 25.2 μg/mL;13C15-NIV, 25.30 μg/mL;13C15-DON, 10.0 μg/mL;13C17-3-AcDON, 25.3 μg/mL;13C22-HT-2, 10.1 μg/mL;13C22-T -2, 1.02 μg/mL。 以上均购自ROMER 公司。
2. 混合标准储备液。 吸取一定量的标准溶液,用甲醇定容至10 mL, 涡旋混匀, 在-20℃保存。
3.混合同位素内标标准储备液。 分别移取一定体积的15 种真菌毒素同位素标准溶液于5 mL 容量瓶中, 用乙腈稀释定容至刻度, 充分混匀后于-20℃避光保存。
4.标准曲线溶液。 准确移取混合标准储备液适量, 用超纯水逐级稀释, 配制成不同浓度点的混合标准曲线系列溶液。 分别准确移取10 μL 混合同位素内标标准储备液于各内插管中, 加入190 μL 对应的混合标准曲线浓度点溶液, 于涡旋混合器上混合均匀, 配制成标准曲线溶液系列。
(四) 仪器条件
1. 色谱条件。 色谱柱为Cortecs UPLC C18柱(150 mm×2.1 mm, 1.6 μm)。 流动相A 为0.1%甲酸水溶液, 流动相B 为0.1%甲酸甲醇溶液; 柱温为40℃; 样品室温度为10℃; 进样量为5 μL。 梯度洗脱条件见表1。

表1 液相色谱梯度洗脱程序
2. 质谱条件。 离子源为ESI, 正离子模式; 质谱扫描方式为多反应监测模式(MRM); 锥孔电压为3.0 kV; 加热气温度为400℃; 离子源温度为150℃; 脱溶剂气流速为800 L/h。 各目标化合物及其内标物的保留时间、 定性定量离子对及锥孔电压、 碰撞能量见表2。
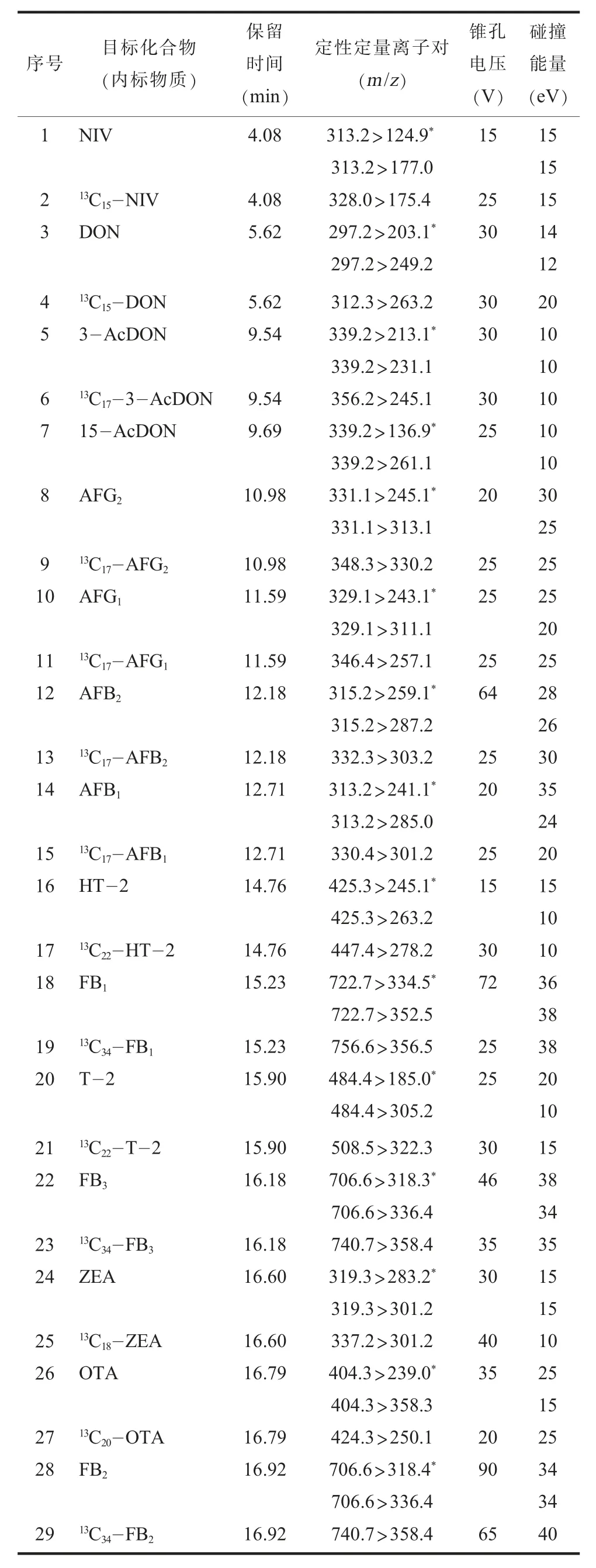
表2 15 种目标化合物和14 种内标物质的质谱参数
(五) 样品处理
1.样品前处理。 用高速粉碎机将挂面、 方便面粉碎, 过筛, 使其粒径小于0.5~1 mm 孔径试验筛, 混合均匀后储存于样品瓶中, 密封保存, 置于-20℃低温冰箱中保存, 供检测用。
2. 提取与净化。 测试样品: 准确称取5 g (精确到0.01 g) 试样于50 mL 离心管中, 加入20 mL乙腈-水-甲酸溶液 (70∶29∶1,V∶V∶V), 并用涡旋混合器混匀1 min, 置于旋转摇床上振荡提取30 min, 然后以8 000 r/min 离心5 min。 准确转移0.5 mL 上清液于1.5 mL 离心管中, 加入1.0 mL水, 旋涡混匀后, 在4℃下以10 000 r/min 离心10 min, 吸取上清液过0.22 μm 滤膜。 吸取190 μL 处理好的样品滤液于300 μL 内插管中, 加入10 μL稳定同位素混合溶液, 混匀, 待上机检测。
3.空白试验。 除不称取试样外, 均按上述步骤进行。
二、 结果与分析
(一) 色谱柱的选择考察比较了Cortecs UPLC C18(150 mm×2.1 mm, 1.6 μm)、 Capcell Pak C18(100 mm×2.1 mm,2 μm) 和Waters ACOUITY(100 mm × 2.1 mm, 1.8 μm) 3 种色谱柱对目标化合物的分离效果。 结果显示, 当采用Cortecs UPLC C18柱时, 目标化合物分离好, 峰形尖锐, 保留时间适中, 能满足定量检测要求。 因此, 最终选择Cortecs UPLC C18色谱柱 (150 mm×2.1 mm, 1.6 μm)。
(二) 色谱条件的优化UPLC-MS/MS 检测样品时, 流动相的组成与配比会影响目标化合物的离子化效率和色谱峰峰形。 基于目标化合物易溶于甲酸水溶液、 甲酸甲醇溶液等溶剂的特性, 本研究比较了0.1%甲酸水溶液-0.1%甲酸甲醇溶液及超纯水 (含0.1%氨水) -0.1%甲酸甲醇溶液等不同流动相体系下的分离效果。 结果显示, 水相中添加0.1%甲酸后, H+浓度增加, 使得正离子扫描模式下目标物的离子化效率提高; 同时甲醇溶液作有机相添加0.1%甲酸后, 可提高负离子的响应强度并改善峰形。 此外, 也有文献报道在ESI+模式下, 加入甲酸有利于提高目标物的离子化效率, 增大其灵敏度[13~14]。 因此, 综合考虑最终选择0.1%甲酸水溶液-0.1%甲酸甲醇溶液作为流动相体系, 并通过优化梯度洗脱 (结果见表1), 使各目标化合物较好地分离, 色谱峰峰形良好。
(三) 质谱条件的优化配制15 种真菌毒素的混合标准溶液, 将标准溶液用独立针泵以5 μL/min 流速注入质谱, 在电喷雾离子源下, 进行一级母离子全扫描, 比较正、 负离子模式下的响应, 选择合适的模式, 优化质谱毛细管电压、 锥孔电压、 碰撞能量、 去簇电压、 雾化气、 气帘气, 检测得到具有最强响应的定量离子和定性离子对(见表2)。
(四) 提取溶剂的选择目前常用的提取溶剂主要为甲醇-水、 乙腈-水-甲酸、 乙腈-水等。在极性溶剂中加入一定比例的水后进行提取, 可提高其对样品的渗透性从而提高提取效率[15]。 本研究参考不同文献中的提取溶剂, 选取甲醇-水(70∶30,V∶V)、 乙腈-水-甲酸 (70∶29∶1,V∶V∶V)、 乙腈-水 (50∶50,V∶V) 进行对比,结果见图1。 结果显示, 乙腈-水-甲酸 (70∶29∶1,V∶V∶V) 作为提取溶剂时, 15 种目标化合物的回收率较甲醇-水(70∶30,V∶V) 条件下高; 而相较于乙腈-水(50∶50,V∶V) 作提取溶剂时, 虽然HT-2 的回收率有所下降, 但其下降幅度不超过3.5%, 且DON、 FB2、 FB3的回收率有了明显提高, DON 的回收率由74.0%提高到89.6%,FB2由75.8%提高到89.4%, FB3的回收率由69.7%提高到84.9%。 加入甲酸不仅有助于维持DON、FB2、 FB3的稳定性, 避免在萃取和分析阶段的降解, 而且它优化了ESI 的离子产生过程, 从而增强了检测的灵敏度。 因此, 本研究最终选择乙腈-水-甲酸 (70∶29∶1,V∶V∶V) 作为提取溶剂。这与谢慧英等[16]研究选用的提取溶剂相同, 但体积比略有不同。
(五) 线性关系、 方法检出限与定量限目标化合物使用同位素内标, 以空白样品的提取液作为标准溶液的稀释液, 配制基质匹配系列工作曲线。以待测物的质量浓度(μg/L) 为横坐标, 目标化合物的峰面积为纵坐标制作标准曲线。 结果显示, 15种真菌毒素在一定浓度范围内线性关系良好, 相关系数大于0.99 (见表3)。 以3 倍信噪比(S/N=3)和10 倍信噪比 (S/N=10) 时相应的加标量为方法的检出限(LOD) 和定量限(LOQ), 结果显示,方法LOD 为0.1~33.0 μg/kg, 方法LOQ 为0.2~100.0 μg/kg。 方法的灵敏度完全满足国家标准对真菌毒素的限量要求。

表3 15 种真菌毒素的线性范围、 回归方程、 相关系数、 检出限和定量限
(六) 准确度与精密度对样品进行3 个浓度水平的加标回收试验, 每个浓度水平进行6 次重复实验, 计算测定结果的相对标准偏差 (RSD)。 结果显示, 15 种真菌毒素的平均回收率为76.9%~110.4%, RSD 为0.1%~7.1%(见表4)。 方法准确性高, 稳定性好, 符合GB/T 27404-2008 《实验室质量控制规范 食品理化检测》 对实验室质量控制范围的要求。
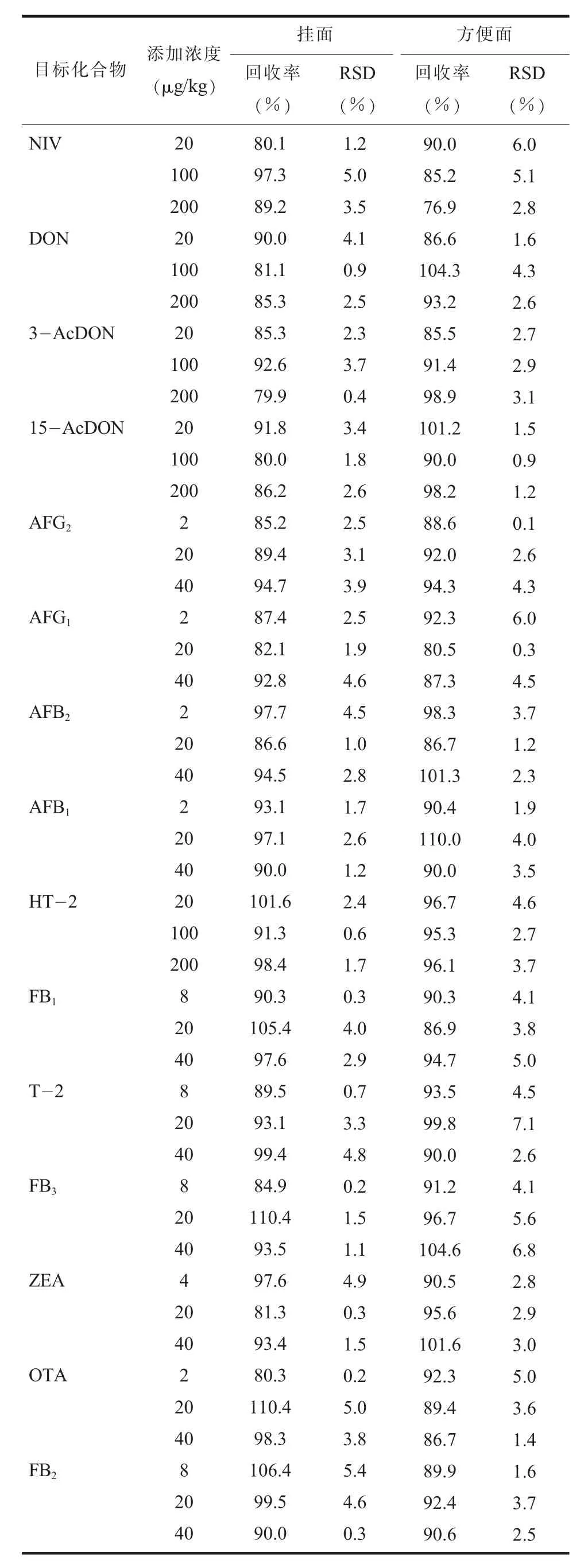
表4 15 种真菌毒素在挂面、 方便面中的回收率与精密度 (n=6)
三、 结论
在食品安全领域, 真菌毒素的检测是一个十分重要的研究课题。 面对真菌毒素的结构多样性, 研究人员们必须不断革新和优化检测方法。 该研究践行了这一理念, 构建了一种挂面、 方便面中15 种真菌毒素的超高效液相色谱-串联质谱检测方法。该 方法利用MRM 模式, 确保了对各类真菌毒素的高灵敏度检测, 使得即便是微量的毒素也能被准确捕捉和分析。 此外, 该方法能够同时进行真菌毒素的定性和定量分析, 具有极高的应用价值和应用前景, 为食品安全领域提供了一种新的、 可靠的检测手段。
