紫外可见光谱法测定抗体偶联药物药物-抗体偶联比的方法建立和验证
2024-02-29白露陈苗苗王远芝黄铭蕊赵永新
白露,陈苗苗,王远芝,黄铭蕊,赵永新
目的 建立基于紫外可见光谱检测抗体偶联药物(ADC)药物-抗体偶联比(DAR)的检测方法并进行验证。
方法 使用盐酸胍作为变性剂,修正基于氨基酸组成推算的抗体在 280 nm 处消光系数。利用比尔-朗伯定律测定抗体和小分子药物在 252 nm 处的消光系数及小分子药物在280 nm 处的消光系数。确定基于紫外可见光谱检测 ADC的 DAR 公式参数和检测方法。根据《中华人民共和国药典》(2020)指导原则,对方法进行验证。
结果 抗体在 252 nm 和 280 nm 处的摩尔消光系数分别为 91258 和 228913 L/(mol·cm);tubulysin 衍生物小分子药物在 252 和 280 nm 处的摩尔消光系数分别为 12798和 3186 L/(mol·cm)。DAR =(A280-ADC × 91258 - A252-ADC ×228913)/(A252-ADC × 3186 - A280-ADC × 12798)。方法专属性符合要求。模拟 DAR 值为 1.881 ~ 15.045 的 ADC 药物进行准确性验证,回收率为 79.38% ~ 99.13%。重复性相对标准偏差(RSD%)为 1.93%,中间精密度 RSD% 为2.36%。以 252 nm 处吸光值与 280 nm 处吸光值的比值为纵坐标,以模拟 DAR 值为横坐标进行线性回归的方程为y = 0.0408x + 0.414,相关系数 r2 为 0.9954。根据 DAR 测定公式推算该方法的检测范围为 0.60 ~ 82.56。不同检测波长[(280 ± 1)或(252 ± 1)nm]、不同放置时间(0 ~ 60 min)、不同批次的比色皿条件下,DAR 值检测结果的 RSD% 均< 5.0%。
结论 基于紫外可见光谱法进行抗体偶联药物 DAR 测定的方法简单、可操作性强,专属性、准确度、精密度、耐用性满足检测需求,该方法可以用于抗体偶联药物的质量分析和质量控制。
自 Paul Ehrlich 百年前提出特异性杀伤癌细胞的“魔术子弹”概念,特别是近 40 年,伴随着单克隆抗体创新技术进步,单克隆抗体偶联药物(ADC)也日臻成熟和加速迭代发展[1]。由于结合了抗体的特异性和小分子药物的杀伤性,ADC 药物相比传统化疗或放疗疗法具有更高的疗效和更低的副作用。因此自 2000 年首款 ADC 药物上市以来,至今已经有 15 款 ADC 药物上市,尤其是在过去 5 年内有 10 款 ADC 药物获批上市。
药物-抗体的平均偶联比(drug-antibody ratio,DAR)表示每个抗体上平均偶联的小分子数量。低DAR 值的 ADC 药物疗效弱,高 DAR 值的ADC 药物毒性增加的同时清除率也会增加[2]。同时,偶联疏水性毒素分子或连接体时,高 DAR 的ADC 药物容易产生沉淀[3]。因此,DAR 值直接与ADC 药物的安全性和疗效相关,是其重要的质量属性之一[4]。
检测 ADC 药物 DAR 值的方法主要有高效液相色谱法、质谱分析法和紫外可见光谱法。三种方法的检测原理各不相同、各有优缺点。液相色谱法主要包括疏水色谱(HIC-HPLC)和反相色谱(RP-HPLC)法。疏水色谱法根据偶联药物后疏水性的不同进行分离,通常偶联的小分子药物为疏水性分子,偶联越多疏水性越强,保留时间也越长。各峰面积的百分比也代表偶联不同数量小分子药物的 ADC 分布。通过对分离物峰面积百分比的计算获得 DAR 值[5]。相比疏水色谱,反相色谱法需要使用变性剂对 ADC 药物进行还原,然后分离重、轻链和偶联不同数量小分子的重、轻链,通过不同组分的面积百分比计算获得 DAR 值[5-6]。质谱法作为强大的分析工具,不仅可以进行 DAR 值的测定,还可进行药物偶联分布的分析[7-8]。除此之外,也有学者利用双波长的分子排阻色谱法在检测药物分子大小变异体的同时测定药物的 DAR 值[9]。
虽然上述 DAR 值测定方法精度高,但其设备昂贵,对操作人员要求高,方法开发参数多、周期长、数据处理量大。相比之下紫外可见光谱法操作简单、成本低、检测时间短,是目前常用的 DAR 值检测方法。尤其是在 ADC 生产过程中的产品放行和质量控制方面具有广泛应用性。紫外可见光谱法利用比尔-朗伯定律,将 ADC 药物作为多组分溶液,利用抗体消光系数和小分子消光系数分别测定抗体和小分子药物的摩尔浓度,进而计算出 ADC药物的 DAR 值。但在该方法建立和验证的过程中存在诸多问题和困难,误差较大,如:利用抗体氨基酸组成预测消光系数[10]时,未考虑抗体高级空间结构(折叠、螺旋)对消光系数的影响[11];未对小分子药物进行消光系数测定;或者引用类似结构小分子的消光系数时未考虑结构差异对消光系数的影响;由于 ADC 药物制备工艺的复杂性和不同检测方法测定 DAR 值的差异,不易获得 DAR 的理论值用于准确度的验证。基于此,本研究利用盐酸胍对抗体进行变性,通过变性前后吸光值的变化修正推算的理论消光系数,获得抗体的实际消光系数。同时,利用不同浓度的小分子溶液,消除浓度对小分子药物消光系数测定的影响。最后,通过模拟摩尔比作为准确度验证的理论值优化该方法的验证过程。
1 材料与方法
1.1 材料
IgG1 抗体、微管抑制剂类 tubulysin 衍生物小分子药物和通过半胱氨酸随机偶联的抗体药物偶联物由本实验室制备和保存;Cary 3500 型紫外可见光分光光度计为美国 Agilent 公司产品;磷酸二氢钠、氢氧化钠、盐酸胍购自上海阿拉丁生化科技股份有限公司。
1.2 方法
1.2.1 抗体消光系数的测定 根据抗体的氨基酸组成,计算组成抗体的酪氨酸、色氨酸以及胱氨酸(半胱氨酸个数的一半)数目(N)。根据公式① 计算抗体在 280 nm 处的理论摩尔消光系数(εAb-280理论)。
其中:ε酪氨酸= 1490,ε色氨酸= 5500,ε胱氨酸=125[11]
分别用天然缓冲液(pH 6.0 的磷酸盐缓冲溶液,PBS)和变性缓冲液(6 mol/L 盐酸胍缓冲液,GH)稀释抗体,分别测定抗体溶液在 280 和 320 nm处的吸光值(A280-Ab、A320-Ab),根据公式 ②[11]计算抗体在 280 nm 处的实际消光系数(εAb-280)。依据公式 ③、④ 计算抗体摩尔浓度(CAb)及抗体在 252 nm 处的摩尔消光系数εAb-252。
式中,L 是通过含分析物的比色皿的路径长度(通常为 1 cm)。
1.2.2 药物消光系数的测定 测定不同浓度tubulysin 小分子药物在 252 和 280 nm 的吸光值。根据公式 ⑤、⑥ 计算小分子药物在 252 和280 nm 的消光系数。
式中,CD是药物的摩尔浓度;εD-252是药物在252 nm 处的消光系数。
1.2.3 ADC 药物 DAR 值的测定公式 抗体偶联药物在 280 和 252 nm 处的吸光值A280-ADC和A252-ADC分别为[12]:
将公式 ⑦、⑧ 代入公式 ⑨,可得 DAR 测定公式 ⑩:
1.2.4 方法验证
1.2.4.1 专属性实验 分别使用 ADC 偶联工艺中间产品的空白溶液(S1)、冻干成品制剂的空白溶液(S2)、纯水(S3)和磷酸盐缓冲液(S4)作为稀释液稀释样品,进行 DAR 值检测。平行测定3 次。各种不同稀释液稀释样品在 280 和 252 nm处的吸光值和 DAR 值检测结果的 RSD 作为验证指标。
1.2.4.2 准确度实验 线性溶液配制:准确度溶液 1(记为 A1):取抗体药物偶联物,平行制备3 份,测定 DAR 值。准确度溶液 2(记为 A2):取 A1 与等摩尔量裸抗标准品母液等体积混合,平行制备 3 份。准确度溶液 3(记为 A3):取 A1与等摩尔量小分子标准品母液等体积混合,平行制备 3 份。准确度溶液 4(记为 A4):取 A1 与2 倍摩尔量小分子标准品母液等体积混合,平行制备 3 份。准确度溶液 5(记为 A5):取 A1 与3 倍摩尔量小分子标准品母液等体积混合,平行制备 3 份。分别用上述不同小分子药物和抗体摩尔比的准确度溶液模拟不同 DAR 值的 ADC 药物。以回收率作为验证指标。
1.2.4.3 精密度实验 同一样品(记为 P1)平行配制 6 份样品进行 DAR 值检测,6 份样品 DAR值检测结果的 RSD 值作为重复性验证结果。A、B两位分析人员分别在不同日期取同一样品(P1)平行配制 6 份,12 份样品 DAR 值检测结果的RSD 值作为中间精密度验证结果。
1.2.4.4 线性 以准确度溶液中模拟 DAR 值为横坐标,252 nm 处吸光值与 280 nm 吸光值的比值为纵坐标进行拟合,以r2作为验证指标。
1.2.4.5 检测范围 DAR 值与A252和A280的比值成正比。当A252越大且A280越小时,DAR 值最大;当A252越小且A280越大时,DAR 值最小。当A252和A280均在 0.3 ~ 0.7 范围内时,根据公式 ⑩,计算 DAR 值的检测范围。
1.2.4.6 耐用性 考察不同检测条件对检测结果的影响。验证方案:①分别在 279、280、281 和252 nm 处检测 DAR 值,平行测定 3 次;②分别在 251、252、253 和 280 nm 处检测 DAR 值,平行测定3 次;③分别在供试品配制后 1 小时内,每隔 10 min 检测 DAR 值;④分别使用 3 个不同批次的比色皿检测 DAR 值。以 DAR 值检测RSD 作为各耐用性条件验证指标。
2 结果
2.1 抗体的消光系数测定
根据抗体的理论氨基酸组成,可得酪氨酸、色氨酸、半胱氨酸的个数分别为 56、24、32。根据公式 ① 计算出抗体的理论消光系数为217440 L/(mol·cm)。分别用 pH 6.0 的磷酸盐缓冲溶液和 6 mol/L 盐酸胍缓冲液稀释抗体,记为Ab-1、Ab-2、Ab-3,测定 Ab-1、Ab-2、Ab-3 在280 nm 和 320 nm 处的吸光值,根据公式②计算抗体实际消光系数(εAb-280)为 228913 L/(mol·cm)(表 1)。

表1 抗体在 280 nm 处摩尔消光系数(L/(mol·cm))Table 1 The molar extinction coefficient of the antibody at 280 nm [L/(mol·cm)]
根据公式 ③ 计算抗体的摩尔浓度。用 pH 6.0的磷酸盐缓冲溶液将已知浓度的抗体稀释,分别记为 Ab-4、Ab-5、Ab-6。检测抗体在 252 nm 处的吸光值,根据公式 ④ 计算抗体在 252 nm 处的摩尔消光系数εAb-252为 91258 L/(mol·cm)(表 2)。

表2 抗体在 252 nm 处摩尔消光系数(L/(mol·cm))Table 2 The molar extinction coefficient of the antibody at 252 nm [L/(mol·cm)]
2.2 药物的消光系数测定
分别制备 6 个不同摩尔浓度的小分子药物溶液,分别记为 Drug-1、Drug-2、Drug-3、Drug-4、Drug-5、Drug-6,测定各溶液在 252 和 280 nm的吸光值,根据公式 ⑤、⑥,计算小分子药物在280 和 252 nm 的εD-252和εD-280分别为 12798和 3186 L/(mol·cm)(表 3 和表 4)。

表4 小分子在 280 nm 处摩尔消光系数(L/(mol·cm))Table 4 The molar extinction coefficient of the small molecule at 280 nm [L/(mol·cm)]
2.3 ADC 药物 DAR 值公式的确定
抗体在 280 和 252 nm 处的消光系数和药物小分子在280 和 252 nm 处的消光系数分别代入公式 ⑩ 可得 DAR 值计算公式如下:
2.4 方法验证
按照验证方案,从表 5 可知,使用磷酸盐缓冲液、中间产品空白溶液、成品制剂空白溶液、纯水稀释的样品在 280 和 252 nm 处的吸光值和 DAR值检测结果的 RSD 为 1.99%。说明使用不同稀释液对 DAR 值测定结果影响较小。中间产品溶液中的其他成分、成品制剂中的辅料等均不会影响该方法的检测,同时易获得的纯水可以作为日常检测的稀释液使用。准确性实验时,当使用裸抗添加的方法降低模拟 DAR 值时,其回收率相比通过添加小分子药物提高模拟 DAR 的回收率低。推测是由于裸抗浓度由计算获得,而非像小分子药物一样通过称量获得,导致回收率误差稍大。尽管如此,准确度溶液的 DAR 值检测结果与模拟摩尔比的回收率均在 75% ~ 100% 范围内(表 6),说明检测方法准确度好。同一样品的 6 份平行样品 DAR 检测结果 RSD 为 1.93%(表 7),说明方法重复性好;不同分析人员在不同时间检测同一样品的 12 个DAR 检测结果 RSD 为 2.36%(表 8),说明该方法在不同人员和不同时间的中间精密度良好。
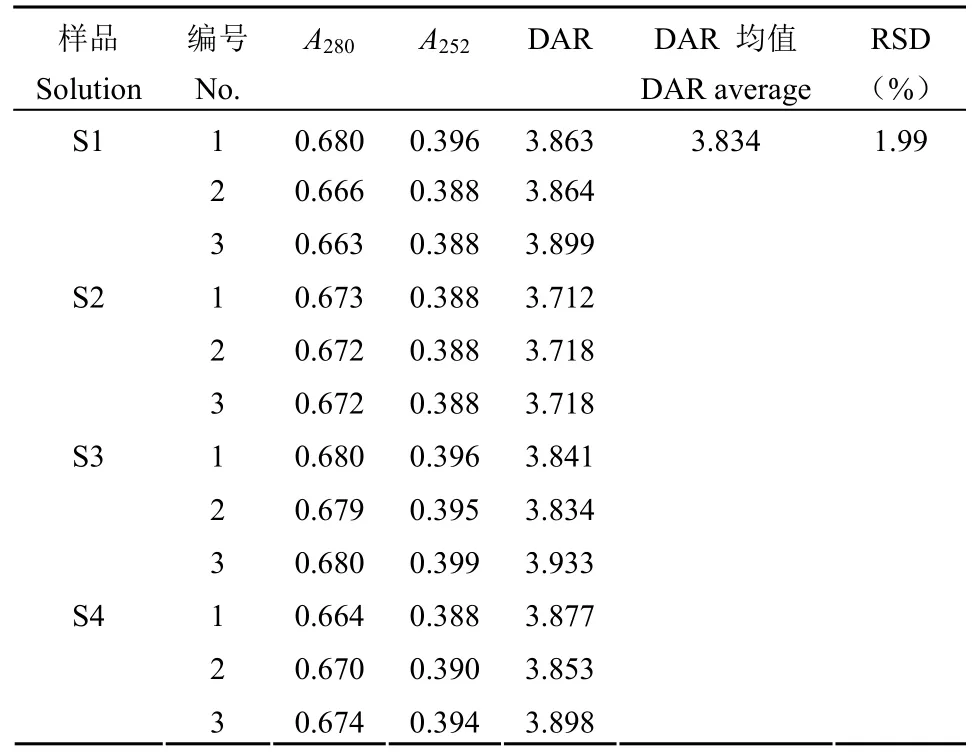
表5 专属性验证结果Table 5 The validation results of specificity
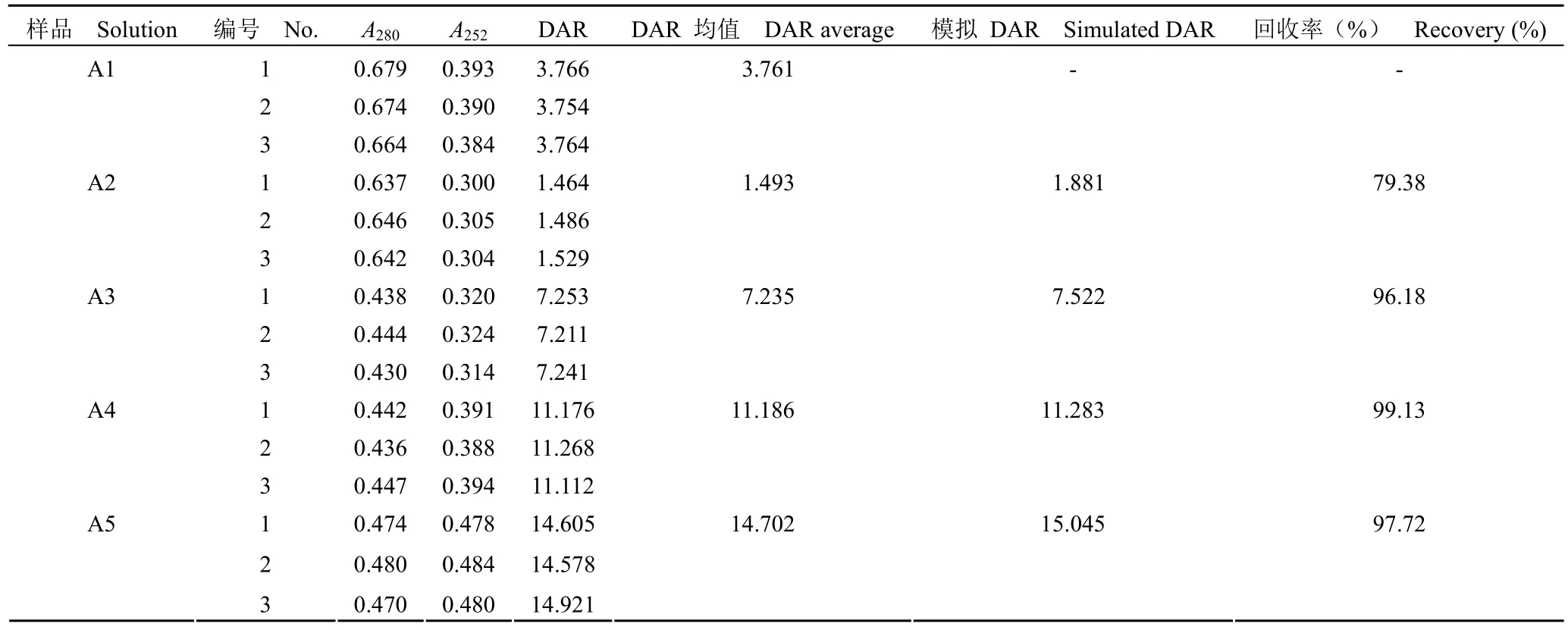
表6 准确性验证结果Table 6 The validation results of accuracy

表7 重复性验证结果Table 7 The validation results of repeatability
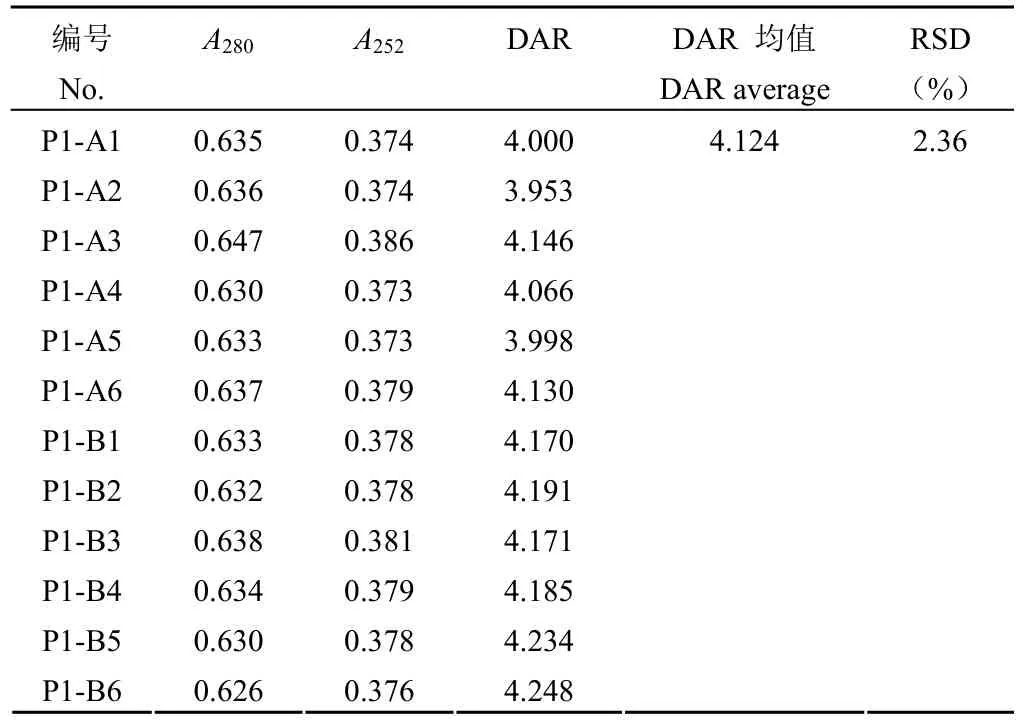
表8 中间精密度验证结果Table 8 The validation results of intermediate precision
根据公式 ⑩,当A280固定时,A252与 DAR值呈正相关,A252越大 DAR 值越大。为了控制不同样品检测时A280之间的差异,以A252和A280的比值作为纵坐标,以 DAR 值为横坐标进行线性回归检测方法的线性,结果显示拟合后线性回归方程为 y = 0.0408x + 0.414,r2= 0.9954,说明检测方法具有良好的线性(图 1)。根据公式 ⑩,当A280为 0.7,A252为 0.3 时,DAR 最小,为0.60;当A280为 0.3,A252为 0.7 时,DAR 最大,为 82.56。故使用该方法进行 DAR 值的检测范围为 0.60 ~ 82.56。当检测波长为(280 ± 1)nm 或(252 ± 1)nm 时,DAR 值检测结果的 RSD 分别为 2.09% 和 4.76%(表 9);当溶液配制后放置0 ~ 60 min,每隔 10 分钟检测的 DAR 值结果RSD% 为 2.73%(表 10);当采用不同批次的比色皿进行检测,DAR 值 RSD% 为 4.94%(表 11)。综上,说明方法具有良好的耐用性。

图1 线性验证结果Figure 1 The results of linear regression
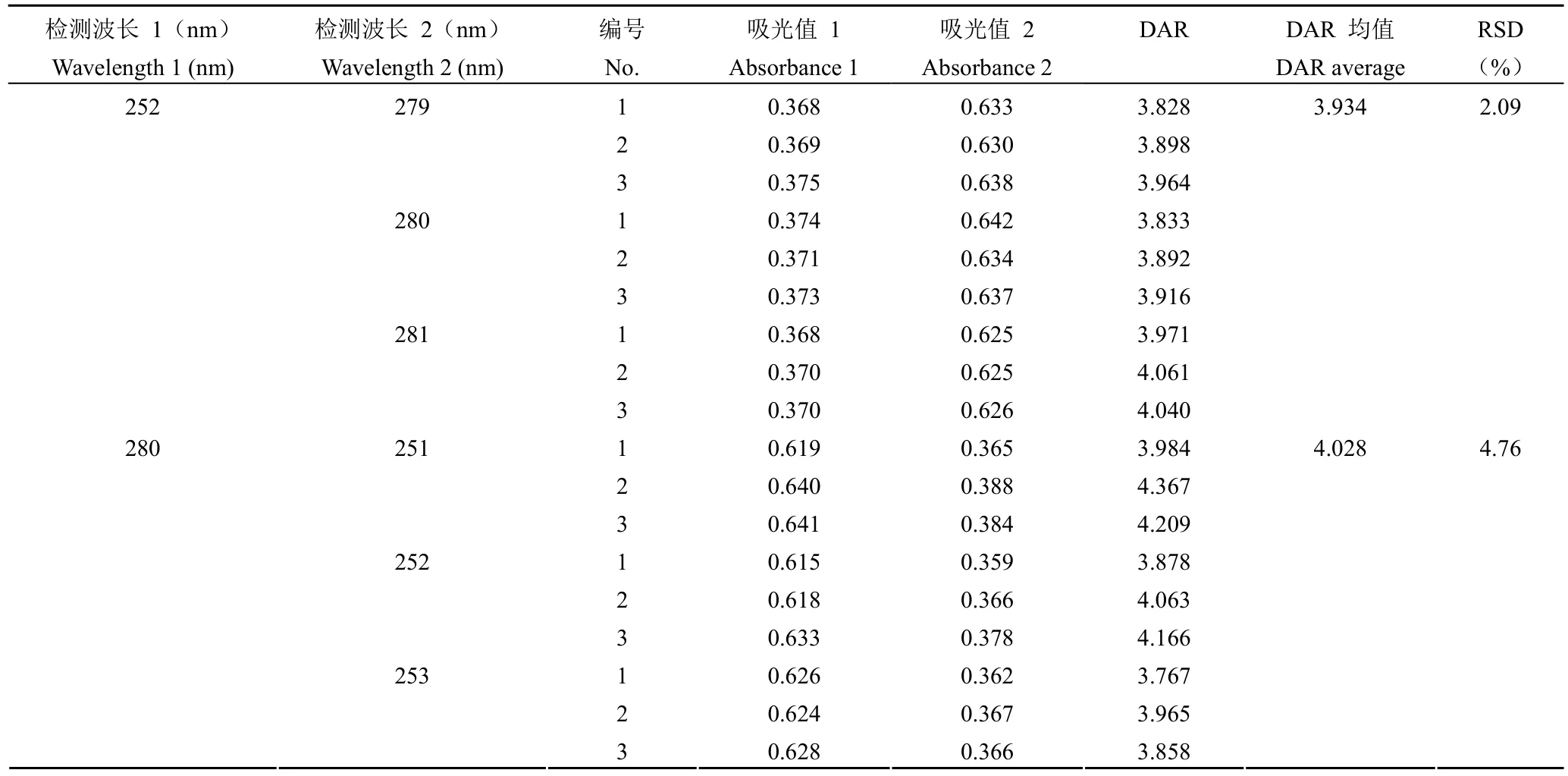
表9 耐用性(检测波长)验证结果Table 9 The validation results of robustness (detection wavelengths)
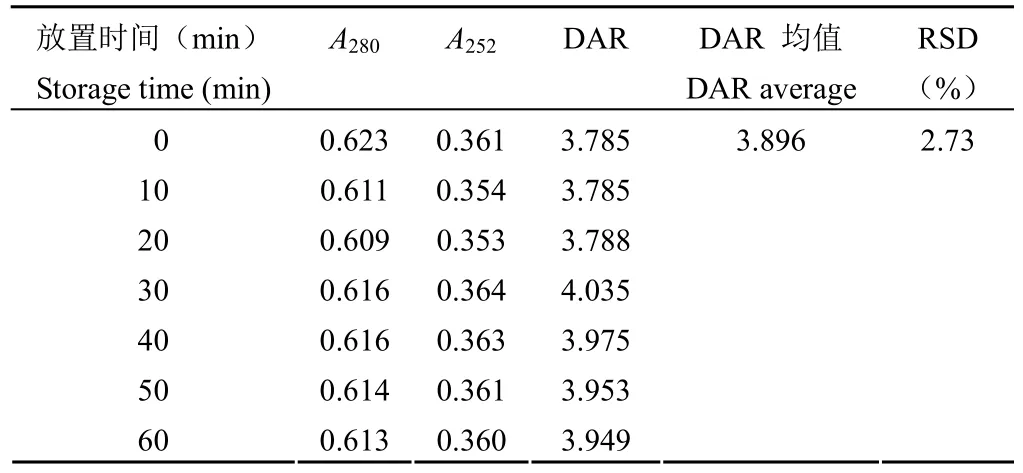
表10 耐用性(放置时间)验证结果Table 10 The validation results of robustness(solution storage times)

表11 耐用性(比色皿批次)验证结果Table 11 The validation results of robustness(cuvette batches)
3 讨论
紫外可见光谱法检测抗体偶联药物具有简单、快捷、成本低的特点。采用该方法进行抗体偶联药物的 DAR 值检测已经广泛用于研发阶段的 ADC药物[5]和已上市 ADC 药物[13]。相比色谱法或者质谱法等其他检测方法,紫外可见光谱法适用于不同偶联方式的 ADC 药物,无论是随机偶联或者定点偶联。当小分子药物和抗体未发生变化,仅偶联方式调整时,采用该方法进行 DAR 值检测可有效减少检测方法开发的时间,加快药物研发进程。
抗体的高级结构,如折叠或螺旋,可能会影响部分氨基酸的吸收光谱,因此基于氨基酸组成计算的消光系数可能和实际消光系数存在差异[14]。加入盐酸胍改变抗体的高级结构,减少高级结构对消光系数的影响[15]。不同类型小分子药物的最大吸收波长不同,如美登素 DM1、DM4 等细胞毒素分子通常在 252 nm 处检测 DAR 值[16-17];Duocarmycin、CC-1065 分子在约 325 nm 处检测[18];Camptothecin(CPT)类小分子(Exatecan、Dxd)在约 370 nm 处检测 DAR 值[19];MMAE、MMAF 分子则在约248 nm 处检测 DAR 值[20]。在实际使用时需要根据不同的小分子药物选择合适的检测波长。不同溶液环境对氨基酸吸收光谱存在影响,不同溶剂也可能影响小分子药物的消光系数,因此在使用该方法进行药物生产过程控制时,需要考虑不同工艺阶段溶液对抗体和小分子药物的影响。
虽然紫外可见光谱法优点众多,但相比其他方法仍然存在一定的局限性。首先,该方法不能区分偶联的小分子药物和游离的小分子药物。当样品中游离小分子药物较多时,该方法的检测可能存在虚高。针对此类样品,可以利用 ADC 药物和小分子药物亲和性的不同或分子大小的不同进行分离纯化,去除游离小分子后再进行检测。其次,该方法无法分析 ADC 药物的偶联分布。当 DAR 值相同时,但偶联方式或偶联位点不同时,需要结合其他方法进行偶联分布的分析。
药物抗体偶联比作为 ADC 药物的重要质量属性,尚缺少关于方法建立和方法验证的法规指导原则及系统性描述紫外可见光谱法检测 DAR 值方法建立和验证过程的研究资料。基于此,本研究将紫外可见光谱法检测 DAR 值方法建立过程进行优化,使其简单、系统、可操作性强,可应用于不同抗体和不同小分子药物偶联物的方法建立过程,为业内人士提供参考。此外,本研究结合方法的理论基础,对方法的专属性、准确性、精密度、线性、范围和耐用性进行验证,结果表明方法可用于药物的质量控制检测。
