生姜蛋白酶辅助金线鱼腐乳发酵工艺优化及理化性质研究
2024-02-28马才学沈瑞敏
罗 璇,马才学,沈瑞敏
(武汉设计工程学院 食品与生物科技学院,湖北 武汉 430205)
鱼类食品是一种高蛋白、低脂肪的菜肴,深受消费者喜爱[1-2],鲜活鱼类容易腐败,难以长途运输,所以将鱼肉进行发酵制成鱼腐乳,不仅可以提高营养价值,改善口感,形成特有的风味,还能延长食品的保藏期[3]。鱼类发酵食品有许多种类,泰国鱼膏是一种富含蛋白质和多肽的佐餐食品[4],贵州鱼酱酸是一种开胃的半固态调味料[5],鱼露是将原料鱼和食盐混合发酵三个月获得的一种类似于酱油的调味料[6-7]。
目前,有许多关于传统豆腐乳理化指标、营养品质的研究报道[8-11],但是以冷冻鱼糜为原料制作鱼腐乳的研究较少。大豆、玉米或红花籽油可以提高金线鱼鱼糜的凝胶品质和风味[12];盛宇华等[13]在白腐乳后发酵过程中,分别加入酸性、中性或碱性的蛋白酶,探究了不同发酵温度下腐乳的理化性质,且产品风味较好。
生姜蛋白酶是一种易于获取的天然植物蛋白酶[14],其降解的水解物具有多种生物学效应,包括抑制血管紧张素转换酶、促进成骨细胞分化和抗抑郁活性[15],相比酸性和碱性蛋白酶,生姜蛋白酶制备的鱼皮明胶水解物对二肽酶-IV的体外抑制活性更显著,1,1-二苯基-2-苦基肼自由基清除活性也最高[16-17]。
本试验以金线鱼鱼糜为原料,接种雅致放射性毛霉(Actinomucor elegans)进行发酵,辅助添加生姜蛋白酶制作金线鱼腐乳,对其发酵工艺及理化性质进行研究,旨在为优化酶促鱼腐乳工业化生产提供理论依据和技术方法。
1 材料与方法
1.1 材料与试剂
金线鱼冷冻鱼糜:购于淘宝佰腾旗舰店;鲜生姜:市售;雅致放射性毛霉(Actinomucor elegans):武汉设计工程学院食品与生物科技学院试验室保存。
L-酪氨酸、干酪素、福林酚、10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、四甲基乙二胺、过硫酸铵、Tris-HCl、丙烯酰胺;三氯乙酸、乙酰丙酮、氢氧化钠、冰乙酸、甲醛、无水碳酸钠、三水合乙酸钠:国药集团化学试剂有限公司。所用试剂均为分析纯或生化试剂。
1.2 仪器与设备
UV2150紫外可见分光光度计:尤尼柯(上海)仪器有限公司;JP-031S超声波清洗仪:深圳洁盟清洗仪器有限公司;DYCZ-24DN垂直板电泳仪:北京六一生物科技有限公司;PAL-1(NFC)型手持数显糖度计:浙江托普云农科技股份有限公司。
1.3 试验方法
1.3.1 金线鱼腐乳制备[18]
冷冻鱼糜在室温条件下解冻后添加少量蒸馏水,用玻璃棒擂溃5 min,转移至烧杯,准确称质量,加入其质量3%的NaCl,盐擂10 min,加入其质量10%的淀粉搅拌,继续擂溃10 min,将擂溃好的样品装入已消毒的长方形铝盒中,盖上盒盖,45 ℃水浴加热1 h,再置于90 ℃水浴加热20 min,取出迅速冷却至室温后,放入冰箱4 ℃冷藏12 h得到金线鱼腐乳白坯。将金线鱼腐乳白坯切成1×3×3 cm的方块,刀口顺直,规格整齐,摆放在经体积分数75%的乙醇消毒的塑料盒中,码放整齐,白坯四周留有空隙,在白坯表面均匀洒上5%毛霉孢子悬液(6×107个/mL),27 ℃条件下培养72 h。将金线鱼腐乳毛坯撮毛,记录金线鱼腐乳块总质量,加入豆腐块总质量12%的食盐腌制,广口瓶底层先洒一层盐,然后一层豆腐块一层盐,越往上层盐越多,码完广口瓶容积3/4即可撒上最后一层盐。最后在瓶口处裹上保鲜膜。
腌制约22 h得到盐坯,设置试验组和空白组,试验组向广口瓶中添加生姜蛋白酶粗酶液(70 mL/500 g盐坯),空白组加入等体积的10%食用乙醇,用保鲜膜包裹瓶口,分别在27 ℃和35 ℃条件下发酵。
1.3.2 金线鱼腐乳前发酵条件优化单因素试验
试验分别考察前发酵时间(24 h、48 h、72 h、96 h、120 h);发酵温度(23 ℃、25 ℃、27 ℃、29 ℃、31 ℃);菌悬液接种量(3%、4%、5%、6%、7%)对前发酵工艺条件的影响,以蛋白酶活力为指标,确定影响响应值的3个较优试验因素参数范围。
1.3.3 金线鱼腐乳前发酵条件优化响应面试验
为确定金线鱼腐乳前发酵最佳发酵工艺条件,在单因素试验的基础上,选择金线鱼腐乳前发酵时间(A)、发酵温度(B)、菌悬液接种量(C)为影响因素,以蛋白酶活力(Y)为响应值,根据Box-Behnken中心组合设计原理,运用Design-Expert 8.6.0.1软件设计响应面试验,考察各因素间交互作用对金线鱼腐乳前发酵条件的影响,响应面试验因素与水平见表1。

表1 金线鱼腐乳前发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for prefermentation conditions optimization of goldthread fish sufu
1.3.4 生姜蛋白酶粗酶液的制备
根据团队前期研究成果[21],称取外形完整、色泽均一的新鲜生姜50 g,削皮并切成小块,放入研钵中,加入100 mL 0.05 mol/L的磷酸盐缓冲液(phosphate buffer solution,PBS)(pH=6.0),缓慢研磨20 min,过滤,再用250 mL烧杯收集滤液,放入冰箱冷藏,30 min后以6 000 r/min离心10 min,去除沉淀,合并上清液即为生姜蛋白酶粗酶液。
1.3.5 金线鱼腐乳预处理
将腐乳在无菌条件下取样,于-20 ℃的冰箱中冷冻12 h,然后在真空冷冻干燥机中干燥2 h,碾碎后过50 目筛,称取1 g腐乳,玻璃棒捣碎,加入10 mL的磷酸缓冲液(pH=7.2),以8 000 r/min离心10 min,用胶头滴管收集上清液后,于冰箱冷藏。
1.3.6 测定方法
毛坯氨基酸态氮的测定:依据GB/T 5009.235—2016《食品中氨基酸态氮的测定》[19]中的比色法检测腐乳样品中的氨基酸态氮。
蛋白质含量的测定:用干燥洁净的药匙取间隔发酵1 d的腐乳,研磨均匀后准确称取2 g,加入4 mL的磷酸氢二钠-磷酸二氢钠缓冲液(pH=7.2),40 ℃超声提取15 min,以8 000 r/min的转速离心10 min,取1 mL沉淀物溶液于试管中,绘制考马斯亮蓝G-250标准曲线,计算腐乳试样中蛋白质含量。
使用SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析腐乳中大分子蛋白质的降解情况。配制5%浓缩胶4 mL和12%分离胶15 mL,上样量为10 μL,考马斯亮蓝R-250避光染色12 h,脱色4 h。
前发酵时期蛋白酶的提取及活力测定:将毛坯取样后置于-20 ℃冰箱24 h,干燥后粉碎,称取1 g样品,加入10 mL磷酸盐缓冲溶液(pH=7.2),玻璃棒搅拌均匀,40 ℃水浴超声提取30 min,经8 000 r/min离心10 min,取上清液备用。参照GB/T 23527.1—2023《酶制剂质量要求第1部分:蛋白酶制剂》[20]中的福林法检测腐乳中的蛋白酶活,将在40 ℃水浴中1 g样品1 min内水解酪蛋白产生酪氨酸的微克数,定义为1个酶活单位,U/g。
后发酵时期腐乳理化指标的测定:用pH计测定处理后的腐乳样品,手持糖度仪测定试样可溶性固形物含量。
2 结果与分析
2.1 金线鱼腐乳前发酵时期氨基酸态氮的测定
由图1可知,金线鱼腐乳发酵前的氨基酸态氮含量极低,为0.13%,随着发酵时间的延长,金线鱼腐乳白坯的氨基酸态氮含量明显增加,前发酵72 h时,上升至最高值8.04%,说明毛霉在适宜环境下生长并分泌了许多蛋白酶,充分水解金线鱼腐乳中的蛋白质,使得氨基酸态氮含量持续上升。根据现有文献资料得知腐乳前发酵的时间在60~84 h比较合理[18],如果前发酵时间超过84 h,继续发酵,不但会使氨基酸态氮含量降低,毛霉菌丝也会出现老化,造成腌坯时腐乳块硬度小,易碎不成形的现象,影响后发酵进程,所以选择72 h为最佳发酵时间。
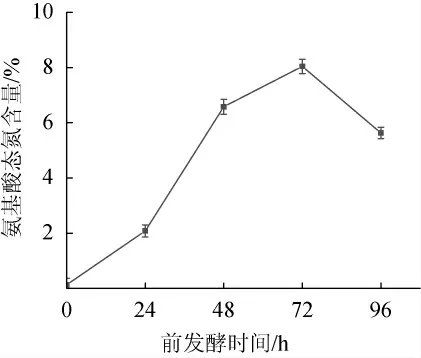
图1 金线鱼腐乳前发酵过程氨基酸态氮含量的变化Fig.1 Changes of amino acid nitrogen contents during pre-fermentation process of goldthread fish sufu
2.2 金线鱼腐乳前发酵时期SDS-PAGE结果分析
从图2可以看出,发酵24 h和48 h的金线鱼腐乳中仍有肌动蛋白,而发酵至72 h的金线鱼腐乳中肌动蛋白条带基本看不清,随着发酵时间延长,25~35 kDa的小分子蛋白条带明显增多,说明毛霉在发酵过程中产生了大量蛋白酶,快速提升水解大分子蛋白质的速率。经过发酵,蛋白质被分解成小分子肽或氨基酸。
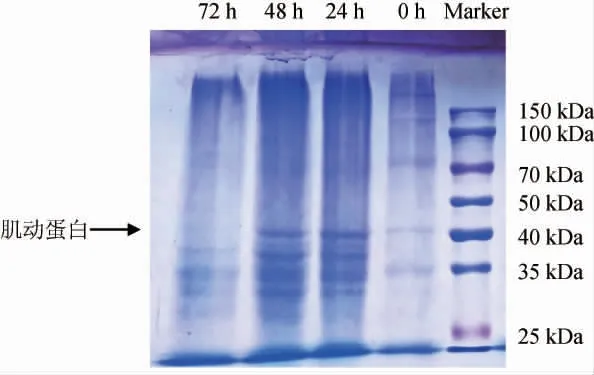
图2 金线鱼腐乳前发酵过程蛋白质十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果Fig.2 SDS-PAGE results of protein during pre-fermentation of goldthread fish sufu
2.3 金线鱼腐乳前发酵条件优化单因素试验结果
2.3.1 发酵时间对蛋白酶活力的影响
由图3可知,随着发酵时间的延长,金线鱼腐乳蛋白酶活力呈先上升后下降的趋势,72 h时达到峰值,之后快速下降,发酵时间延长使得菌丝开始老化,分泌蛋白酶的性能大幅下降,其他代谢产物的积累改变了菌液的pH值,超出了菌体生长的最适pH范围,最终影响菌体的代谢机制和产物活性,所以应该将发酵时间控制在72 h为宜。

图3 前发酵时间对蛋白酶活力的影响Fig.3 Effect of pre-fermentation time on protease activity
2.3.2 发酵温度对蛋白酶活力的影响
由图4可知,随发酵温度的升高,金线鱼腐乳蛋白酶活力呈先上升后下降的趋势,27 ℃时达到最大值,之后呈下滑趋势,说明升高温度会影响菌体自身的生理代谢和分泌机制,各种蛋白酶的分泌受到了阻碍,其他代谢产物累积,缩短了菌体生长曲线中的稳定期,所以发酵温度应控制在27 ℃。
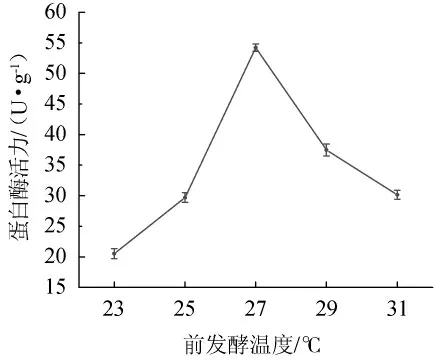
图4 前发酵温度对蛋白酶活力的影响Fig.4 Effect of pre-fermentation temperature on protease activity
2.3.3 菌悬液接种量对蛋白酶活力的影响
由图5可知,随菌悬液接种量的增加,金线鱼腐乳蛋白酶活力呈先上升后下降的趋势,接种量为5%时达到最大值,此后接种量加大,即每毫升液体中孢子数增多,金线鱼腐乳蛋白酶活力数值逐步降低。可能是均为菌体生长需要消耗大量的营养,有许多次级代谢产物生成,破环了毛霉适宜的生长环境,菌体提前进入稳定期或衰亡期,对蛋白酶活力有一定的负面影响,所以菌悬液接种量应控制在5%左右。
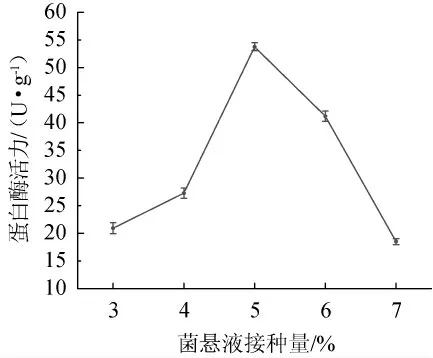
图5 菌悬液接种量对蛋白酶活力的影响Fig.5 Effect of bacterial suspension inoculum on protease activity
2.4 金线鱼腐乳前发酵条件优化响应面结果与分析
以金线鱼腐乳前发酵时间(A)、发酵温度(B)、菌悬液接种量(C)为评价因素,以蛋白酶活力(Y)为响应值,根据Box-Behnken中心组合试验,试验设计与结果见表2。
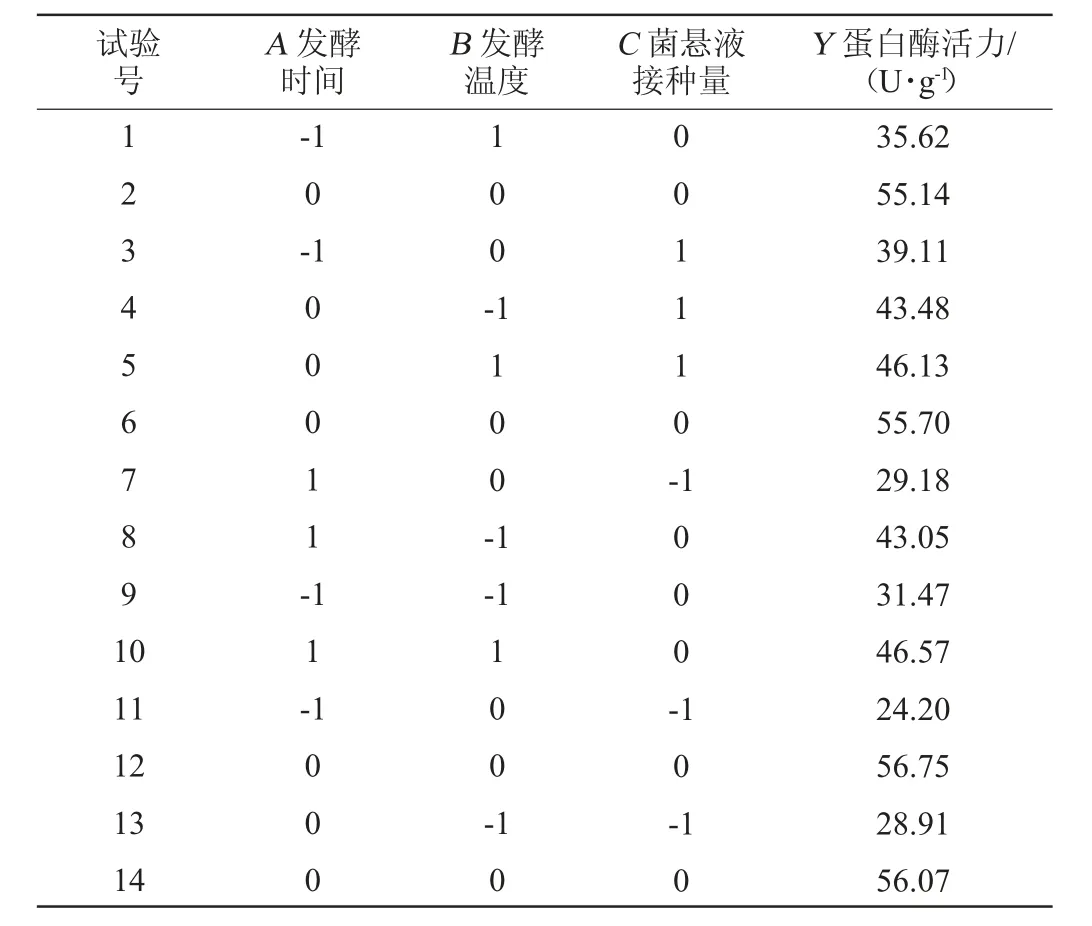
表2 金线鱼腐乳前发酵条件优化响应面试验设计及结果Table 2 Design and results of response surface tests for pre-fermentation conditions optimization of goldthread fish sufu
对表2试验数据进行线性回归拟合,得到多项式方程为:
Y=-1 629.734+2.439A+93.361B+119.105C-0.003AB+0.049AC-0.346BC-0.017A2-1.674B2-10.565C2
从表3可知,失拟项P=0.104 2>0.05,不显著,模型P值<0.001,显著,相关系数R2=0.988 5,调整决定系数R2Adj=0.973 8,两数之差的绝对值小于0.2,可用来预测实际操作中响应值的变化情况。试验中的3个因素对模型3D曲面的影响皆为极显著(P<0.01)。由F值可知,3个因素对蛋白酶活力的影响次序为:菌悬液接种量>发酵时间>发酵温度。
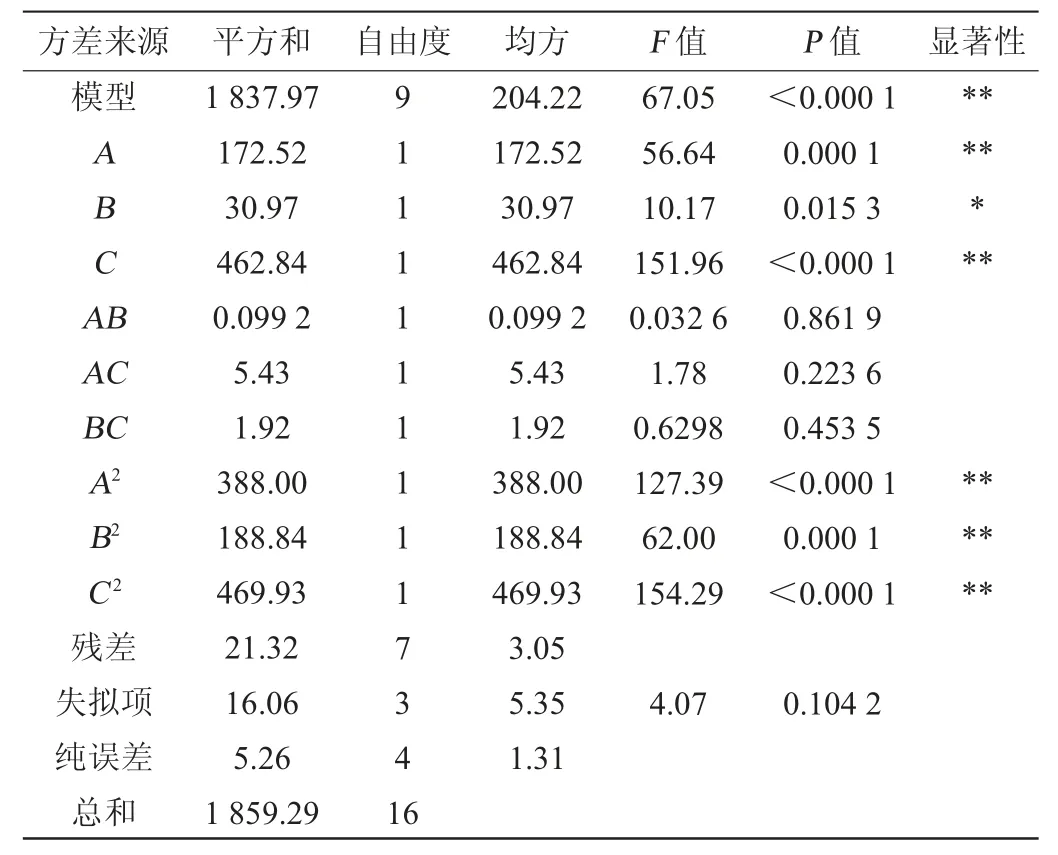
表3 回归模型方差分析Table 3 Variance analysis of regression model
3个因素间交互作用对蛋白酶活力影响的响应面及等高线见图6。

图6 发酵时间、发酵温度和菌悬液接种量间交互作用对金线鱼腐乳蛋白酶活力影响的响应面及等高线Fig.6 Response surface plots and contour lines of effects of interaction between fermentation time, temperature and inoculum of bacterial suspension on protease activity
由图6可知,3个因素交互作用结果与方差分析的结论一致。预测优化金线鱼腐乳前发酵条件为:发酵时间78.34 h,发酵温度27.25 ℃,菌悬液接种量5.37%。在此条件下,金线鱼腐乳蛋白酶活力的预测值为57.62 U/g。
为验证软件的预测值与试验实际值之间的相似度,同时顾及实际生产状况,调整前发酵条件为:发酵时间、温度和菌悬液接种量分别为78 h、27 ℃和5.4%。在此优化条件下,进行3次平行试验,得到蛋白酶活力实际值为55.46 U/g,与预测值相差不大,证明了此模型的合理性和可行性。
2.5 金线鱼腐乳后发酵时期理化指标的变化
2.5.1 金线鱼腐乳后发酵时期氨基酸态氮含量变化
由图7可知,后发酵1~6 d内添加了生姜蛋白酶的两个试验组的氨基酸态氮含量明显高于两组对应温度的空白组,说明生姜蛋白酶粗酶液的添加,加快了酶促反应,促进了蛋白质的水解,提高了氨基酸态氮含量。而6~8 d内,27 ℃的生姜蛋白酶添加试验组显著高于35 ℃的试验组和其他两组空白组,分析原因是较高的发酵温度影响了生姜蛋白酶的活力,进而影响其催化功效。27 ℃的生姜蛋白酶添加试验组在8 d后发酵后氨基酸态氮含量达到最高值9.05%,说明生姜蛋白酶实验组在27 ℃进行后发酵有利于金线鱼腐乳中蛋白质的水解,提高了氨基酸态氮含量,缩短发酵周期。
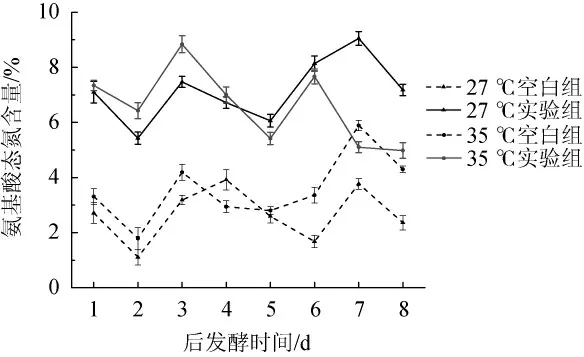
图7 金线鱼腐乳后发酵时期氨基酸态氮含量变化Fig.7 Changes of amino acid nitrogen contents during postfermentation process of goldthread fish sufu
2.5.2 金线鱼腐乳后发酵时期pH值的变化
由图8可知,后发酵温度为27 ℃或35 ℃时,添加了生姜蛋白酶的试验组腐乳样品的pH值几乎都低于空白组,说明生姜蛋白酶加快咸坯中的蛋白质分解成谷氨酸、天冬氨酸等酸性氨基酸,生成精氨酸、赖氨酸和亮氨酸等碱性氨基酸的含量较少,此外脂肪的分解会产生苹果酸、延胡索酸、柠檬酸、琥珀酸、乙酸等酸性物质导致pH值下降[22-25]。随着发酵天数的增加,部分氨基酸发生脱氨反应,对pH值有一定的影响。35 ℃后发酵条件下腐乳的pH值较27 ℃发酵时高,添加生姜蛋白酶组的腐乳pH值较未添加组的低。
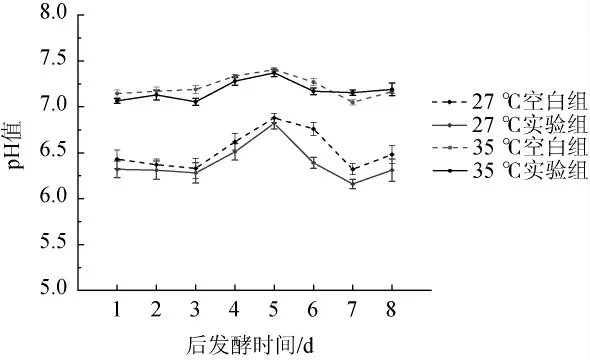
图8 金线鱼腐乳后发酵时期pH值的变化Fig.8 Changes of pH during post-fermentation process of goldthread fish sufu
2.5.3 金线鱼腐乳后发酵时期可溶性固形物含量变化
由图9可知,在27 ℃和35 ℃的后发酵温度条件下,空白组和试验组的腐乳可溶性固形物含量的变化趋于一致,试验组腐乳中的蛋白质被快速降解成小分子氨基酸和多肽,比空白组的降解速率快,所以添加了生姜蛋白酶的试验组的可溶性固形物含量相对较高。
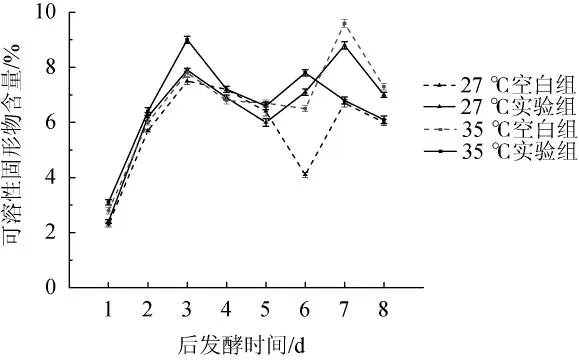
图9 金线鱼腐乳后发酵时期可溶性固形物含量变化Fig.9 Changes of the soluble solid contents during post-fermentation process of goldthread fishsufu
3 结论
本试验以金线鱼鱼糜为原料,制作成金线鱼腐乳,检测氨基酸态氮含量,分析腐乳中蛋白质降解情况,优化前发酵工艺参数,在后发酵时期加入生姜蛋白酶液,分别在27 ℃和35 ℃下发酵,探究氨基酸态氮、pH值、可溶性固形物的变化规律,为优化金线鱼腐乳前发酵工艺和酶促后发酵提供理论依据。结果表明,前发酵时期,金线鱼腐乳的氨基酸态氮含量逐渐增加,用凝胶成像系统观察SDS-PAGE的电泳结果可知:发酵72 h的腐乳中分子质量较大的蛋白条带明显减弱。以毛坯中蛋白酶活力为因变量,先开展单因素试验,再运用Design Expert 12.0响应面法优化前发酵条件,得到最优前发酵条件为:发酵时间78 h,发酵温度27 ℃和菌悬液接种量5.4%。在此优化条件下,蛋白酶活力为55.46 U/g。后发酵阶段,添加生姜蛋白酶试验组的氨基酸态氮含量普遍大于空白组,pH值小于对照组,可溶性固形物含量略高于空白组。说明了生姜蛋白酶可以降解咸坯中的蛋白质,产生更多酸性氨基酸和多肽,证实了生姜蛋白酶的催化功效。且27 ℃更有利于生姜蛋白酶的催化效果。
