层黏连蛋白基质在肿瘤细胞行为及血管生成拟态形成中的机制研究
2024-02-27帅旗志祖拉莱阿力比衣提程静雯王晓婉梁宇翔彭志伟
帅旗志, 祖拉莱﹒阿力比衣提, 程静雯, 王晓婉, 梁宇翔, 彭志伟, 解 军
(山西医科大学基础医学院生物化学与分子生物学教研室;出生缺陷与细胞再生山西省重点实验室, 太原 030001)
肿瘤是人类健康的一大杀手,其中肿瘤血管与肿瘤的侵袭、浸润和转移密切相关,直接影响肿瘤患者的预后[1, 2]。而肿瘤中的血管不同于正常器官中的血管,形成方式比较复杂,肿瘤可以响应或调动不同机制来完成血管化进程[3, 4]。研究人员曾认为,以内皮细胞形成的血管是肿瘤内部循环的唯一形式。直到1999年,Maniotis等人在高侵袭性黑色素瘤中发现了新的流通管道,并将其命名为血管生成拟态(vasculogenic mimicry, VM)[5]。VM的存在使得肿瘤患者的预后极差,且成为肿瘤恶性程度的重要指标[6]。VM是肿瘤内部部分肿瘤细胞与肿瘤微环境中的细胞外基质和因子相互作用,形成的类似血管的管状结构[7]。自肿瘤VM 的概念出现以来,大量文献提供了关于VM 在各种癌症中的诱导、形成和靶向机制的见解。除了黑色素瘤的相关研究,VM 还存在于肺癌、前列腺癌、膀胱癌、肝癌癌、恶性肉瘤和胶质瘤等[8-10]。抗血管治疗药物主要针对内皮细胞形成的血管,VM的存在不仅使肿瘤免受抗血管药物的影响,而且使肿瘤容易出现耐药性,严重影响抗血管药物的应用,并造成患者治疗效果差和易复发,最终影响患者的生存[11, 12]。尽管VM在近几十年来受到了密切关注,但是VM的形成机制仍不清楚的。
肿瘤微环境在肿瘤发生发展过程中发挥关键作用。其中细胞外基质(extracellular matrix,ECM)是一种在肿瘤微环境中异常表达的非细胞成分。ECM由胶原、糖蛋白和蛋白聚糖等组成[13]。高侵袭性黑色素瘤细胞分泌的细胞外基质ECM可以促进非侵袭性黑色素瘤细胞形成 VM,这提示了ECM-细胞间的相互作用,可以促进VM相关基因的差异表达,从而参与肿瘤细胞中VM的形成[14, 15]。层黏连蛋白(laminins,LN)是糖蛋白的一种,存在于早期胚胎、纤维化及某些肿瘤细胞之间。已知层黏连蛋白直接调节与形态发生相关的关键生物事件,例如增殖、黏附、迁移、血管生成和存活[16]。层黏连蛋白表达模式和活性的改变与病理事件有关,例如致癌过程,因为它们可以调节关键的细胞过程,从而影响不同的细胞行为[17, 18]。已有报道LN在肿瘤发生过程中发挥重要调控作用,同理,VM的形成也与LN密切相关,但是其中的调控机制尚不清楚[19, 20]。此外,多项研究表明,肿瘤组织中层黏连蛋白表达模式和活性的改变与患者预后(例如肿瘤侵袭性和预后不良)有关,揭示了其作为预后生物标志物的潜力[21-23]。通过鉴定和重建肿瘤生长的基质,例如基质浓度、拓扑结构或基质组分等,仿生地构建肿瘤细胞生长的微环境,可以使用天然生物材料体外还原体内生长环境,构建VM形成的 niche用于研究VM形成发生机制。本研究利用不同浓度的LN基质培养体系,探究其对黑色素瘤、骨肉瘤癌细胞的黏附、增殖、迁移、干性表达和血管生成拟态形成的影响,并探索LN促进VM形成潜在的分子机制,以期为VM的治疗提供有效的分子靶点。
1 材料与方法
1.1 材料
小鼠皮肤黑色素瘤细胞B16F10细胞株、人骨肉瘤细胞SW1353细胞株购于武汉普诺赛生命科技有限公司。细胞外基质蛋白层黏连蛋白购于瑞典BioLamina公司。RPMI1640、DMEM培养基以及胎牛血清购于Gibco公司;引物购于上海生工公司;反转录试剂盒盒购自Takara公司;CCK-8试剂盒购于北京索莱宝公司;蛋白质裂解液RIPA、蛋白酶抑制剂PMSF、BCA蛋白浓度试剂盒购自碧云天公司;PBS溶液、青霉素/链霉素、胰蛋白酶购于北京索莱宝公司;Matrigel基质胶购于美国康宁公司;抗体CD133和抗体波形蛋白(vimentin)购于美国abcam。
1.2 细胞培养
小鼠皮肤黑色素瘤细胞B16F10细胞株、人骨肉瘤细胞SW1353细胞株均用含10%胎牛血清、1%青霉素/链霉素的RPMI1640培养基培养,放到含5%二氧化碳的37摄氏度恒温培养箱中培养。培养基每2 d更换1次,当细胞长到80%状态时用0.25%胰酶-EDTA溶液消化并传递培养。
1.3 层黏连蛋白基质固定
细胞外基质蛋白LN,分别以1 μg/mL、5 μg/mL的浓度溶液,作为孵育蛋白质加到12孔板中,孔板放置到37摄氏度孵育箱孵育固定4 h,孵育后将剩余的蛋白质用PBS轻轻洗掉,留着备用。实验分组为对照组(Control组)、低浓度LN基质(Low LN组)和高浓度LN基质(High LN组)。
1.4 细胞黏附实验
将肿瘤细胞以每孔1 × 105细胞的密度分别接种到6孔组织培养板 (tissue culture polystyrene, TCPS)、低浓度和高浓度LN基质的孔板上培养。在37 ℃、5% CO2培养箱中培养2 h,用PBS溶液清洗3次孔板,去掉未黏附的细胞,随后用显微镜进行拍照,每组随机选取5个视野计数统计。
1.5 CCK-8检测
将B16F10、SW1353细胞以每孔5 × 103细胞的密度分别接种到96孔TCPS、低浓度和高浓度LN基质的孔板上,每组设置3个复孔。培养24 h或48 h时,每孔加入100 μL含10%CCK-8培养基,37 ℃恒温孵育箱培育2 h,利用全自动酶标仪检测波长450 nm处每孔的吸光度数值。
1.6 细胞划痕
将肿瘤细胞以每孔1 × 105细胞的密度分别接种到6孔TCPS、低浓度和高浓度LN基质的孔板上培养,当细胞融合度达到接近95%时,使用200 μL的无菌移液器枪头垂直于背后横线划出一条竖线,用PBS 缓冲液清洗2次,洗掉细胞碎片,加入含10%胎牛血清的培养基进行培养,分别于0 h、24 h和48 h在同一划线交叉处拍照。
1.7 血管生成拟态形成
100 μL预冷的Matrigel溶液均匀铺到48孔板上,放置到37 ℃孵育箱中成胶。肿瘤细胞用胰酶-EDTA溶液消化,去除上清,分别用含有1 μg/mL、5 μg/mL LN蛋白的无血清培养基重悬,接种到上述48孔板中,将孔板放置到37 ℃培养箱中培养12 h,随后用显微镜进行拍照,每组随机选取5个视野进行分析。
1.8 实时定量PCR分析
使用TRIzol试剂分离在不同基质培养的肿瘤细胞的总RNA。检测RNA浓度和纯度,将RNA反转录为cDNA。反转录条件为:42 ℃ 2 min;37 ℃ 15 min;85 ℃ 5 s。扩增条件为:95 ℃ 10 min,95 ℃ 15 s,59 ℃ 1 min,95 ℃ 15 s,59 ℃ 1 min,95 ℃ 15 s。引物序列详见Table 1。
1.9 免疫荧光染色
将肿瘤细胞培养在不同基质上,培养24 h,去除培养基,用PBS溶液清洗,加入4%多聚甲醛溶液室温固定15 min,再用细胞封闭液(含5% BSA和0.1% Triton X-100)室温封闭15 min,再用PBS溶液清洗3次。随后进行相应一抗和荧光二抗的孵育,将染色的细胞进行激光共聚焦成像。

Table 1 The primers of qPCR
1.10 统计学方法
采用SPSS 20.0软件进行统计学分析。所有数据均采用均数±标准差表示。多组间采用单因素方差分析,以P<0.05为差异具有统计学意义。所有图表采用GraphPad Prism 8.2进行数据处理并绘制。
2 结果
2.1 层黏连蛋白基质促进黑色素瘤和骨肉瘤细胞的黏附和增殖
为了证实细胞外基质蛋白-层黏连蛋白对肿瘤细胞黏附与增殖的影响,本文选取了黑色素瘤B16F10细胞株和人骨肉瘤SW1353细胞株,通过细胞黏附实验及光镜统计,结果发现,层黏连蛋白可以促进肿瘤的细胞黏附,且随着LN浓度提高,细胞黏附则越好(Fig.1A-C)。通过细胞培养光镜观察,随着时间培养的延长,生长在LN基质下的肿瘤细胞,细胞数量显著增多且呈长梭形,提示肿瘤细胞的迁移能力得以提高(Fig.2A, B)。通过CCK-8检测,高浓度LN基质培养的肿瘤细胞相较于Control组,细胞增殖活力显著增大,同时,也高于低浓度LN基质培养的肿瘤细胞,细胞增殖活力与培养板上LN基质浓度成正相关(P<0.05,P< 0.01, Fig.3A)。综上所述,层黏连蛋白可以促进肿瘤细胞的黏附和增殖。
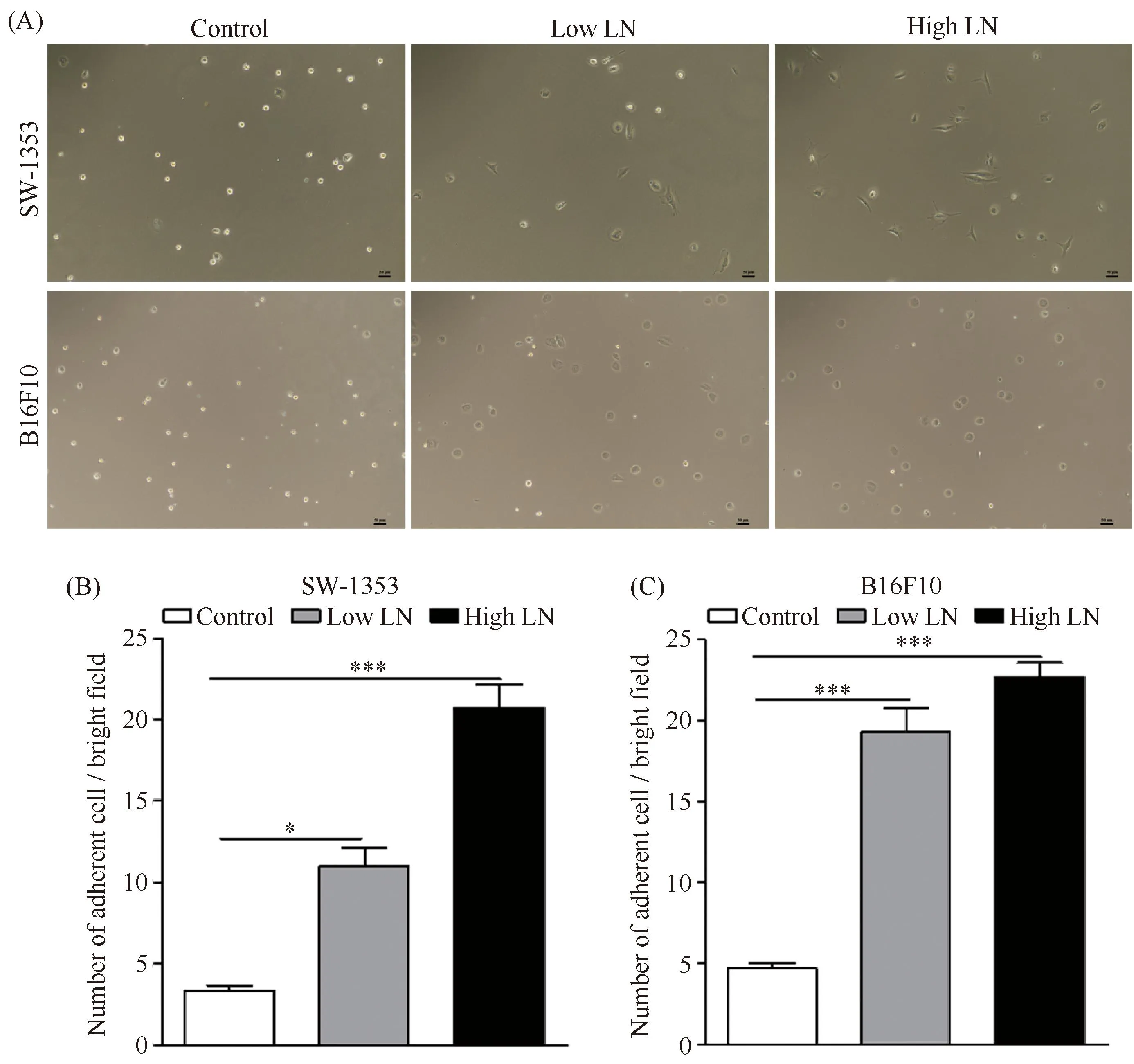
Fig.1 Laminin proteins treatment promoted cell adhesion of SW1353 cells and B16F10 cells (A) Representative bright field images of SW1353 cells and B16F10 cells cultured on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 2 hours. Scale bar, 50 μm. (B) The quantitative analysis of adherent cell numbers of SW1353 cells. The data were reported as mean ± SD, n = 5.*significant difference, P<0.05. ***significant difference, P< 0.001.(C) The quantitative analysis of adherent cell numbers of B16F10 cells. The data were reported as mean ± SD, n = 3. *P< 0.05, ***P< 0.001
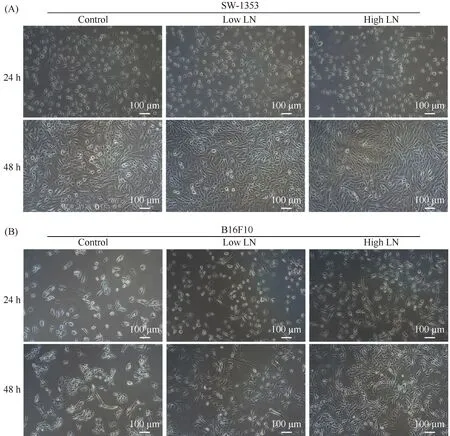
Fig.2 The cell morphology of SW1353 cells and B16F10 cells on different matrix (A) Representative bright field images of SW1353 cells cultured on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 24 hours and 48 hours. Scale bar, 100 μm. (B) Representative bright field images of B16F10 cells cultured on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 24 hours and 48 hours. Scale bar, 100 μm
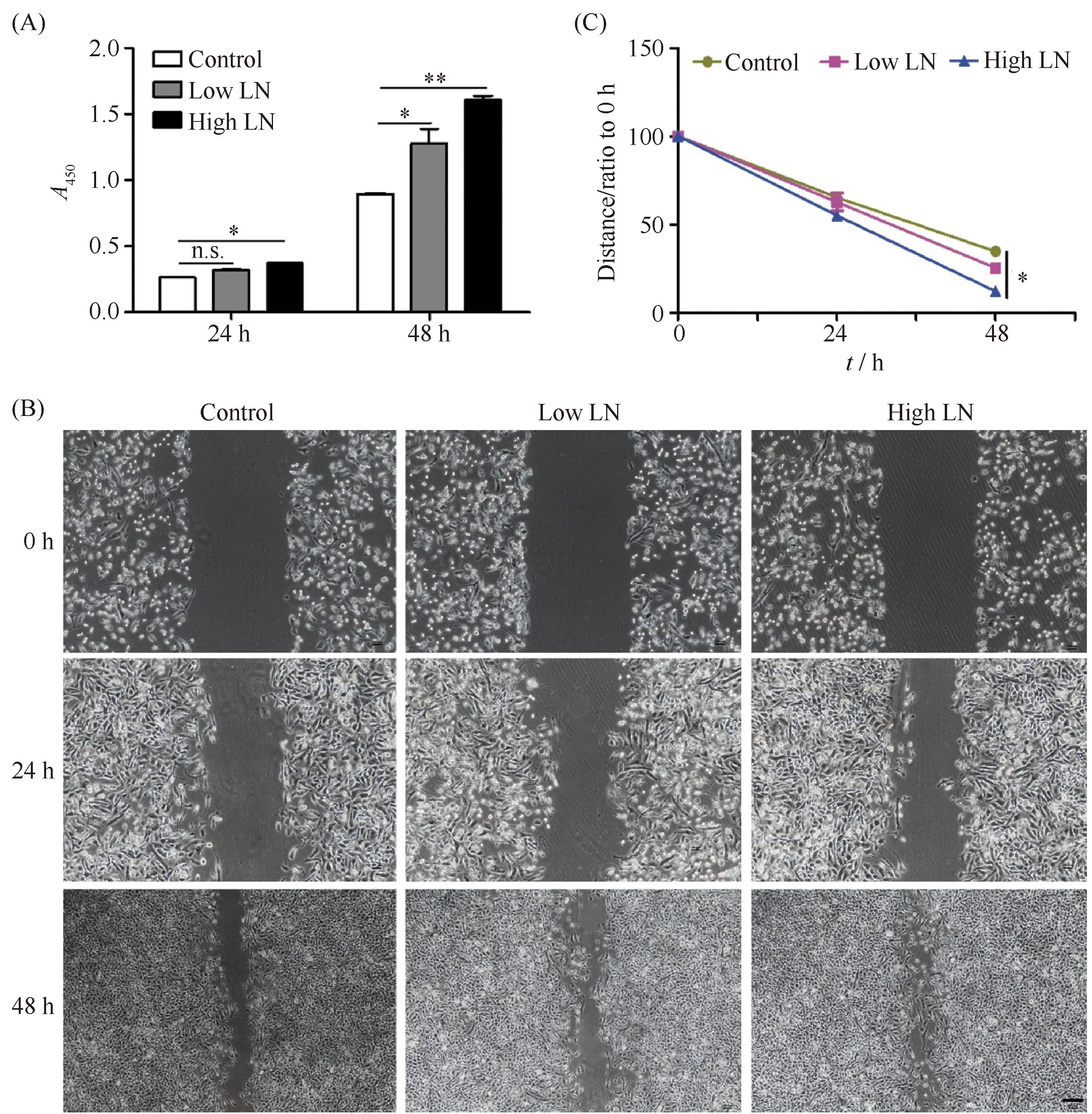
Fig.3 Laminin proteins treatment promoted cell proliferation and migration abilities of B16F10 cells (A) CCK-8 assays of B16F10 cells cultured on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 24 hours and 48 hours. (B) Wound healing images of B16F10 cells cultured on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 0, 24 and 48 hours. Scale bar, 100 μm. (C) The quantitative analysis of wound healing images. The data were reported as mean ± SD, n = 5. *significant difference, P<0.05. **significant difference, P<0.01
2.2 层黏连蛋白基质促进肿瘤细胞的迁移
为了探究细胞外基质蛋白-层黏连蛋白对肿瘤细胞迁移能力的影响,通过细胞划痕愈合实验,与Control组相比,High LN组的肿瘤细胞迁移速度增加,且迁移速度高于Low LN组(P< 0.05, Fig.3B, C),本结果提示,层黏连蛋白可以促进肿瘤细胞的迁移能力。
2.3 层黏连蛋白基质促进肿瘤细胞的干性表达
肿瘤干性是肿瘤恶性和血管生成拟态的关键标志。为了验证层黏连蛋白对肿瘤细胞干性的影响,通过CD133免疫荧光染色检测,结果显示:CD133定位于肿瘤细胞胞质,与Control组相比,High LN组的肿瘤细胞CD133阳性表达显著增多,同时也多于Low LN组(P< 0.05, Fig.4A, B),由此得出结论:层黏连蛋白可以促进肿瘤干性标志的表达。
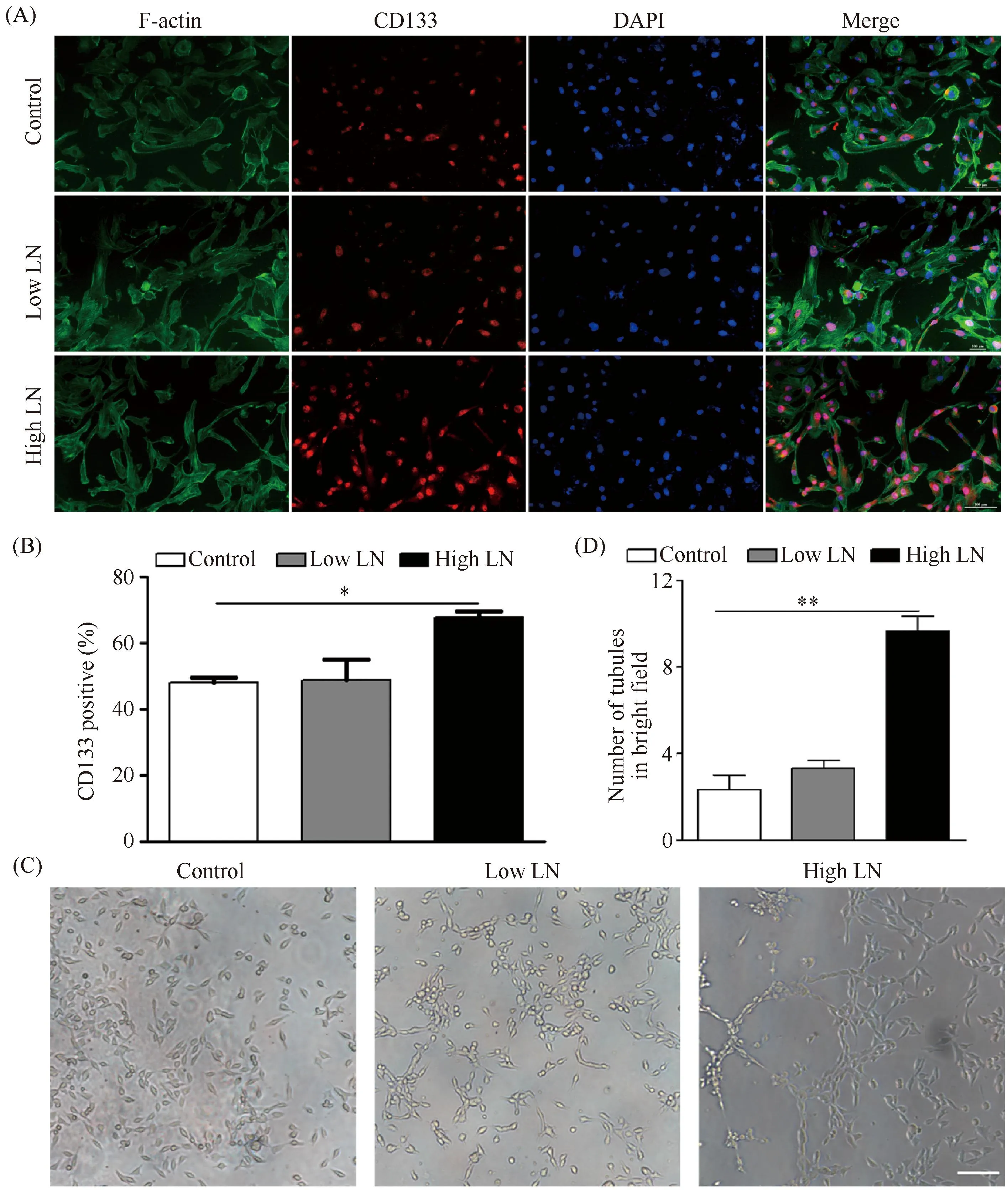
Fig.4 Laminin proteins treatment increases CD133 expression and VM formation of melanoma cells in vitro (A) Immunofluorescence staining of CD133 of B16F10 cells cultured on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 48 hours. CD133 was stained in red by FITC, the F-actin was stained in green by Phalloidin and the nuclei were stained in blue by DAPI. (B) The quantitative analysis of CD133-positive cells. The data were reported as mean ± SD, n = 5. *significant difference,P<0.05. (C) B16F10 cells were treated with PBS, Low LN (1 μg/mL) and High LN (5 μg/mL) for 24 hours and tested for VM formation through Matrigel-based tube formation. Scale bar, 100 μm. (D) Quantitation was shown and results were presented as mean ± SD, **Significant difference, P<0.01
2.4 层黏连蛋白促进肿瘤细胞体外血管生成拟态的构建
为了检测层黏连蛋白对黑色素瘤血管生成拟态形成的影响,本文进行了基质胶成管实验。本文发现,在层黏连蛋白基质存在的情况下,肿瘤细胞形成了更多的血管生成拟态的管状结构。尤其在高浓度LN的作用下,血管图案化环状结构数量显著多于其他两组(P< 0.01, Fig.4C, D),提示了层黏连蛋白可刺激细胞的行为改变,促进肿瘤细胞向VM转分化。
2.5 层黏连蛋白调控整合素以及上皮间质转化上皮间质转化相关基因表达
为了探究层黏连蛋白促进肿瘤血管生成拟态形成的分子机制,本文探究了肿瘤细胞上整合素的表达以及EMT相关基因表达情况,。免疫荧光染色结果显示:与Control组相比,High LN组能显著促进肿瘤细胞膜表面的波形蛋白的表达(P< 0.05, Fig.5A, B)。实时定量PCR结果显示:与Control组对比,在High LN组中,E-钙黏着蛋白的mRNA表达下调,而整合素、N-钙黏着蛋白、波形蛋白以及Snail、Twist的mRNA表达上调(P< 0.05, Fig.5C),以上结果表明,层黏连蛋白可以促进肿瘤细胞自身整合素表达,进一步调控EMT相关基因,最终促进肿瘤细胞形成血管生成拟态。
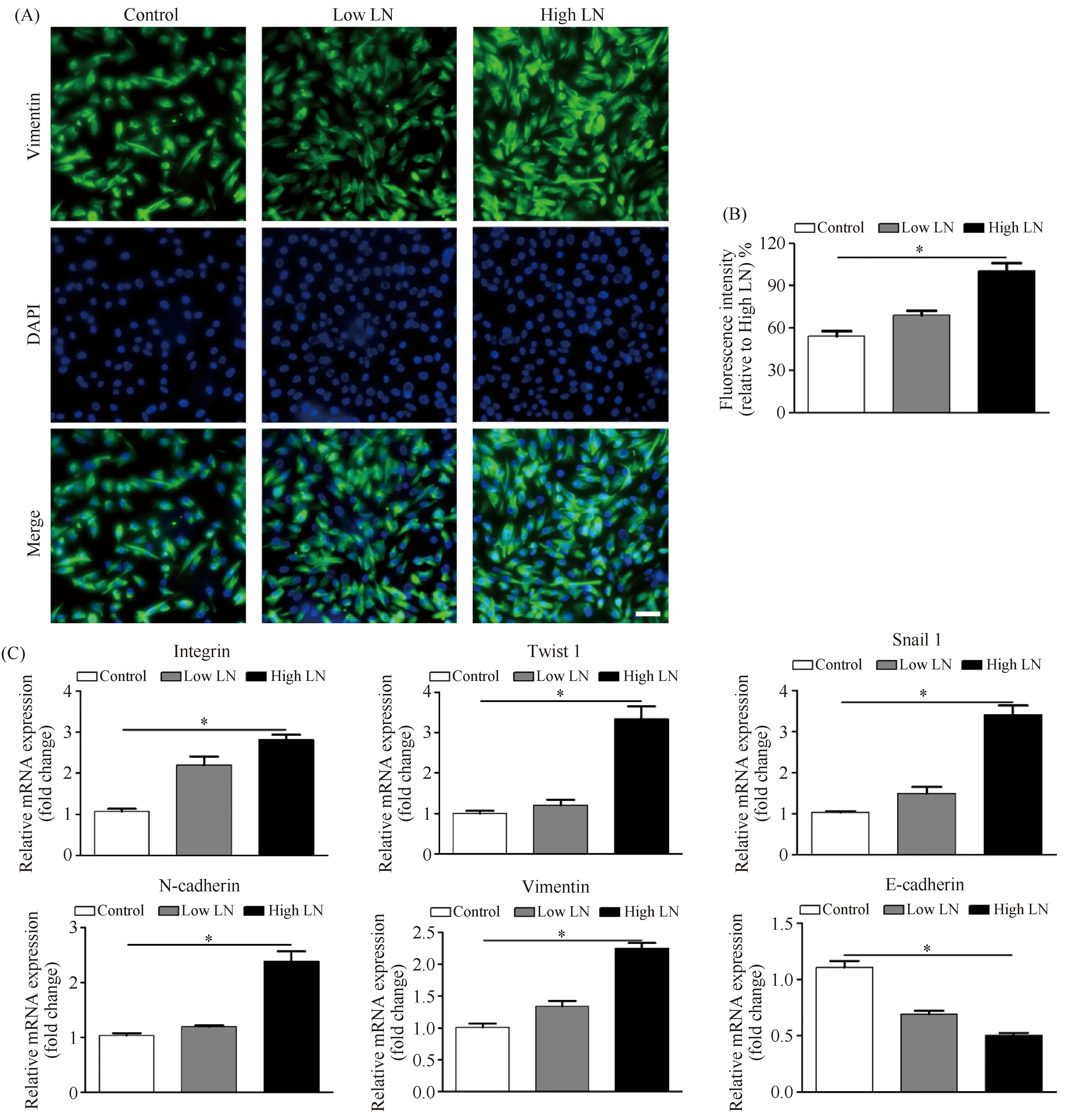
Fig.5 Laminin proteins treatment promoted the expression of stemness and EMT related markers in B16F10 cells (A) Immunofluorescence staining of vimentin of B16F10 cells cultured on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 48 hours. Vimentin was stained in green by FITC and the nuclei were stained in blue by DAPI. Scale bar, 100 μm. (B) The quantitative analysis of Vimentin fluorescence intensity. (C) Gene expressions of integrin, Twsit 1, Snail, N-cadherin, Vimentin and E-cadherin of B16F10 cells on TCPS, Low LN (1 μg/mL) and High LN (5 μg/mL) coated plates for 48 hours were analyzed by qPCR. The data were reported as mean ± SD, n = 5. *Significant difference, P<0.05
3 讨论
血管生成拟态(VM)作为肿瘤血管体系的补充,为肿瘤组织提供血液,维持肿瘤生长和转移[24];在多种肿瘤类型中,VM的存在与不良预后呈正相关[2]。据报道VM发生在许多实体瘤中,包括黑色素瘤、头颈部癌、乳腺癌、肝癌和胶质瘤等[9, 10]。鉴于恶性肿瘤与VM之间的密切联系,有必要对VM形成机制及靶向治疗开展研究。
理解肿瘤发生进程,包括VM的发生,不仅要研究肿瘤细胞本身,还要关注肿瘤细胞与周围的肿瘤基质(肿瘤微环境或niche)之间的动态的相互作用。尤其像 VM 这种特殊的血管,它本身就是肿瘤细胞与周围的胞外基质共同形成的管状结构[25]。这种肿瘤微环境是复杂的,主要包括一些细胞类型(例如肿瘤相关的成纤维细胞和间充质细胞等)、细胞外基质和液性因子,例如转化生长因子(transforming growth factor-β, TGF-β),血管内皮生长因子(vascular endothelial growth factor, VEGF)等。肿瘤微环境中直接影响肿瘤行为的细胞外基质蛋白质包括胶原(collagen)、纤连蛋白(fibronectin,FN)、层黏连蛋白(laminin,LN)和糖蛋白等[26, 27]。前期有研究表明,在胶原中,相较于Matrigel 乳腺癌细胞作为单个细胞迁移时,细胞具有更长的突出和更高的迁移率。个别细胞外基质已经被广泛研究,2017 年NatureCommunications杂志报道了通过改变一型胶原的3 D结构,可以促使乳腺癌细胞 MDA-MB-231发生迁移和转录响应,体外形成类似于VM的结构[28]。结论提示,细胞固有的特性和胞外基质蛋白质因素可以有助于VM的发生。在之前的报道中,层黏连蛋白、玻连蛋白和纤连蛋白基质可以通过激活整合素和表皮生长因子受体(epidermal growth factor receptor, EGFR)诱导恶性胶质瘤细胞产生耐药性[29]。目前,针对层黏连蛋白基质对于肿瘤细胞成血管生成拟态的研究未见报道。
本文研究层黏连蛋白基质对黑色素瘤细胞、骨肉瘤细胞黏附、增殖、迁移、干性和血管生成拟态能力的影响。CCK-8证实,层黏连蛋白基质促进肿瘤细胞的增殖。此外,最近的证据表明,VM的形成经常在富含ECM的区域观察到,这些区域含有大量的蛋白质,例如胶原蛋白、纤维连接蛋白和层黏连蛋白。据报道,IV型胶原蛋白在乳腺癌的侵袭和转移过程中发挥重要作用。换句话说,肿瘤细胞在形成VM之前,自身的侵袭转移能力得以增强。划痕愈合实验证实,层黏连蛋白可以促进肿瘤细胞的迁移。基质胶成管实验证实,层黏连蛋白促进肿瘤细胞行为的改变,也促进了肿瘤细胞形成血管生成拟态的能力。但是其中的机制尚不清楚。整合素是异二聚体跨膜细胞表面受体蛋白质,介导细胞和细胞外基质之间的结合。有报道称,在乳腺癌中EGFR可与整合素αvβ3协同调节胞外配体的结合[30]。通过免疫荧光染色和实时定量PCR实验,结果证实,层黏连蛋白基质可以促进肿瘤细胞膜上整合素的表达,同时,肿瘤细胞中EMT相关的mRNA水平发生改变,结果表明,层黏连蛋白可以促进肿瘤细胞的上皮间质转化。肿瘤细胞发生EMT过程中,伴随着相关基因的调控。已经证实,EMT在多种肿瘤中发挥着重要作用。肿瘤转移和VM的形成涉及到肿瘤细胞失去上皮黏附分子,并获得间充质表型(例如波形蛋白(vimentin), N-钙黏着蛋白(N-cadherin))。有文献报道证明,肝细胞癌中 VM的形成与EMT调节因子Twist1相关。这些结果表明,VM的形成可能是EMT的一部分[31],但是关于VM形成的具体分子调控机制仍需要进一步探究。
综上所述,层黏连蛋白作为一种肿瘤微环境中细胞外基质蛋白,在肿瘤发生发展过程中发挥关键调控作用,同时也调控肿瘤血管生成拟态的发生。本研究强调了细胞外基质与细胞之间相互作用的重要性,尤其是肿瘤血管生成拟态形成机制中。本研究初步证实了层黏连蛋白基质促进肿瘤细胞黏附、增殖、迁移、干性与VM形成及机制,为抗血管生成拟态的治疗提供了新的靶标。
