芳香烃受体蛋白质生理功能及在肿瘤中的作用机制
2024-02-27常文静严汉池
常文静, 严汉池
(天津大学生命科学学院结构生物学实验室, 天津 300072)
芳香烃受体(aryl hydrocarbon receptor,AHR)作为一种配体激活的转录因子,属于PAS同源域(PER-ARNT-SIM, PAS)蛋白质,是碱性螺旋-环-螺旋(basic helix-loop-helix, bHLH)基因超家族中已知唯一被配体激活的成员[1]。AHR同配体结合被激活后转位至细胞核,同AHR核转运蛋白(AHR nuclear translocator,ARNT)二聚化,并与特定DNA序列结合,启动靶基因的转录[2, 3]。
最初,芳香烃受体(aryl hydrocarbon receptor,AHR)在毒理学家研究芳烃代谢和二恶英(2,3,7,8-tetrachloro-dibenzop-dioxin,TCDD)毒性实验中被发现,因其为控制芳基烃羟化酶(aryl hydrocarbon hydroxylase,AHH)表达的“诱导受体”[4]而得名。AHR在进化上具有保守的结构域和功能,在多种组织中均有表达[5],因在介导外源性物质的毒性和致癌性中发挥重要作用而被广泛研究。近年来,相关研究结果表明,AHR能够对来自膳食成分、宿主细胞代谢和肠道微生物群的多种外源性和内源性信号作出反应,在包括免疫、发育、炎症和癌症在内的多种生理和病理学中发挥着重要作用[6, 7]。
1 芳香烃受体的基本结构及其配体
1.1 AHR基本结构
AHR属于基本bHLH转录因子家族,其结构由配体结合的N-端bHLH结构域、C-端可变结构域和PAS结构域三部分组成(Fig.1)[8]。其中,位于AHR蛋白质N-端的bHLH基序具有2个功能独特且高度保守的结构域:碱性域和HLH域,它们共同构成约60个氨基酸残基的区域。碱性域是基本结构域,它将AHR结合在DNA靶基因启动子区,称为AHR反应元件(AHR response elements,AHREs)共有调控序列(5′-T/GCGTG-3′)上[9];HLH域促进蛋白质-蛋白质相互作用,与AHR核转运蛋白(AHR nuclear translocator,ARNT)形成异二聚体复合物。PAS结构域包括2个结构重复序列PAS-A和PAS-B[10],其中,PAS-A结构域参与同ARNT的异二聚化,增强二聚体复合物的稳定性。生化和缺失研究表明,其N端的α螺旋结构是维持AHR和ARNT之间稳定性不可或缺的二聚体界面[11]。AHR的配体结合位点存在于PAS-B 结构域,并包含几个对配体结合至关重要的保守残基[12]。突变研究表明,小鼠残基丙氨酸375、组氨酸285和谷氨酰胺377在配体结合中发挥关键作用[13]。C-端结构域包含分别富含酸性残基、谷氨酰胺及丝氨酸、苏氨酸和脯氨酸的3个亚结构域,共激活因子和共抑制因子通过该结构域与AHR相互作用[14]。
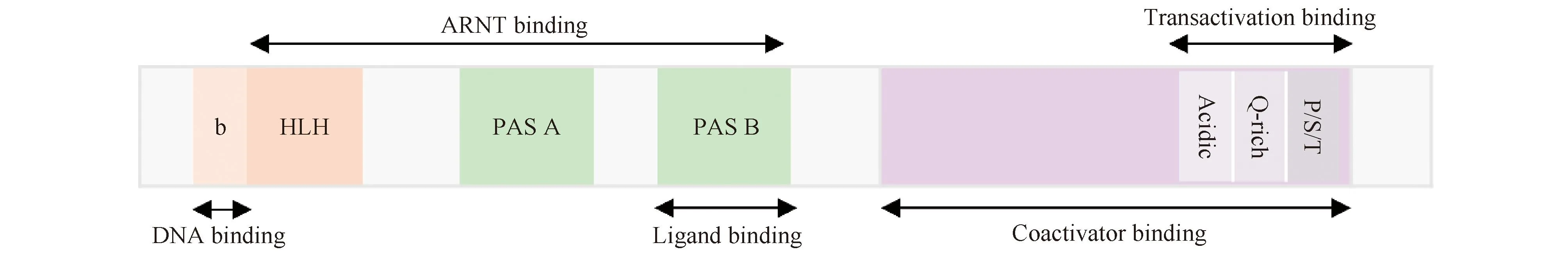
Fig.1 Functional domains of AHR The bHLH domain is involved in DNA binding and protein interaction ; the PAS domain mediates heterodimerization and ligand binding; the transcriptional activation domain consists of three subdomains: an acidic region rich in glutamic acid and aspartic acid residues, a glutamic acid-rich region (Q-rich), and a P/S/T region rich in proline/serine/threonine residues
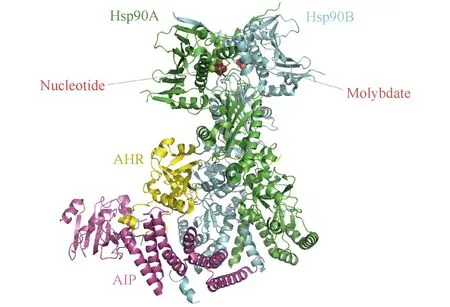
Fig.2 Cryo-EM structure of the agonist-bound Hsp90-AIP-AHR cytosolic complex 2.85 Å structure of the complex reveals a closed conformation of an Hsp90 dimer with AHR threaded through its lumen and AIP serving as a brace[23]
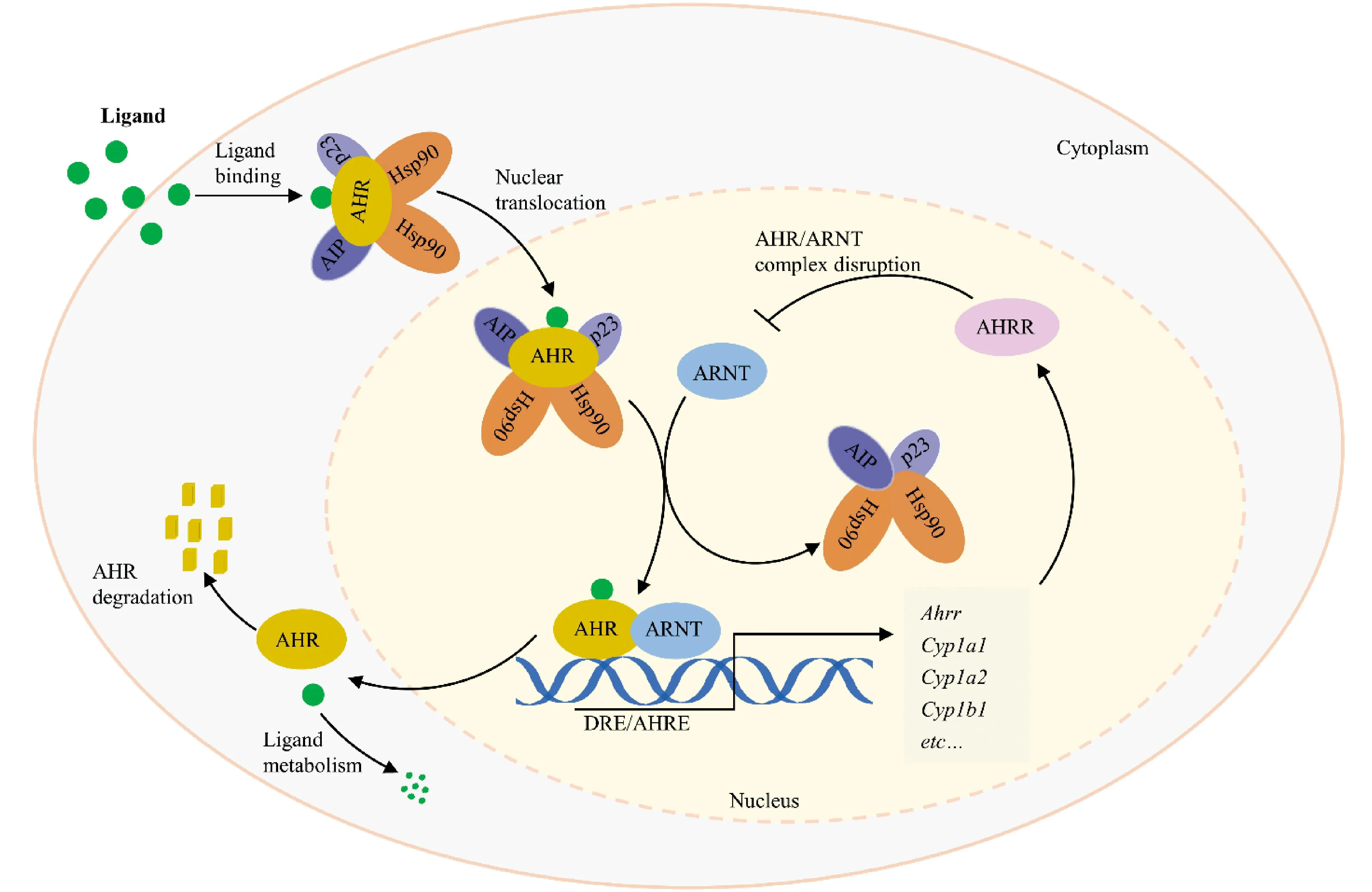
Fig.3 The canonical AHR pathway Under ligand-free conditions, AHR is present in the cytoplasm and forms complexes with heat shock protein 90 (Hsp90), AHR-interacting protein (AIP) and the chaperone protein p23. After binding to the ligand, it is translocated into the nucleus, released from the complex, forms a dimer with ARNT, binds to the genomic region containing its binding motif dioxin response element (DRE) , and induces transcription of the target genes
1.2 AHR配体
AHR作为一种配体依赖性转录因子,能与配体以高亲和力特异性结合,其配体有多种不同来源,主要包括环境污染物、细胞内代谢物、膳食成分和细菌代谢等[15]。
环境污染物是最早被鉴定为AHR配体的分子,主要包括平面卤代多环烃 (例如二恶英、联苯)和多环芳烃(例如苯并蒽和苯并芘)[1]。这些分子以复杂的混合物存在于食物或空气中,且极其稳定。长期环境暴露会导致神经发育异常、肾功能衰竭、甲状腺功能障碍和生殖功能的破坏[14]。
目前已知的AHR内源性配体主要是人体必需氨基酸色氨酸(tryptophan,Trp)的代谢衍生物。色氨酸通过吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)和色氨酸2,3-双加氧酶(tryptophan 2,3-dioxygenase,TDO2)分解产生犬尿氨酸(kynurenin,Kyn)[16]。Kyn是一种中等亲和力的AHR配体,参与调节性T细胞(regulatory T cells,Tregs)功能成熟和抑制树突状细胞(dendritic cells, DC)中炎性细胞因子的产生,调节免疫疾病小鼠模型的炎症过程[17]。人脑肿瘤细胞中TDO大量生成Kyn,并与AHR介导的抗肿瘤反应抑制和恶性进展有关[18]。此外,在紫外光照射下,色氨酸降解生成6-甲酰基吲哚并[3,2-b]咔唑(6-formylindolo[3,2-b]carbazole,FICZ),FICZ对AHR具有与TCDD相似的亲和力,能在皮摩尔浓度下激活AHR,FICZ也在人体内存在,尤其是皮肤中[19, 20]。
膳食来源配体主要是十字花科芸薹属蔬菜,例如西蓝花、花椰菜和甘蓝,该类物质富含芸苔葡糖硫苷,食用后,其在胃内抗坏血酸存在的酸性条件下水解为吲哚-3-甲醇(indole-3-carbinol,I3C)及其下游缩合衍生物3,3'-二吲哚甲烷(3,3'-di-indolyl-methane, DIM)和和吲哚[3,2-b]咔唑(indolo [3,2-b] carbazole, ICZ),它们作为AHR激动剂,参与维持上皮内淋巴细胞和固有淋巴细胞所需的肠道AHR活性[8, 21]。其他膳食来源的AHR配体是存在于果蔬中的天然黄酮类化合物,例如高良姜素、染料木黄酮、芹菜素和槲皮素等[22]。
有研究发现,共生细菌和真菌的代谢物也具有AHR激动特性。枯草芽孢杆菌能够合成色氨酸,并根据膳食摄入引起的色氨酸浓度变化来调节自身合成色氨酸的量,并将其代谢为能够激活AHR的配体[22];包括罗伊氏乳杆菌在内的多种乳杆菌,能够产生吲哚-3-醛等AHR配体,通过多种方式与宿主免疫系统发生相互作用,调节肠道和黏膜免疫,维持机体稳态。
2 芳香烃受体的作用机制
AHR具有多种配体结合位点,能够与广泛的合成和天然配体相互作用,通过经典信号通路和其他非经典信号通路在细胞内发挥作用。
2.1 经典AHR信号通路
AHR激活过程主要包括配体结合、核易位和与典型的外源性反应元件结合。在无配体的稳态条件下,AHR存在于细胞质中,同热激蛋白90(heat shock protein 90,Hsp90)、AHR相互作用蛋白(AHR-interacting protein, AIP)及伴侣蛋白p23形成复合物[23]。Hsp90结合bHLH和PAS结构域,将AHR维持在高亲和力结合配体的构象,增强配体诱导的激活,同时防止AHR核易位[24];p23能够稳定AHR-Hsp90相互作用,维持非活性AHR在细胞质中的定位,阻止其在无配体的情况下发生核易位[25];AIP通过抑制AHR泛素化来维持其在胞质内的高蛋白质水平,以增强AHR传导信号[26]。
AHR与配体结合之后,其构象发生改变,暴露核定位信号,AHR-配体复合物转位至细胞核内,ARNT介导Hsp90置换,形成AHR-ARNT异源二聚体[1, 27]。此外,也有学者认为,Hsp90的释放发生在细胞质中,因为Hsp90的释放是形成AHR-ARNT异源二聚体和诱导AHR 转录活性所必需的[8]。AHR-ARNT二聚体同目标基因启动子区域的AHREs结合,通过募集转录所需的各种物质来诱导靶基因的转录[28]。AHR调控多种原型基因,包括细胞色素P450家族基因(CYP1A1、CYP1A2、CYP1B1)、AHR阻遏因子基因和BRAHMA相关基因,分别在环境致癌物的解毒、AHR依赖性基因的负调控、染色质结构的重塑中发挥重要作用[29]。
2.2 非经典AHR信号通路
最近的研究发现,除了经典的信号传导通路,活化的AHR能够在细胞核中与不同的转录因子形成复合物,导致其与非ARE DNA元件结合以调节靶基因的表达[30]。例如,AHR激活后,酪氨酸激酶Src激活正向调节丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和黏着斑激酶(focal adhesion kinase,FAK),导致细胞迁移和炎症增强等病理生理过程[31]。此外,AHR和RelB(V-Rel reticuloendotheliosis viral oncogene homolog B,RelB)之间存在直接的物理相互作用,AHR可与RelB相互作用形成RelB-AHR反应元件诱导细胞因子和趋化因子的表达[32, 33]。一些研究显示,多种炎症基因,包括单核细胞趋化蛋白1(monocyte chemoattractant protein 1, MCP-1)、白细胞介素8和CC-趋化因子配体1等趋化因子,均以AHR依赖方式调控[34, 35]。
2.3 AHR负反馈调节
在AHR激活的负反馈环调节中,下调AHR信号存在3种机制。AHR下游基因靶点AHR抑制因子(aryl hydrocarbon receptor repressor,AHRR)是一种额外的bHLH-PAS蛋白质,其C-末端为反式抑制结构域,它允许参与AHR负调控环路的辅抑制因子的结合。诱导后,AHRR与ARNT发生二聚化竞争AHRE占有率,同时也通过改变CYP1A1启动子周围的染色质结构和可能相关的AHRE驱动基因抑制AHRE介导的转录[36, 37]。此外,AHR的编码蛋白质细胞色素p450依赖性单加氧酶(cytochrome P450 1A1 enzyme,CYP1A1),通过降解内源性配体来限制AHR的激活[38]。AHR输出细胞核后,在细胞质区室中通过泛素化和蛋白酶体途径被迅速降解。这种负调控环和受体的蛋白酶体降解能够保护生物系统免受激动剂过度刺激的后果,同时提供信号的时间控制[14]。
3 芳香烃受体的生理功能
AHR在体内多种细胞类型中广泛表达。作为一种多功能转录因子,AHR同其他转录因子及细胞和系统信号网络相互作用,整合各种信号通路,在解毒代谢、屏障保护、免疫调控等方面发挥多效功能。
3.1 AHR参与化学和微生物防御
AHR参与化学防御。AHR可诱导药物代谢3个阶段的基因电池,包括经典的Ⅰ相酶(CYP1A1、CYP1A2、CYP1B1)、Ⅱ 相酶(尿苷二磷酸葡醛酸转移酶家族、谷胱甘肽硫转移酶1/2)及人类共轭转运蛋白质ABCG2转运蛋白(ABC subfamily G2,ABCG2)[39]。Ⅰ 相酶负责代谢活化和解毒燃烧产物中存在的大量多环芳烃和芳香胺;谷胱甘肽硫转移酶家族对化学致癌物、环境污染物等亲电性外源物质具有解毒作用[40];尿苷二磷酸葡醛酸转移酶家族参与NADPH(reduced nicotinamide adenine dinucleotide phosphate)醌氧化还原酶产生的对苯二酚的解毒,从而防止氧化还原循环。
AHR参与微生物防御。Kimura等[41]研究表明,AHR缺陷小鼠更容易受到细菌感染。AHR通过诱导巨噬细胞凋亡抑制因子,促进巨噬细胞在感染环境下的存活;此外,AHR诱导NADPH氧化酶亚基p40phox表达以增加NADPH氧化酶活性,促进活性氧的产生来清除细菌[42]。
3.2 AHR参与皮肤屏障形成
Fernandez-Salguero等[43]对AHR缺陷小鼠的研究发现,该缺陷小鼠背部皮肤表现出滤泡间和滤泡表皮增生,并伴有结构异常的毛发纤维和毛囊破裂,易发生细菌感染。TCDD对小鼠皮肤发育影响的结果指出,TCDD刺激后小鼠皮肤形态发生过程中角质形成细胞终末分化的连丝蛋白表达加速,暗示AHR为晚期角质形成细胞终末分化的调节剂[44]。FICZ通过激活AHR-OVOL1(OVO-like 1)通路上调聚丝蛋白和兜甲蛋白等屏障相关蛋白质的表达,从而增强皮肤屏障的保护[45]。此外,在角质形成细胞中,AHR参与紫外线应激反应和抗凋亡信号对紫外线的反应。皮肤中AHR的存在可以保护紫外线诱导的红斑,或改变角质形成细胞的基因表达谱,参与紫外线诱导的免疫抑制[46]。
3.3 AHR参与免疫调节
已有数据表明,AHR信号在免疫系统中发挥多重效应。AHR通过调控抗原提呈细胞介导机体免疫炎症反应,并直接或间接地调节T细胞和B细胞的分化及其下游分泌因子的表达,在调节先天性免疫和适应性免疫方面具有重要作用。
3.3.1 AHR与先天性免疫 AHR负调控巨噬细胞中脂多糖(lipopolysaccharide,LPS)介导的炎症反应。经LPS刺激后,巨噬细胞中AHR被诱导上调表达,驱动白介素10(interleukin-10,IL-10)等免疫抑制因子的产生,对持续性炎症发挥保护作用。同时,AHR与信号转导与转录激活因子1(signal transducerand activator of transcription 1,STAT1)和核因子(nuclear factor-κB,NF-κB)形成阻遏复合物,从而抑制促炎因子IL-6的转录[47-49]。当AHR功能被抑制时,能够完全消除巨噬细胞中凋亡细胞诱导的Il-10基因表达,体内外IL-6、IL-12和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)增加,对凋亡细胞相关抗原的耐受性丧失[8]。
当受到抗原刺激时,DCs迁移至淋巴结,并向T细胞呈递抗原。在LPS或CpG刺激下,DCs中AHR表达上调,并诱导免疫抑制酶IDO表达,发挥负调控作用。AHR激活诱导IDO1和IDO2表达,将Trp分解代谢为Kyn,使T细胞从辅助T细胞17(T helper 17,Th17)向Foxp3+Treg细胞分化,促进免疫耐受反应[22, 50]。此外,AHR内源性配体2-( 1′H-吲哚-3′-羰基)-噻唑-4-羧酸甲酯能够直接作用于DCs和T细胞,促进主动免疫耐受的诱导[51]。以上结果表明,AHR及其配体对于防止自身免疫和对病原体的过度免疫反应具有重要作用。
另外,Goudot等[52]发现,AHR的激活能够调节单核细胞对巨噬细胞和Dcs的分化方向。AHR被环境中I3C等配体激活,诱导B淋巴细胞成熟蛋白1(B lymphocyte-induced maturation protein 1,BLIMP-1)激活,促进单核细胞向DCs分化,同时抑制其向巨噬细胞分化,AHR缺陷型小鼠则表现为单核细胞向巨噬细胞的分化。AHR作为单核细胞命运的分子开关,通过对微环境中配体的感知,调控先天免疫中巨噬细胞-DCs的平衡,以调节免疫进程和结果。
3.3.2 AHR与适应性免疫 T细胞在适应性免疫中具有重要作用,其收到特定抗原信号后分化为效应细胞,并执行清除抗原刺激的相关功能。经特定细胞因子刺激,CD4+T细胞可分化为Th1、Th2、Th17和Tregs等多种亚群,AHR在各亚群分化及细胞因子表达过程中发挥作用[53]。Th1细胞分泌细胞因子IFN-γ,参与细胞免疫,过度反应会导致组织损伤;Th2细胞分泌细胞因子IL-4和IL-5,刺激B细胞增殖,介导体液免疫[54],过度反应会导致超敏反应。AHR作为体内Th1/Th2平衡的调节剂,使Th1/Th2平衡向Th1偏移,并抑制Th2细胞因子的产生,导致具有抗过敏作用的免疫反应[55]。Th17细胞负责抑制胃肠道病原体的系统性感染。有研究表明,AHR参与Th17细胞分化终末阶段,并增强促炎细胞因子IL-17、IL-22的产生[56]。Tregs通过抑制针对自身抗原的炎症反应来阻止自身免疫性疾病的发展,AHR通过增强转化生长因子β(transforming growth factor-β,TGF-β)信号促进Tregs发育,并上调Tregs细胞标志物FoxP3的表达[54]。此外,AHR也能够调节抗原特异性CD8+T细胞反应。在流感病毒感染过程中,AHR的发育激活改变了CD8+T细胞在感染前和感染过程中DNA甲基化和基因表达模式,导致CD8+T细胞应答的持久降低[57];同时,AHR也参与组织驻留记忆CD8+T细胞在皮肤中的滞留过程[58]。以上结果表明,AHR的激活对于平衡体内T细胞的免疫反应具有重要意义。
此外,Vaidyanathan等发现,AHR在B细胞受体介导的激活下表达强烈上调,通过Bach2调控BLIMP-1的表达,抑制B细胞在体外向浆母细胞和体内向分泌抗体的浆细胞分化[59],表明AHR在调节激活诱导的细胞命运中发挥着重要作用。
4 芳香烃受体在肿瘤中的功能
在肿瘤发生的初始阶段,AHR与配体结合进入核内,诱导CYP1A1、CYP1B1和谷胱甘肽转移酶等的表达[60],介导机体对外源毒性物质的解毒代谢反应,但同时也产生了具有高致癌效力的某些毒性中间活性物质,造成DNA损伤,从而导致肿瘤发生。IDO1和TDO2能在各种肿瘤细胞表达,通过色氨酸代谢产生大量Kyn,通过建立自分泌和旁分泌途径导致AHR的持续性激活[1]。另一方面,AHR作为抑癌基因,在肿瘤发生过程中表达沉默。经毒性物质二乙基亚硝胺处理,同AHR+/+相比,AHR-/-小鼠肝的腺瘤显著增多,增殖标志物和炎症标志基因表达增加[61]。根据所处细胞种类和配体环境的不同,AHR对肿瘤表现出抑制或促进的不同影响。
4.1 AHR对细胞增殖的影响
AHR对细胞增殖的调控依据不同细胞的特异性分别发挥促进或者抑制的作用。Abdelrahim等[62]使用siRNA技术下调MCF-7人乳腺癌细胞和HepG2肝癌细胞中AHR表达,结果发现,siRNA能够促进MCF-7细胞增殖,但下调了HepG2细胞中相关蛋白质的表达,表明AHR对MCF-7细胞生长具有抑制作用,而对HepG2细胞增殖发挥促进作用。人类肺癌A549细胞中,通过过表达AHR以增强E2F1(E2F transcription factor 1)/DP2的活化,提高增殖细胞核抗原水平,从而促进肿瘤细胞增殖[63]。另一方面,在肝癌细胞中,AHR通过直接改变Kip1的转录来诱导激活p27Kip1细胞周期蛋白质抑制剂,Kip1反义表达细胞对TCDD具有抗性,因此,能够抑制其诱导的肝癌细胞增殖[64]。此外,AHR能够与视网膜母细胞瘤抑制蛋白质相互作用,从而使其介导的E2F依赖的转录抑制和细胞周期阻滞,以及通过上调转化生长因子TGF-β的胞内水平来抑制细胞增殖[65]。目前的研究结果显示,细胞类型是影响AHR对细胞增殖作用效应的重要参数,但具体的作用机制仍需要更进一步的研究来阐明。
4.2 AHR对细胞周期的调控
在生理状态下,AHR具有促进细胞周期进程的能力,但当其接触外源性配体后,表现出对细胞周期的抑制作用。Barhoover等[66]研究表明,AHR在胞内与周期蛋白依赖性激酶4(cyclin-dependent kinases 4,CDK4)及细胞周期蛋白1(cyclin D1,CCND1)相互作用,推动细胞由G1期到S期的进展。研究表明,AHR缺陷型小鼠肝癌细胞同野生型细胞相比,表现出细胞形态改变、白蛋白合成减少及细胞G1期延长等特征。在人乳腺上皮细胞中,AHR过表达时,群体倍增时间显著减少,细胞周期分析表明,AHR过表达通过增加进入S期和G2/M期的细胞百分比来增强细胞周期进程,并表现出细胞运动和迁移增强[67, 68]。
4.3 AHR对细胞凋亡的调控
相关研究表明,AHR能够通过调节参与细胞凋亡信号基因的表达来调控细胞凋亡。Park等人研究显示,AHR敲除小鼠能够免受Fas Jo2抗体的致命影响,将AHR引入AHR-/-小鼠后,增加了响应Fas配体的细胞死亡程度,伴随着胞内胱天蛋白酶(caspase)活性增强及线粒体细胞色素C释放增加[69, 70]。在促凋亡剂 TNF-α +放线菌酮刺激下,含有AHR的小鼠肝癌1c1c7细胞发生凋亡,而AHR缺陷型Tao细胞对其不敏感。在无外源配体的情况下,AHR影响通常存在于溶酶体中的蛋白酶的运输和加工,导致释放的蛋白酶通过激活 Bid来触发凋亡程序[71]。Wu等[72]对小鼠1c1c7细胞系及其AHR缺陷细胞分别进行紫外线照射、过氧化氢和血清饥饿处理,细胞凋亡终点分析表明,野生型细胞对这些压力更为敏感,表明AHR在面对启动内在凋亡途径的刺激时发挥细胞保护作用。
另一方面,当外源性配体激活AHR时,其对细胞凋亡表现出抑制作用。TCDD能够通过诱导birc3、dad1、tnf等相关基因的表达,以及维持染色体的完整性来抑制紫外光诱导的细胞凋亡[73]。
4.4 AHR与细胞间接触
细胞间接触是细胞增殖、分化和细胞运动的关键调节剂,通过细胞-细胞接触抑制增殖的过程称为接触抑制。肿瘤发展的特征是由细胞增殖增加或凋亡水平降低导致的不平衡增殖,因而细胞接触抑制释放会促进肿瘤的发展进程。AHR激活导致细胞接触抑制释放使细胞增殖失去平衡,从而促进肿瘤的发生发展。
AHR能够特异性地干扰细胞接触抑制的信号级联反应。Weiss等[74]研究发现,转录因子JunD(Jund proto-oncogene subunit,JunD)作用于转录激活因子(activating transcriptional factor,ATF)/环腺苷酸应答元件(cAMP response element,CRE)位点引起的细胞周期蛋白A的失调是肿瘤启动子TCDD引起的接触抑制丧失的关键。WB-F344大鼠肝卵圆细胞经TCDD处理,引发JunD的诱导,进而激活细胞周期蛋白A的转录,导致细胞接触抑制释放。通过RNA干扰敲除ATF,可以抑制TCDD依赖性的细胞周期蛋白 A诱导。
另一方面,在无外源配体的情况下,AHR能够因细胞-细胞接触的丧失而瞬时激活。在小鼠成纤维细胞的高密度培养中,AHR核定位及其靶基因CYP1B1的表达均无法检测,但通过悬浮或以低密度接种细胞使其失去细胞间接触,便会引起AHR的核易位,同时伴随CYP1B1的表达[75]。当细胞被稀疏接种时,AHR主要位于细胞核中;当细胞亚汇合时,AHR在细胞质和细胞核中均等分布;当细胞完全汇合时,免疫染色的AHR主要位于细胞质中。使用免疫印迹分析,显示细胞核中AHR的相对量与细胞密度成比例地逐渐降低;使用连接到ARE序列的荧光素酶cDNA的报告分析表明,AHR活性也受细胞密度的影响,虽然在亚汇合培养中观察到最大荧光素酶活性,但在汇合培养中荧光素酶活性降低至基础水平[76]。这些研究结果表明,AHR的亚细胞定位和转录活性受细胞密度的调节。
4.5 AHR对血管生成的影响
血管的生成在肿瘤发展过程中具有重要作用,Roman等[77]发现,AHR有助于血管内稳态和内皮细胞对毒素的反应。实验中AHR-/-小鼠体内血管内皮生长因子(vascular endothelial growth factor,VEGF)活性降低,其受体VEGFR-1/Flt-1表达下调,内皮细胞无法分支形成管状结构,体内血管生成受损。此外,AHR-/-细胞中TGF-β表达上调,抑制了内皮细胞和血管的生成[78]。另有研究表明,在人肺癌细胞系中下调AHRR的表达增强对凋亡信号的抵抗,提高体外运动侵袭能力及体内的血管生成潜能[79]。这些数据强调了AHR在心血管稳态中的作用,以及通过调节血管的生成来改变肿瘤细胞的活力和迁移能力。
5 问题与展望
AHR作为环境污染物受体介导毒理学反应而被初识,但随着研究的广泛和深入,作为位于信号网络交叉点的转录因子,参与多种对细胞正常内稳态至关重要的信号通路,在免疫防御、屏障保护、维持器官正常功能及组织代谢稳态等多个方面发挥重要作用。AHR作为一种重要的环境调节剂,参与介导了多种免疫炎症和肿瘤发生发展过程,揭示其潜在的治疗价值。根据AHR在不同免疫细胞中的功能,筛选特定的激动剂或拮抗剂,可能有助于产生免疫耐受的自身免疫性疾病及炎症疾病的治疗。依所处微环境不同,AHR可能发挥促肿瘤或抗肿瘤的作用,根据给定的抗癌作用机制设计和选择AHR配体有助于发现具有治疗价值的分子。但是在目前,许多功能研究是基于啮齿动物模型,鉴于物种之间的生理差异,动物模型的许多发现不能直接外推到人类,AHR在肿瘤病理中作用的分子机制仍有许多尚不清楚,揭示其在癌症多个病理阶段中作用的潜在分子机制仍是目前研究的一大难题。由于AHR具有重要的药物潜力,未来对于AHR在肿瘤免疫中分子机制的研究与靶向药物探索仍具有重要研究价值。
