淋巴细胞胞质蛋白2在恶性肿瘤发生与发展过程中的免疫调节机制
2024-02-27韩英伦
魏 琳, 韩英伦,2), 刘 欣,2)*
(1)辽宁师范大学生命科学学院七鳃鳗研究中心,辽宁, 大连 116029;2)大连工业大学海洋食品精深加工关键技术省部共建协同创新中心,辽宁, 大连 116034)
淋巴细胞胞质蛋白2(lymphocyte cytoplasmic protein 2,LCP2)又称含SH2结构域的76 kD白细胞蛋白(Src homologous 2 domain containing leukocyte protein of 76 kD,SL P-76),是一类缺乏内在催化功能的模块化衔接蛋白质,具有控制与细胞发育、细胞凋亡以及细胞增殖相关的信号转导的作用。20世纪80年代,通过研究人类白血病T细胞系(Jurkat细胞系)对T细胞受体(T cell receptor, TCR)刺激产生的相关反应,初步确定了LCP2在TCR信号转导通路中发挥重要作用[1]。后续研究发现,LCP2与T细胞激活连接蛋白(linker for activation of T-Cell, LAT)及蛋白质酪氨酸激酶(protein tyrosine kinase, PTK)等共同协调T细胞中的大分子信号复合物,实现调控TCR信号转导的功能[2,3]。LCP2不仅能够通过免疫细胞相关的信号通路达到保护机体清除病原体的作用,而且最近研究证明,该分子在免疫失调疾病及恶性肿瘤的发生与发展中也发挥调控作用。本文就LCP2蛋白的分子结构及其在免疫失调性疾病及恶性肿瘤的发生和发展中的调节机制进行介绍,以期为恶性肿瘤的临床诊断、预后治疗和病理标志物开发方面提供参考依据。
1 淋巴细胞胞质蛋白2的生物学特征及其在免疫细胞中的功能
LCP2是SLP-76蛋白质家族的重要成员之一。除LCP2外,SLP-76蛋白质家族还包括B细胞连接蛋白(B-cell linker protein,BLNK)、细胞因子依赖性造血细胞接头(cytokine-dependent hemopoietic cell linker, CLNK)。SLP-76蛋白质家族在结构上具有高度相似性但分布不同[1]。在T细胞信号通路中,LCP2通过与其他因子相互作用,调节TCR信号转导过程,从而实现T细胞对机体免疫的调节。
人的LCP2基因定位于染色体5q33.1上,其cDNA的全长为1 984 bp,编码的蛋白质由533个氨基酸组成。LCP2分子是在人的骨髓、子宫内膜、淋巴结、血小板、胰脏、脾和扁桃体等组织中表达的一种特有蛋白质[1]。LCP2分子具有3种结构域,分别是N-末端的1个无菌alpha基序(sterile alpha motif,SAM)结构域、中间富含脯氨酸区域的3个Src同源区3结构域(Src homologous region 3 domain,SH3)和1个C-末端的 SH2结构域(Fig.1)。早期的研究表明,LCP2通过参与TCR信号转导,增强下游转录调控因子活化T细胞核因子(nuclear factor of activated T cells,NFAT)、激活蛋白-1(activator protein-1, AP-1)及细胞外调节蛋白质激酶1(extracellular regulated protein kinase 1, Erk)的活性,促进细胞因子白细胞介素-2(Interleukin-2,IL-2)的产生,以显著影响T细胞的活化、增殖及其分化[4]。在体外,敲除Lcp2的SAM结构域、C-末端SH2结构域或富含脯氨酸区域中的任何1个SH3结构域,都会降低LCP2对NFAT的激活能力[1]。
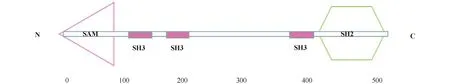
Fig.1 LCP2 protein structure The structural domains of human LCP2 (the accession number: Q13094) were predicted using the online tool SMART(http://smart.embl-heidelberg.de/). SAM: Sterile alpha motif domain, SH2: Src homologous region 2 domain, SH3: Src homologous region 3 domain
在T细胞中,SYK家族的TCRζ链相关70-kD蛋白质激酶(70-kD zeta chain of T cell receptor associated protein kinase, ZAP-70)对LCP2蛋白N-末端的酪氨酸基序进行磷酸化,活化的LCP2与具有鸟苷酸交换因子(guanine nucleotide exchange factor, GEF)活性的鸟嘌呤核苷酸交换因子1(vav guanine nucleotide exchange factor 1,Vav1)、非催化区域的酪氨酸激酶(noncatalytic region of tyrosine kinase, NCK)、白介素2诱导T细胞激酶(IL2-inducible T-cell kinase,Itk)诱导性结合成信号小体。LCP2蛋白的C-末端区域包含所有SLP-76家族蛋白质所共有的结构域。包括黏附和脱粒促进衔接蛋白(degranulation-promoting adaptor protein, ADAP)结合位点、造血祖细胞激酶1(hematopoietic progenitor kinase 1, HPK1)结合位点及SH2结构域[5,6]。该区域属于酪氨酸磷酸化信号传导中心,是识别酪氨酸磷酸化最基本的蛋白质结合模体,含有SH2结构域的蛋白质通常在PTK信号通路上发挥重要作用[7]。LCP2富含脯氨酸区域为SH3结构域,该结构域能够结合磷脂酶C(phospholipase C, PLC)及Grb2相关衔接蛋白2(Grb2 related adaptor protein 2Gads)。Gads通过SH3结构域与LCP2形成组成型结合[8],其SH2结构域与跨膜的T-细胞激活连接蛋白(linker for activation of T-Cell, LAT)的磷酸化酪氨酸残基结合。LAT可以将LCP2从细胞质转移到细胞膜上,并与T细胞相关分子形成1个多分子信号复合体,促进TCR信号转导过程(Fig.2)。

Fig.2 LCP2 takes part in the T cell receptor signaling pathway The T cell receptor signaling pathway of LCP2 in KEGG database (the accession number: hsa04660) was referenced to draw the diagram. SOS: Son of sevenless,LAT: linker for activation of T-Cell, GRB2: growth factor receptor-bound protein 2, Zap-70: 70-kD zeta chain of T cell receptor associated protein kinase, DAG: Diacyl glycerol,Vav1: vav guanine nucleotide exchange factor 1, Lck: lymphocyte cell-specific protein-tyrosine kinase, NCK: noncatalytic region of tyrosine kinase, ITK: IL2-inducible T-cell kinase, Gads: Grb2 related adaptor protein 2, PLCγ1: phospholipase C gamma 1, ADAP: degranulation-promoting adaptor protein, HPK1: hematopoietic progenitor kinase1, PI3K: Phosphoinositide3-kinase, PIP3: phosphatidylinositol 3,4,5-trisphosphate, PDK1: 3-phosphoinositi dedependent protein kinase-1, PKCθ:protein kinase Cθ, Bcl10: B-cell lymphoma/leukemia 10, WASP: Wiskott-Aldrich syndrome protein, cdc42: cell division control protein 42, 14-3-3: 14-3-3 protein epsilon, Ras: rat sarcoma, Raf: rapidly accelerated fibrosarcoma, RasGRP: Ras guanyl nucleotide-releasing proteins
国外有学者将Lcp2完全敲除建立体外Lcp2缺陷小鼠模型[9]发现,T细胞经TCR刺激交联后淋巴细胞特异性蛋白质酪氨酸激酶(lymphocyte cell-specific protein-tyrosine kinase, Lck)和ZAP-70的活化情况无改变,而磷酸酯酶Cγ1(phospholipase C gamma 1,PLCγ1)、Erk、钙通量、NFAT、AP-1及IL-2激活显著降低。敲除模型的T细胞接受佛波肉荳蔻醋酸(Phorbol 12-myristate 13-acetate,PMA)和离子霉素刺激后启动Ras-MAPK反应[10]。这表明,LCP2可以参与多种信号通路调节T细胞相应的免疫功能。
在成熟健康B细胞中,LCP2基本不参与BCR信号通路[11]。研究发现,SLP-76衔接蛋白质家族的第2个成员BLNK与LCP2的结构域高度相似,是参与BCR信号通路的重要成员。BCR接受刺激交联激活后,BLNK的SH2结构域与Igα上的基于免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif, ITAM)磷酸酪氨酸结合,使BLNK向质膜募集。磷酸化的BLNK与PLCγ2的SH2结构域结合,其富含脯氨酸区域则与B细胞中的生长因子受体结合蛋白2(growth factor receptor-bound protein 2,Grb2)结合[12]。但与LCP2不同的是,BLNK的SH2结构域只与HPK1结合,不与ADAP结合。磷酸化的BLNK又将Vav1、NCK和布鲁顿氏酪氨酸激酶(the original identification of Bruton’s tyrosine kinase, BTK)等募集到质膜上,并启动B细胞免疫信号级联反应,促进B细胞信号转导过程。近几年研究发现,弥漫性大B淋巴细胞白血病患者预后效果较差与LCP2在B细胞中异位表达有关[13]。经BCR激活后,LCP2酪氨酸磷酸化显著增强,并降低了BTK、PLCγ2 和IκB等参与BCR信号通路重要信号因子的磷酸化,使BCR信号通路转导受阻,从而强烈抑制了患者的体液免疫能力,导致病情加重。另外,晚期糖基化终产物受体(the receptor for advanced glycation end products,RAGE)是一种能引起感染和炎症的多配体细胞表面受体。在脓血症中,LCP2参与RAGE介导的促炎信号通路。LCP2的SAM结构域与RAGE结合并快速介导下游信号通路激活,从而启动肿瘤坏死因子-α(tumour necrosis factor alpha,TNF-α)、IL-6、高迁移率族蛋白B1(high mobility group protein,HMGB1)的基因转录。上调的HMGB1与RAGE结合,从而放大炎症反应,最终导致脓血症的产生[14]。
2 淋巴细胞胞质蛋白2在恶性肿瘤发生与发展中的免疫调节机制
2.1 LCP2参与NF-κB信号通路促进或抑制肿瘤的发生与发展
近几年,因生活不规律以及外界因素等影响,结直肠癌和前列腺癌患病人群年龄逐年降低[15]。研究表明,LCP2通过调节多种免疫细胞及下游信号因子参与核因子-κB(nuclear factor kappa-B,NF-κB)信号通路,调控结直肠癌和前列腺癌的发生与发展。
研究发现,LCP2与Grb2协同结合蛋白2(Grb2-associated binding protein-2,Gab2)分子在结直肠癌中高表达[16]。高表达的LCP2募集大量 PLCγ1,并产生大量二酰基甘油(diacyl glycerol,DAG),在激活DAG活化蛋白质激酶Cθ(protein kinase Cθ,PKCθ)后,进一步激活NF-κB信号通路,启动IL-1分子的表达,。IL-1是体内重要的促炎因子,从而加剧结直肠细胞的炎症反应,并促进结直肠癌的发生与发展。体外结直肠癌小鼠模型中高表达的LCP2还可以诱导肿瘤坏死因子α诱导蛋白2(tumor necrosis factor, alpha-induced protein 2, TNFAIP2)活化。TNFAIP2是炎症因子TNF-α刺激内皮细胞后表达的主要基因[17]。TNFAIP2产生后,激活P38、NF-κB诱导促炎因子IL- 6和IL-8的合成[18]。通过基因转录调控数据库GTRD及GEO数据库分析结直肠癌患者的基因数据发现,转录激活子(signal transducer and activator of transcription1,STAT1)的表达与LCP2和TNFAIP2的表达呈正相关。活化的STAT1增强了小鼠结直肠细胞中IL-1的表达,促进结直肠炎症细胞向癌细胞发展。
在前列腺癌患者中,其标志物之一是Zn2+浓度在前列腺癌组织中的降低。高浓度的Zn2+可诱导线粒体凋亡,抑制NF-κB信号通路及抑制人前列腺中氨肽酶N和尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,u-PA),从而抑制前列腺癌细胞的增殖和侵袭[19]。利用超生理浓度的Zn2+长期处理前列腺癌细胞发现,ZAP-70激酶、LCP2表达水平较处理之前明显升高,证明前列腺癌细胞中ZAP-70、LCP2的表达与Zn2+浓度呈正相关[20]。同时,长期补充Zn2+的前列腺癌细胞有丝分裂比例降低,细胞增殖缓慢。高浓度的Zn2+使ZAP-70激酶表达量升高,同时促进激活下游因子LCP2的表达。高表达的LCP2通过抑制IκB的表达继而抑制了NF-κB信号通路,降低了促进肿瘤生长因子IL-6、IL-8和TNF-α的表达水平,阻碍了IL-8加快肿瘤细胞浸润进程,进而抑制了前列腺癌细胞的生长和迁移[20]。从细胞培养物中去除高浓度Zn2+即可恢复前列腺癌细胞的癌变增殖率。
以上结果表明,LCP2通过NF-κB信号通路调节肿瘤的生长发育。NF-κB存在于多种细胞内,广泛参与基因的转录调节。NF-κB有5个家族成员,即NF-κB1、NF-κB2、c-Rel、RelA和RelB。NF-κB信号通路的活化依赖于IκB丝氨酸磷酸化途径或IκB酪氨酸磷酸化途径,活化后可以调控先天性和获得性免疫、炎症、应激反应和淋巴器官的生成[21]。近年来,越来越多的研究支持NF-κB在肿瘤细胞的增殖、迁移和凋亡的过程中具有重要作用[22]。在肿瘤细胞中,不同类型分子的改变会导致NF-κB活化受损,NF-κB被组成性激活,使其控制下的基因表达失调[23,24]。
2.2 LCP2通过MAPK信号通路促进或抑制恶性肿瘤的发生与发展
研究发现,膀胱癌中高表达的LCP2能够促进肿瘤细胞形成新的淋巴系统,有助于肿瘤的扩散和侵袭[25,26]。人原代膀胱微血管内皮细胞(human primary bladder microvascular endothelial cells,MEC)中,高表达的LCP2和血管内皮生长因子(vascular endothelial growth factors,VEGFs),并活化Raf原癌基因丝氨酸/苏氨酸蛋白质激酶(RAF proto-oncogene serine/threonine-protein kinase, Raf-1)激活丝裂原活化蛋白质激酶激酶(mitogen-activated protein kinase kinase,MEK)和ERK启动VEGFs和MAPK信号通路,完成膀胱癌中新生血管细胞的增殖过程[27]。同时,LCP2是血小板和中性粒细胞中整合素依赖性细胞反应所必需的,β3亚单位的整合素存在于血小板表面。LCP2连接活化的脾酪氨酸激酶(spleen tyrosine kinase,SYK)与磷酸化的PLCγ2同活化的Src蛋白质一起启动血小板上αIIbβ3整合素的激活,使血小板扩散产生新的血管与淋巴管以促进膀胱癌中肿瘤细胞的生长[28]。术后随访发现,血液中LCP2表达少的膀胱癌患者预后效果较好[29]。
但相反的是,在转移性黑色素瘤和淋巴细胞白血病中,LCP2发挥抑制肿瘤发生的作用[28]。在这2种癌细胞内检测到高表达的LCP2,其通过激活Ras蛋白特异鸟嘌呤核苷酸释放因子1(Ras guanyl nucleotide-releasing proteins,RasGRP1)启动MAPK信号通路,并产生大量免疫调节细胞因子IL-2[30,31]。一方面,过表达的IL-2与NK细胞、B细胞和LAK细胞上的IL-2受体结合,增强机体免疫功能防止肿瘤生长。另一方面,高表达的LCP2会产生更高数量的抗肿瘤免疫细胞CD8+T细胞,CD8+T细胞比活化的CD4+T细胞对癌细胞杀伤作用更大,提高患者的生存率[32]。LCP2的这种双重作用均是通过MAPK信号通路实现的。
MAPK信号通路级联反应是调节包括细胞增殖、分化、血管生成及肿瘤转移过程的中心信号传导元件[33]。ERK、ERK5、c-jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和P38共同构成MAPK家族。其中,ERK/MAPK信号通路是调节细胞生长、发育和分裂的信号网络核心。生长因子、细胞因子、病毒、肿瘤坏死因子、PKC激活剂等多种刺激物都可以激活ERK/MAPK信号通路[34]。当细胞外信号与受体结合时,LCP2的下游分子生长因子受体结合蛋白2(growth factor receptor-bound protein 2,Grb2)与激活的受体、鸟苷酸交换因子(son of sevenless,Sos)富含脯氨酸序列结合形成“受体-Grb2-Sos”复合物,启动ERK/MAPK信号通路,参与肿瘤增殖、侵袭和转移[35,36]。
2.3 LCP2参与JAK/STAT信号通路中促进或抑制恶性肿瘤的发生与发展
在全球所有癌症中,肺腺癌是第2常见的癌症,但死亡率为全球第1。LCP2在肺腺癌细胞中低表达,与患者不良的预后效果成正相关[15]。LCP2在肺腺癌细胞中下调表达[37],T细胞中LCP2激活IL-2,IL-2作为一种重要的免疫调节细胞因子不仅可以抑制CD4+T细胞向炎性TH17细胞的分化,还可以维持CD8+T细胞的多能性,发挥强大的抗肿瘤作用[38,39]。同时,IL-2也是T细胞和NK细胞的生长因子,促进这些免疫细胞的抗肿瘤作用[40],所以低表达的IL-2降低了CD4+T细胞和CD8+T细胞的抗肿瘤功能[41]。在肺腺癌组织中,低表达的IL-2会抑制JAK/STAT信号通路的活性,降低了肿瘤细胞凋亡,从而促进了肺腺癌的发生与发展过程。另有研究[42]发现,在肺腺癌中,高表达的LCP2可以激活细胞粘附分子(cell adhesion molecules, CAMs)以及JAK1/STAT信号通路,调节加强自身免疫能力,发挥减缓肿瘤细胞增殖的作用。
近几年来,研究者在银屑病患者的血液中也检测到炎症标志物LCP2,证实银屑病患者发病期间身体处于炎症状态[43]。同时有研究发现,银屑病患者与健康人群相比,低密度粒细胞(low-density neutrophils, LDG)大幅升高,LDG属于中性粒细胞对内皮细胞具有细胞毒性的作用。银屑病中高表达的LCP2激活促炎因子IL-22、IL-23和IL-27,促使T细胞分化为Th1和Th17两个细胞亚型。Th1细胞分泌TNF-α促进角质细胞的形成,并激活JAK1/STAT3信号通路促进炎症发生。在美国,临床上已利用托法替尼治疗银屑病[44]。托法替尼是一种JAK1/JAK3抑制剂,通过抑制信号通路,减少炎症因子IL-22、IL-23和IL-27的产生。数据表明,62.8%的斑块性银屑病患者在连续服用5 mg托法替尼52周后,银屑病好转率达到75%以上。这也为今后治疗银屑病的药物开发提供了新的方向。
以上研究结果表明,LCP2可以参与Janus激酶/信号转导子和转录激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信号通路,调控肿瘤细胞生长。JAK/STAT是细胞外细胞因子活化受体介导的信号转导核心,参与造血、免疫稳态和细胞增殖分化等过程[45]。JAK/STAT通路由配体-受体复合物JAK和STAT组成,其中JAK家族由JAK 1-3和非受体蛋白质酪氨酸激酶(non-receptor protein-tyrosine kinases, non-receptor PTK)组成,STAT家族由STAT 1-6组成[46]。JAK与不同的细胞因子受体非共价结合,介导受体酪氨酸磷酸化,并募集一种或多种STAT分子以调节不同的生物学功能。JAK/STAT通路过度激活、血清JAK依赖性细胞因子升高,或JAK/STAT发生突变均会使JAK/STAT信号通路失调产生恶性肿瘤和自身免疫性疾病[45,47]。
2.4 LCP2参与PD-1/PD-L1信号通路促进或抑制肿瘤的发生与发展
研究发现,在肺腺癌细胞中LCP2表达量降低,程序性死亡配体1(programmed death-ligand 1, PD-L1)表达量增加[48]。在肺腺癌中,高表达的PD-L1抑制了T细胞增殖和细胞因子的产生;然而,促进LCP2高表达后,可以逆转PD-L1的抑制作用,从而增强了T细胞的激活,减缓癌细胞的增殖。Wang等[49]发现,在持续的抗原刺激环境下,PD-1/PD-L1通路具有明显的致癌作用,在结直肠癌中PD-L1作为受体将抗凋亡信号传递给肿瘤细胞,以保护它们免受凋亡。但与肺腺癌中PD-L1作用不同的是,在结直肠癌组织中促进LCP2高表达时。分析结直肠癌基因表达谱后发现,在DNA错配修复处于正常状态的结直肠癌组织细胞中,比在异常状态的结直肠癌组织细胞中,检测到更高的PD-L1表达[50]。这可能是由于高表达的LCP2增加了CD8+T细胞的浸润,维持了CD8+T细胞的抗肿瘤作用。以上结果表明,高表达的PD-L1通过PD-1/PD-L1信号通路直接抑制免疫细胞增殖促进肿瘤发生发展。
近年的研究发现,肿瘤微环境(tumor microenvironment,TME)可维持肿瘤干细胞活性,有助于肿瘤细胞发展和转移[51]。TME中的免疫分子LCP2成为促炎因子和其他细胞因子TNF-α以及精氨酸酶1(arginase-1,ARG-1)共同调节PD-1/PD-L1信号通路,能够促进肿瘤细胞的增殖[52,53]。Yao等[54]研究表明,TME在识别肿瘤抗原后,髓细胞和巨噬细胞的免疫分子,例如LCP2产生炎症细胞因子IL-12、IL-15和IL-18等协调免疫浸润和免疫反应,使TME表现为免疫抑制和炎症状态。同时,TME中促肿瘤M2表型巨噬细胞可分泌集落刺激因子1(colony stimulating factor,CSF-1),CSF-1活化LCP2结合因子Grb2启动ERK/MAPK信号通路,持续活化的ERK可促进肿瘤细胞生长,发挥促炎作用并促进肿瘤产生新的转移病灶[55]。这说明,LCP2在PD-1/PD-L1信号通路调控肿瘤发生发展方面具有促进和抑制的双重作用,这也为今后LCP2作为肿瘤预测分子提供新思路。PD-L1是协调刺激分子B7家族成员[56],PD-L1很少在正常组织中表达,普遍在多种肿瘤细胞和肿瘤间质中表达[57]。PD-L1促进肿瘤发生发展的机制分为以下2种情况[58,59]。第1种情况,T细胞中高表达的PD-L1会使T细胞耗竭,同时耗竭的CD8+T细胞失去分泌IL-2、IFN-γ和TNF-α等细胞因子的效应功能;第2种情况,PD-L1与PD-1结合形成“PD-1/ PD-L1”TCR抑制性微簇。该微簇可以募集SHP1/2分子,导致TCR信号通路中的多个成员去磷酸化。通过以上2个途径,从而通过诱导细胞凋亡、减少增殖和抑制性细胞因子分泌来阻断T细胞活化,导致T细胞功能障碍或凋亡。LCP2是PD-L1的相关蛋白质,能够抑制PD-L1的表达,发挥抑制肿瘤增殖、侵袭及转移的作用[60]。
3 问题与展望
目前,许多研究已经证实,LCP2参与多种肿瘤的免疫调节,能够调控肿瘤细胞生长和迁移,并与肿瘤的不良预后相关。其具体作用机制涉及多条信号通路,包括NF-κB信号通路、MAPK信号通路、JAK/STAT信号通路以及PD-1/PD-L1信号通路。由于LCP2在不同类型肿瘤细胞中存在高表达或低表达的特点,其有望成为预测特定肿瘤产生的标志物。鉴于LCP2在某些肿瘤细胞内过表达,从而活化炎症因子,进而加快肿瘤的生长及转移的机制作用,可以研究开发以LCP2为治疗靶点的基因治疗或免疫治疗方法。例如,LCP2抑制剂、LCP2基因的分子靶向治疗药物等,为肿瘤的治疗提供新的思路。此外,LCP2在肿瘤预防、肿瘤检测、肿瘤治疗、靶向药物研发方面也有较大的潜能。我们相信,随着研究范围的不断拓展和深入,衔接蛋白质LCP2有望在今后的临床医学及相关肿瘤免疫治疗等方面提供更多的新思路和新方法。
