灭活型保存液对甲型流感病毒核酸检测结果的影响
2024-02-26张明霞孟泽民王卫芳王瑜罗晓旭
张明霞 孟泽民 王卫芳 王瑜 罗晓旭
甲型流感病毒是引起季节性流行性感冒的主要病原体之一,属于正粘病毒科。其基因组由8 股单负链RNA 组成。甲型流感病毒常引起爆发或流行,导致本世纪的四次流感大流行,严重威胁着公共卫生安全[1⁃2]。及时准确地对可疑感染甲型流感病毒的患者标本进行检测,对临床治疗和疫情的控制均具有重要意义[3]。实时荧光逆转录聚合酶链反应(Quantitative Real⁃time PCR,qRT⁃PCR)是流感病毒确诊的主要方法之一[4],在季节性流感或流感大流行中都发挥重要的诊断作用。但病毒核酸提取时可能存在生物安全暴露风险,因此检测前病毒灭活处理尤为重要。目前新型冠状病毒的检测在指南[5]中已经明确可以使用灭活的采样管,但是关于甲型流感病毒无此类检测指南发布。中国国家流感中心发布中国流感流行情况概要,监测数据显示[6],2023 年第9 周南、北方省份流感病毒检测阳性率继续上升。研究者在新冠疫情期间使用甲型流感病毒为替代病毒,对新冠病毒灭活后核酸检测进行了研究,阐明化学灭活剂可以应用在甲型流感病毒的检测中。鉴于2023 年1月底以来流感病毒临床送检样本大量增长,而且阳性检出率高达73%,因而本研究拟通过大量临床阳性标本验证灭活型保存液对甲型流感病毒核酸检测的影响。本研究通过将口咽拭子样本采集、储存在病毒灭活采样管中,采用qRT⁃PCR 方法进行甲型流感病毒的检测,分析灭活采样管和非灭活采样管中甲型流感病毒核酸检测结果,为灭活采样管的临床使用进行初步数据积累,报道如下。
1 资料与方法
1.1 标本采集和处理
收集山西白求恩医院2022 年2 月1 日至3 月1 日拟诊流感的口咽拭子标本。2 377 名患者同时采集两份咽拭子标本,一个拭子放在含有灭活型保存液的采集管中,另外一个拭子放在含有非灭活型保存液的采集管中。每个采集管的标本分别分装到3 个EP 管中,1 管即刻(采集后4 小时内)进行核酸检测,另外两管分别保存在2~8℃和-20℃以下,48 小时后对阳性样本进行核酸检测。采用实时荧光逆转录聚合酶链反应(qRT⁃PCR)方法对其进行病毒核酸检测。结果不一致时采用第二种核酸检测试剂进行比对检测。受试对象纳入标准:年龄≥18 岁,拟诊流感样患者定义标准[1]:发热(腋下温度≥38℃),伴有咳嗽或咽痛之一者。排除标准:年龄<18 岁;采样标本为痰液或其它下呼吸道标本。本研究经院医学伦理委员会批准(YXLL⁃2020⁃02),所有患者均知情同意。
1.2 试剂与仪器
甲型乙型流感病毒核酸检测试剂盒(江苏硕世生物科技股份有限公司,48 人份/盒,批号:T202210001);新冠病毒甲型流感病毒乙型流感病毒核酸检测试剂盒(湖南圣湘生物科技股份有限公司,20 人份/盒,批号:20230110);荧光定量PCR仪(美国Thermofisher 公司,型号ABI7500)。
1.3 采样管、核酸提取和RT⁃PCR 扩增条件
灭活型和非灭活型采样管均购自天津百康芯公司;采用江苏硕世生物科技股份有限公司的甲型/乙型流感病毒核酸检测试剂盒提取病毒RNA,按试剂盒操作说明进行。在ABI7500 型荧光定量PCR 仪上进行RT⁃PCR 扩增,反应条件如下:50℃、30 min →95℃、5 min →95℃、10 s →55℃、40 s(45 个循环)。采用循环阈值(Cycling threshold,Ct)进行计算。试剂盒采用一步法实时荧光RT⁃PCR 技术。每批次实验均同时检测阴性质控品,弱阳性质控品和阳性质控品。
1.4 检测结果判断
①根据试剂盒说明书要求,甲型流感病毒阳性结果的判读标准为FAM 荧光通道有扩增曲线且Ct 值≤34.7,乙型流感病毒阳性结果判读标准为VIC 荧光通道有扩增曲线且Ct 值≤34.8;②甲型流感病毒阴性结果的判读标准为FAM 检测通道无扩增曲线或FAM 检测通道有扩增曲线且Ct 值>34.7,乙型流感病毒阴性结果判读标准为VIC 检测通道无扩增曲线或FAM 检测通道有扩增曲线且Ct 值>34.8。
1.5 统计学方法
采用SPSS 26.0 统计软件进行数据处理。符合正态分布数据的计量资料以()表示,两组间比较采用配对t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 流感病毒阳性检出率及灭活和非灭活组的qRT⁃PCR 结果比较
即刻检测时两组甲型流感病毒的阳性检出率相同,均为74.5%(1 771/2 377),非灭活组平均循环阈值(Ct)值为(29.60±3.99),灭活组为(31.30±2.67),差异无统计学意义(t=0.35,P=0.73)。未检出乙型流感病毒核酸。
2.2 甲型流感病毒阳性标本2~8℃和-20℃分别保存48 小时后的qRT⁃PCR 结果比较
2~8°及-20℃保存48 小时后两组甲型流感病毒的阳性检出率均无变化,非灭活组的平均Ct 值与灭活组比较,差异无统计学意义(P均>0.05)。见表1。
表1 两组阳性标本在不同保存温度下的qRT⁃PCR 结果比较()Table 1 Comparison of qRT⁃PCR results of positive samples in two groups at different storage temperatures()
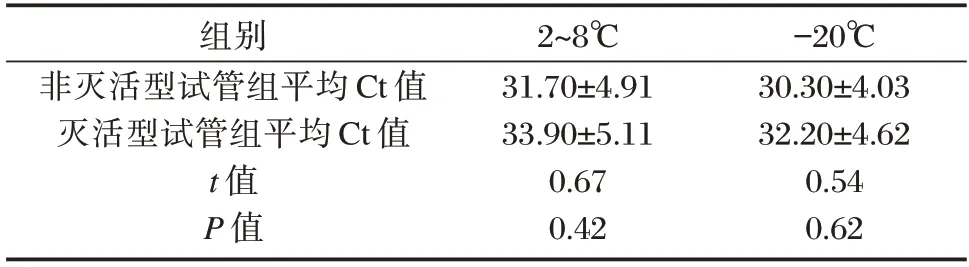
表1 两组阳性标本在不同保存温度下的qRT⁃PCR 结果比较()Table 1 Comparison of qRT⁃PCR results of positive samples in two groups at different storage temperatures()
注:Ct 值为扩增循环阈值。
3 讨论
灭活型采样管在新冠病毒核酸检测中被广泛应用,姜蕾等[7]用热灭活和化学灭活两种不同方法分别处理咽拭子标本,发现56 ℃条件下作用30 min 和胍盐保存液灭活标本对新冠病毒核酸实时荧光qRT⁃PCR 结果无影响。在临床检验方面,为减少实验室操作人员感染传染性及致病性较强的病原体的风险,更多研究关注将标本灭活对核酸检测的影响[8⁃9]。陈培松等[10]研究发现75%乙醇灭活处理后和未灭活处理的新冠病毒标本进行qRT⁃PCR 检测比较,结果一致性良好。
灭活型采样管的方法操作简单、经济,同时不引入其它仪器设备,对样本进行化学灭活病毒的前处理可以降低PCR 检测实验室人员的感染风险。对于化学灭活病毒后是否影响核酸检测效率存在不同意见[11],而关于甲型流感病毒这方面的研究资料较少,因此灭活型保存液灭活手段对甲流病毒核酸检测影响的评估尤为迫切和重要,因为此工作的完成有利于加强PCR 实验室对高生物安全风险样本的处置管理,同时能更好地满足甲流感染的临床诊断和鉴别诊断的客观需要。
2023 年1 月29 日以来,研究者所在的实验室甲型流感病毒阳性检出率大为增加,为本次研究提供了较好较多的临床样本。关于甲型流感病毒灭活后进行核酸检测的研究不多,而且临床标本数量较少[12],用大量临床阳性标本验证灭火病毒采样管的研究不多见,因而研究者开展了本项研究。本实验室对灭活型采样管采集的标本进行病毒核酸检测的大样本研究中发现,对口咽拭子标本采用加胍盐化学灭活后再进行流感病毒的qRT⁃PCR 检测,对结果无明显影响;而且在2~8℃或者-20℃以下的条件下,至少可以稳定保存48 小时,对于无法立即进行检测的标本,提供了保存条件的选择。但本研究亦存在不足之处:①由于检验科条件限制,不能进行灭活后病毒培养工作,从而无法评估此条件下的病毒灭活效率;②对于甲型流感病毒的阳性标本,由于受样本量的限制,未分装标本进行评估常温条件下的保存时间,以及2~8℃或者-20℃以下更长的保存时间对检测结果的影响。根据本研究结果提示,尽管差异未达到统计学意义的程度,但是在冷藏条件的保存48小时,核酸检测结果的Ct值有增大的趋势。
病毒核酸检测具有窗口期短,灵敏度高,特异性强的优点,但在临床实验室操作过程中可能会因职业暴露而对医务人员造成感染。灭活型采样管的使用可也在很大程度上降低感染风险,因此研究者希望灭活型采样管在病毒检测方面的应用越来越广泛,并且采样管既能有效灭活病毒,又不对其扩增反应产生影响,为当下以及以后可能的病毒感染检测做好准备。
