甲醇/正庚烷混合燃料自燃特性实验与数值模拟研究
2024-02-25张东王秋凯李兴奇王自鑫冯立岩
张东,王秋凯,李兴奇,王自鑫,冯立岩
大连理工大学 能源与动力学院,辽宁 大连 116024
以可再生能源制取的绿色甲醇是一种碳中和燃料。推广绿色甲醇应用对于实现碳中和、碳达峰战略目标意义重大[1]。甲醇具有燃烧清洁、储运方便、抗爆性好等优点,是一种优质替代燃料。然而,甲醇的十六烷值低,难以自燃,在发动机中燃用甲醇时需要采用火花塞点燃或者微量喷射柴油引燃[2]。对于缸径大、转速低的船用甲醇发动机,火花塞无法提供足够的点火能量,必须采用柴油引燃的方式。微量喷射柴油引燃的甲醇发动机主要包括低压喷射甲醇的预混合燃烧模式[3−4]与高压喷射甲醇的扩散燃烧模式[5]。此外,甲醇/柴油双燃料机还可以根据不同港口的燃料加注条件自由选择以甲醇或者柴油为主燃料工作。因此,船用甲醇发动机以甲醇/柴油双燃料机为主要形式。MAN 公司的ME-LGIM 甲醇/柴油二冲程双燃料机即采用在原柴油机缸盖加装甲醇喷射系统,以实现原柴油机到甲醇/柴油双燃料机的转换[6]。甲醇/柴油双燃料机性能的改善则依赖于对甲醇/柴油燃烧特性的深入理解。由于甲醇/柴油双燃料机的燃烧涉及甲醇和柴油混合物的自燃过程和火焰传播过程,其复杂性较高,需要通过燃烧基础实验和燃烧数值模拟等研究方法深入理解甲醇/柴油的自燃特性和燃烧特性。甲醇/柴油燃料自燃特性的基础实验研究为甲醇/柴油燃料着火性能研究提供重要的基础数据,同时也为燃烧数值模拟研究的反应机理提供标定依据。柴油组分众多且复杂,因此一般选用与之十六烷值近似的正庚烷替代其进行自燃特性研究。详细反应机理规模过大,需要经过简化以应用于发动机燃烧计算中。简化过程为:将经过验证的化学动力学机理应用于化学动力学分析,通过反应速率与敏感性分析等化学动力学分析方法得出反应过程中的关键物质与反应,将机理中的关键物质与反应保留而去除多余的物质与反应即得到骨架机理。骨架机理需要重新经过实验数据验证。同时,针对单一燃料提出的反应机理(如爱尔兰国立大学(National University of Ireland,NUI)的正庚烷详细机理[7])应用于混合燃料的化学动力学分析仍然需要混合燃料的自燃特性实验数据进行验证。
近年来,研究人员应用激波管和快速压缩机等基础实验设备开展了甲醇单一燃料和甲醇/柴油替代物(本文采用正庚烷)燃料自燃特性研究。其中,快速压缩机的工作过程及温度压力最贴近发动机,是自燃特性研究的重要实验设备。Kumar 等[8]、Wang 等[9]和Burke 等[10]分别应用激波管、快速压缩机、流动反应器等实验设备进行了甲醇自燃特性研究。将实验测得的滞燃期与组分浓度等数据与机理预测数据进行对比,并对甲醇的化学动力学机理进行发展。一些研究机构和学者针对正庚烷自燃特性进行了研究[11−12],并且提出了相应的动力学机理。Li 等[13]利用激波管进行了高温低压条件下甲醇/正庚烷混合物自燃特性研究。研究发现,在当量比Φ=1 时,甲醇比例增加会使滞燃期缩短,这是由于其增加了关键基团超氧化氢(HO2)。HO2随后分别与燃料和氢基(H)反应,造成自由基池的爆炸性增长。然而其高温低压实验工况与甲醇/柴油双燃料机的高压低温实验工况相差较大。Zhu 等[14]采用加热激波管与加热快速压缩机进行了甲醇/柴油(由正十六烷、异十六烷、1-甲基萘组成的柴油替代物)混合物的滞燃期测量。研究结果表明甲醇添加对于混合燃料的自燃具有非线性抑制作用。Wu 等[15]利用激波管、快速压缩机与定容弹进行了甲醇/正庚烷滞燃期与层流火焰速度的测量,对于研究甲醇/柴油双燃料机的燃烧特性具有重要的意义。然而,Zhu 与Wu 等对于不同甲醇/柴油(或正庚烷)混合比例的混合气,其仅进行了当量比为1 情况下的滞燃期测量。对于缸内直喷的甲醇/柴油双燃料机来说,其燃烧形式为扩散燃烧,缸内不同位置混合气混合比例差异较大。因此,需要对于更宽广范围的实验工况与甲醇/正庚烷混合比例下的混合气自燃特性进行研究。
综上所述,双燃料机工作条件下的燃料自燃特性对于其燃烧特性分析与燃烧机理的优化具有重要的意义,然而目前国内外对于甲醇柴油双燃料的相关研究相对较少。为阐述甲醇/柴油双燃料机在着火及燃烧过程中燃料间相互作用,为甲醇双燃料机燃烧机理的优化提供理论指导,本文采用快速压缩机,以正庚烷作为柴油替代物,研究了温度(630~910 K)、压力(1.5~3.2 MPa)、不同甲醇/正庚烷比例(25/75、50/50、75/25、90/10)与当量比(0.67~4.00)下甲醇/正庚烷气相混合物的着火特性。根据实验数据验证了NUI 的正庚烷详细机理,进而进行化学动力学分析,探究甲醇/正庚烷着火过程中的相互作用机理,得出氧化过程中的关键物质与反应。
1 自燃特性实验与模拟方法
1.1 快速压缩机
实验采用自主搭建的快速压缩机,其主要参数与示意分别如表1 和图1 所示。

图1 快速压缩机示意

表1 快速压缩机主要参数
快速压缩机是模拟内燃机压缩过程,提供定容燃烧环境的实验装置。快速压缩机试验台分为驱动系统、液压系统、燃烧系统、配气系统、数据采集系统5 个部分。高压气罐作为驱动系统的动力来源,将运动部件迅速推进到上止点。液压系统确定活塞的下止点,并在活塞到达上止点前起缓冲作用。燃烧缸是快速压缩机的核心部分,是混合气自燃发生和监测压力的区域。实验采用缝隙活塞以抑制燃烧缸内卷生涡流,确保燃烧缸内温度均匀性[16]。数据采集系统由气缸压力传感器AVL GH14DK、电荷放大器AVL 2P2x、NI 采集设备CRIO-9 042 组成,记录燃烧缸内缸压变化。有效压力与有效温度作为滞燃期测量对应的物理条件[17−18]。有效压力peff的定义为上止点压力pmax与由于热损失而造成的压力下降的最低值pmin之间的压力积分平均值,有效温度Teff依据绝热压缩积分计算得到,即
式中:p0、T0分别为初始压力和初始温度, γ为混合气与温度相关的比热比。通过改变p0、T0或压缩比进而改变peff与Teff。图2 是燃烧缸内压力曲线与滞燃期定义。其中,非反应压力曲线是将混合气中氧气替换为氮气,用来模拟上止点后的热损失。0 时刻为活塞到达上止点时刻。一阶段滞燃期τ1和总滞燃期τ分别定义为上止点时刻与第一阶段放热和燃料燃烧造成的压力上升斜率最大值对应时刻之间的时间间隔[19]。

图2 实验压力曲线与滞燃期定义
1.2 混合气制备
混合气储存在由304 不锈钢制成的20 L 混气罐中,各组分比例遵循道尔顿分压定律。配置实验混合气前,需要先将混气罐加热到初始温度。甲醇与正庚烷的分压力分别低于其饱和蒸气压的1/3,以确保其不会出现冷凝现象。实验采用的氮气、氧气、氩气的纯度为99. 99%。为了表征不同工况下扩散燃烧缸内不同区域混合气比例与浓度的差异,本文进行了宽广实验条件下的混合气自燃特性研究,混合气的具体配比如表2 所示。图3 是MAN LGI 甲醇柴油机,图4 是对应的甲醇柴油喷油示意。图4 中数字分别对应表2 混合气比例,忽略燃料喷束外的燃料浓度极低部分。甲醇与柴油油束交汇处为燃料最浓区,向外扩散燃料浓度逐渐降低,最外圈到最内圈分别设置当量比为0.67~4.00,同一圈内(即相同当量比下)从左向右柴油浓度逐渐降低,分别设置25/75、50/50、75/25、90/10 以表示不同位置甲醇/柴油混合比例的差异。

图3 MAN LGI 甲醇柴油机

图4 甲醇柴油喷油示意
每次试验开始前,首先将燃烧室抽至真空状态,然后将混气罐中的混合气充入燃烧室中。电动液压泵在液压缸中建立高压油压,使活塞固定在下止点。待电动蝶阀完全开启后,利用电磁阀关闭电动液压泵,活塞在驱动压力作用下迅速到达上止点并保持在上止点,形成定容燃烧环境。
1.3 设备有效性与动力学模型
为了验证实验设备的有效性,首先进行了单一正庚烷自燃特性的验证实验。实验上止点压力为1.5 MPa,混合气中正庚烷占比0.95%,O2占比10.45%,氩气与氮气共占比88.6%,如图5 所示。为了更好地拟合阿伦尼乌斯公式,对于纵坐标滞燃期做对数处理,对横坐标温度做1 000/T(1 000β)处理。在相近实验条件下,将本文的实验数据与Yu 等[20]的研究结果进行对比,本文的滞燃期测试结果及变化趋势与其基本一致,体现了设备的有效性。燃烧过程的模拟采用CHEMKIN PRO 软件,选用的计算模型为封闭零维均质反应器模型,求解定容绝热能量方程。由于正庚烷机理中包含甲醇子机理,因而在模拟过程中采用正庚烷机理即可。准确的动力学模型对于化学动力学分析十分重要,本文研究选用的动力学机理是NUI 的详细正庚烷机理。该机理中包含1 252 种物质与基团、5 336个反应。该机理针对单一正庚烷燃料提出,对于甲醇/正庚烷混合燃料滞燃期的预测能力需要进行验证。在模拟过程中采用等效容积法[18]计算滞燃期,即将上止点后由于热损失而造成的压力下降转化为容积的变化,使计算更加精准。

图5 实验数据与参考文献中数据的比较
2 自燃特性实验结果及数值模拟
2.1 实验结果
2.1.1 不同压力下CH3OH/n-C7H16物质的量比变化对于滞燃期影响
图6 是在Φ=1 与Φ=2、压力分别为15、3.2 MPa下,滞燃期随混合气中甲醇/正庚烷物质的量比例变化的情况。由图6 可知,NUI 机理可以预测到滞燃期变化趋势,并且对于滞燃期数值预测准确性较高,可以用于后续的化学动力学分析。在2 种当量比与压力下,混合气中甲醇与正庚烷物质的量比为25/75、50/50 时,均观测到负温度系数(negative temperature coefficient,NTC)区域,而混合气中甲醇与正庚烷物质的量比为75/25、90/10时,基本没有NTC 区域。在试验温度区间内,随着混合气中甲醇比例的增加,系统反应活性降低,滞燃期增加。随着温度升高,不同物质的量比例混合燃料的滞燃期逐渐接近。根据图6(a)、图6(c)和图6(b)、图6(d)对比可以发现,压力升高可以显著降低滞燃期。这是由于压力升高可以增加分子碰撞频率,从而加速反应,缩短滞燃期。

图6 不同甲醇/正庚烷摩尔比下滞燃期
2.1.2 当量比变化对于滞燃期影响
图7 是在压力为3.2 MPa,甲醇/正庚烷摩尔比例分别为25/75、50/50、75/25、90/10 下,滞燃期随混合气当量比变化的情况。由图7 可知,在实验工况下,随着当量比的增加,混合气滞燃期缩短,这与甲醇/正庚烷混合物在高温工况下的情况有一些不同。在高温工况(T>1 200 K)下,甲醇/正庚烷物质的量比例为30/70、50/50 时,Φ=1 比Φ=0.5时滞燃期长;而甲醇/正庚烷物质的量比例为70/30、90/1 时,Φ=1 比Φ=0.5 时滞燃期短[13]。这是由于甲醇与正庚烷在高温与低温下反应活性差距不同导致的。同时,根据图7(b)可以发现,随着当量比增加到一定程度,滞燃期下降程度变缓。
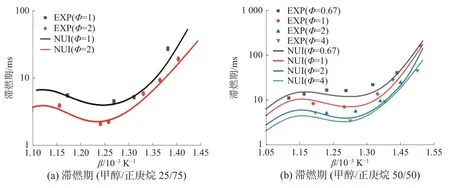
图7 不同当量比下滞燃期
2.1.3 两阶段燃烧
正庚烷自身燃烧具有两阶段燃烧表现,甲醇与正庚烷混合气中正庚烷比例较高时仍然具有两阶段燃烧表现。图8 是压力为1.5 MPa、甲醇/正庚烷物质的量比例为25/75、50/50、当量比分别为1、2 时的一阶段滞燃期数据。1.5 MPa 下,甲醇比例为25%与50%的混合气的一阶段滞燃期均没有NTC 表现,即其他条件相同时,混合气一阶段滞燃期随着温度升高而降低。随着当量比增加,混合气一阶段滞燃期降低;随着混合气中正庚烷比例的增加,一阶段滞燃期降低。对比可以发现,混合气中正庚烷所占比例对于一阶段滞燃期的影响要大于当量比。
自燃特性实验数据可以体现双燃料机缸内不同区域混合气自燃规律,同时,也为反应机理的验证提供依据。反应机理经过验证可用于化学动力学分析,得出反应过程中的关键物质与反应,为骨架机理的搭建提供理论依据。
2.2 数值模拟结果
2.2.1 化学动力学分析
为了进一步探究甲醇/正庚烷混合气的自燃特性,首先进行了一些关键自由基与基团的摩尔浓度随时间变化的数值分析。图9 是900 K、3.2 MPa 条件下各自由基与物质及温度变化情况。值得注意的是,甲醇与正庚烷均在燃烧前反应完全,正庚烷总反应速率持续增大,而甲醇总反应速率前期非常缓慢,后迅速增长超越正庚烷直到反应完全。
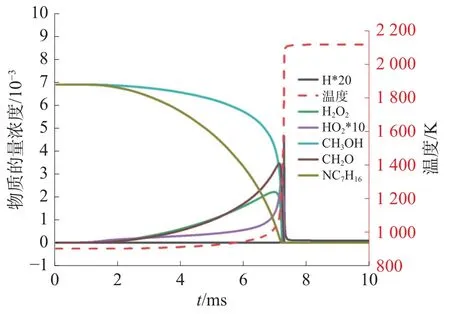
图9 物质的量浓度及温度变化情况
2.2.2 反应速率与敏感性分析
通过反应速率与敏感性分析可以进一步探究甲醇正庚烷混合气氧化过程的关键反应。对于甲醇正庚烷(25/75、50/50、75/25、90/10)、当量比1 和2、稀释比90%N2的混合气在900 K、3.2 MPa进行反应速率与敏感性分析。反应速率分析表明了影响各组分生成或消耗最大的化学反应的反应速率随时间的变化情况。反应速率为正表示生成该物质,负表示消耗。标准化敏感性系数用来表征影响着火过程的反应,定义为
式中:ki为动力学机理中第i个反应的反应速率常数。各反应与NUI 机理中反应序号对应。敏感性系数为正表示降低系统反应活性,延长滞燃期,为负表示提高系统反应活性,缩短滞燃期。
图10 和11 分别为900 K、3.2 MPa 下正庚烷与甲醇反应速率变化情况。表3 为正庚烷与甲醇生成与消耗的主要反应。由图10 可知,不同甲醇正庚烷比例与不同当量比下,正庚烷氧化过程中主要反应基本相同。当前条件下脱氢反应是正庚烷消耗速率最快的反应。其中,正庚烷与OH 的脱氢反应(R4209、R4210、R4211、R4212)是正庚烷氧化过程中的主导反应,其次是同H 和HO2的脱氢反应(R4201、R4202、R4203、R4204、R4218、R4219)。燃烧前,脱氢反应的反应速率持续增大,使正庚烷总体消耗速率持续增大。
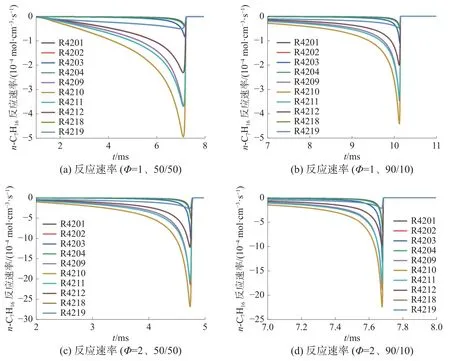
图10 正庚烷反应速率变化情况
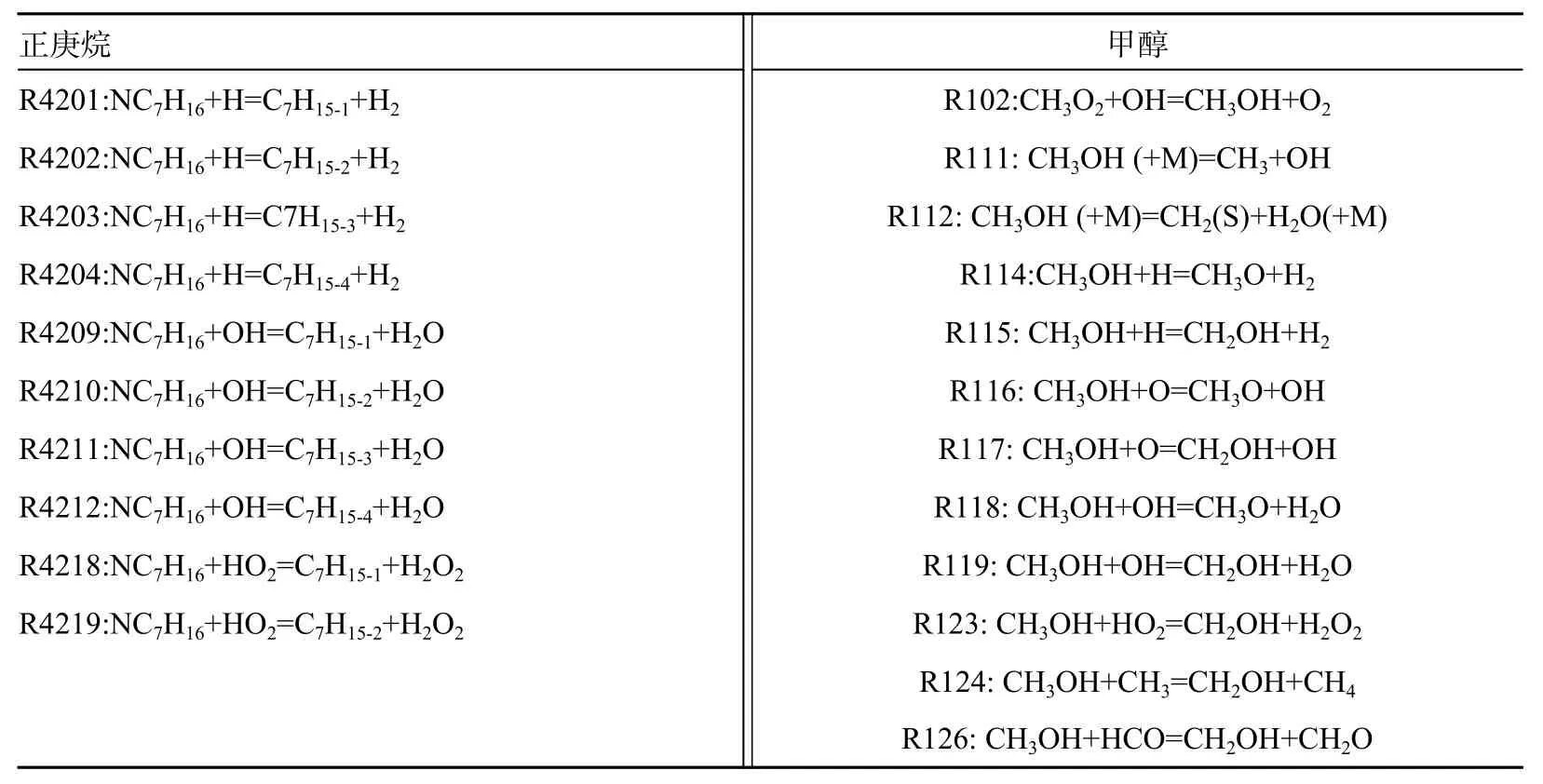
表3 正庚烷与甲醇生成和消耗的主要反应
如图11 所示, 甲醇含量较低时, R111(CH3OH (+M)=CH3+OH(+M))反应生成甲醇的反应速率相对较大,因此甲醇在反应初期消耗速率较慢。R119(CH3OH+OH=CH2OH+H2O)反应消耗甲醇,这2 个反应是甲醇氧化过程中的重要反应。R119 是甲醇与正庚烷竞争OH 基的主要反应,对于整体自燃反应具有抑制作用。相同当量比下甲醇比例增加会加剧对于H、OH 等自由基的竞争,降低正庚烷的反应速率,抑制系统氧化过程。当量比增加使甲醇(R119 等)与正庚烷(R4218、R4219 等)反应速率均加快,但是正庚烷相关反应对于系统反应促进程度更明显,因此滞燃期缩短。
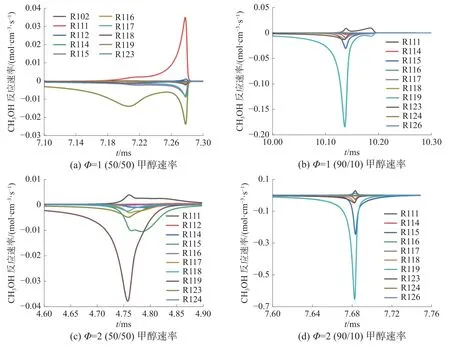
图11 甲醇反应速率变化情况
图12 是H、OH 等关键自由基反应速率变化情况。其中,H 主要来源于燃料,后期通过甲醛(formaldehyde,CH2O)、氧气(O2)等小分子进行生成与消耗反应。 OH 的主要生成反应是R21(H2O2(+M)=2OH(+M)),主要消耗反应是与CH2O 进行的脱氢反应(R156)。由图12 可知,HO2和CH2O 与甲醇正庚烷存在小分子自由基(H、OH)的竞争关系,并且反应速率快得多。

图 12 关键物质反应速率变化情况
图13 是900 K、3.2 MPa 甲醇/正庚烷(25/75、50/50、75/25、90/10)当量比分别为1 和2 的标准化敏感性系数。由图13 可知,在该工况下,甲醇/正庚烷混合物对于反应R32 最为敏感,并且R32 的HO2生成稳定的H2O2降低系统反应活性。正庚烷与HO2基的脱氢反应(R4218、R4219、R4220)、与OH 的脱氢反应(R4209)均有利于提高系统反应活性,并且随着混合气中正庚烷比例的增加,提升程度更大。H2O2的分解反应(R21)生成活跃的OH,是促进系统氧化过程进行的重要反应。甲醇与OH 基的脱氢反应(R119)敏感性系数为正,阻碍系统的自燃过程。该反应(R119)在甲醇与正庚烷比例相近时(50/50、75/25),对于系统氧化过程的抑制程度更强。正庚烷氧化中间产物的β 分解(R4315、R4316、4318)对于系统的氧化过程具有抑制作用。

图13 标准化敏感性系数
3 结 论
1)本文利用快压机实验平台测量了甲醇/正庚烷(25/75、50/75、75/25、90/10)在1.5~3.2 MPa、630~910 K、当量比0.67~4.00 下的滞燃期数据。在实验温度压力区间内,部分混合气具有NTC 现象。在低温工况下,总滞燃期随压力升高而降低。总滞燃期与一阶段滞燃期随当量比增加而降低、随混合气中甲醇所占比例增加而增加。其中,当量比增加到一定程度,滞燃期下降减缓。
2)化学动力学分析中,低温工况下,正庚烷主要通过OH 进行脱氢反应,其次是H、HO2,提高系统反应活性。甲醇作为燃料,同时是正庚烷氧化路径上的组分。甲醇初始浓度较低时,氧化过程中有一部分甲醇生成,而甲醇初始浓度较高时,氧化过程中生成的甲醇基本可以忽略。甲醇与正庚烷存在OH 的竞争关系,这也是低温下混合气中甲醇含量越多滞燃期越长的原因。同时,R21 反应生成OH,是重要的促进系统氧化过程进行的反应。R32 反应HO2生成稳定的H2O2是系统氧化过程中最敏感的反应。
本文进行的自燃特性研究有助于对现有的化学动力学模型进行检验和验证,后续将进一步得到适用于甲醇柴油双燃料机燃烧计算的骨架机理。
